Les différents états de surfaces
 Les implants utilisés en dentisterie sont désormais accessibles dans différents matériaux avec un diamètre, une longueur et une plate-forme variables. Ils possèdent aussi différents états de surface avec des propriétés variables ainsi que des revêtements différents. Il existe différentes procédures de traitement des surfaces implantaires qui ont pour objectif d’améliorer la performance clinique (Esposito et al. 2012).
Les implants utilisés en dentisterie sont désormais accessibles dans différents matériaux avec un diamètre, une longueur et une plate-forme variables. Ils possèdent aussi différents états de surface avec des propriétés variables ainsi que des revêtements différents. Il existe différentes procédures de traitement des surfaces implantaires qui ont pour objectif d’améliorer la performance clinique (Esposito et al. 2012).
Les surfaces usinées
Une surface usinée présente un aspect relativement lisse. Elle forme des pics et des vallées qui concourent à une légère rugosité. Cette rugosité (Ra) varie entre 0,53 et 0,84 µm (Wenneberg et Albrektsson, 2000) selon les conditions d’usinage. C’est l’état de surface avec lequel les études initiales de l’équipe suédoise ont été élaborées entre les années 60 et 80 (Fig. 1 et 2).
Les surfaces traitées par addition
Projetât par la torche à plasma
Les surfaces rugueuses sont le résultat d’un revêtement obtenu par plasma-spray de titane ou d’hydroxyapatite. Ce traitement était réalisé dans les années 1980-2000, mais il a cédé sa place aux procédés chimiques de mordançage et donc par soustraction. La rugosité du plasma-spray de titane varie entre 2,1 (Wennerberg et al. 1993) et 3,1 µm Buser et al. 1998). Pour le plasma-spray d’hydroxyapatite, le Ra varie entre 1,59-2,94 µm (Wennerberg et al. 1993), selon les conditions de traitement.
Ex : TPS (Straumann®).
Les surfaces traitées par soustraction
Sablage
Le sablage consiste à bombarder la surface du titane à l’aide de particules très dures. Celles-ci créent des rugosités en impactant la surface. Le sablage est classiquement réalisé à l’alumine, mais il peut aussi être réalisé à l’oxyde de titane ou à partir de particules de céramique telles que le phosphate tricalcique.
La rugosité de surface dépend du matériau et de la taille des particules de sable. Le Ra des surfaces sablées à l’oxyde de titane varie de 1,05 (Godfredsen, 2000) à 1,09 µm (Wennerberg, 2000).
Celui des surfaces sablées au phosphate tricalcique est de 0,9 µm (Sanz et al. 2001).
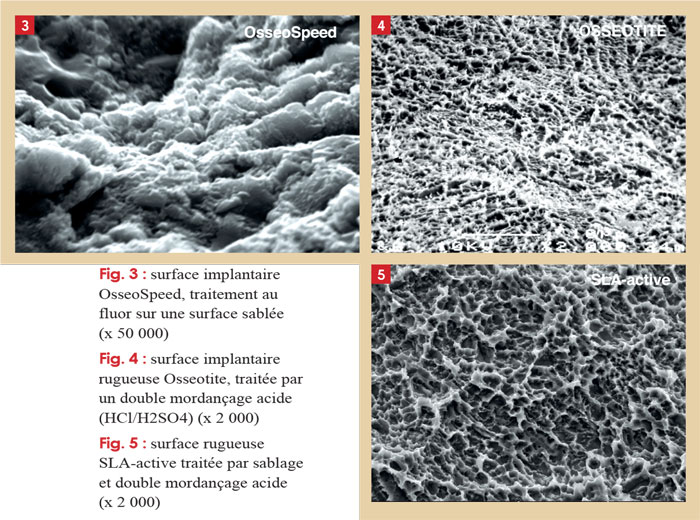
Ex : TiOblast (Astra Tech ® ) : sablage à l’oxyde de titane, Nanotite (Biomet 3i ® ) : sablage au phosphate tricalcique, OsseoSpeed (Astra Tech ® ) : sablage à l’oxyde de titane et traitement chimique à l’acide fluorhydrique (Fig. 3).
Mordançage
Le mordançage consiste à corroder violemment la surface du titane à l’aide d’acides forts. L’attaque du titane ne progresse pas uniformément, elle crée des pores irréguliers, propices à la croissance osseuse et à l’ancrage micromécanique. L’attaque chimique peut être précédée ou non d’un sablage.
La rugosité de surface est différente selon qu’un sablage préalable a eu lieu ou non. Sans sablage, le Ra des sur – faces mordancées est de 0,4 à 1,09 µm. Avec sablage, il varie de 1,44 à 2 µm (Wenneberg et Albrektsson, 2000, Buser et al. 1998).
Ex: Osteotite (Biomet 3i®), SLA (Straumann) (Fig. 4 et 5).
Oxydation anodique
Le principe est d’oxyder fortement la surface des implants en titane. Cela fait croître une couche épaisse d’oxyde TiO 2 . Au-delà d’une certaine épaisseur, la couche d’oxyde croît de manière irrégulière, une ru – gosité se développe sous la forme de cratères de 1 à 2 µm de hauteur sur quelques microns de largeur. La croissance de la couche est réalisée en immergeant les implants dans un bain oxydant et en les soumettant à un courant où ils peuvent jouer le rôle d’anode.
Le Ra des surfaces soumises à l’oxydation anodique varie entre 1,35-2,0 µm (Sul et al. 2006, Albrektsson et Wennerberg, 2004).
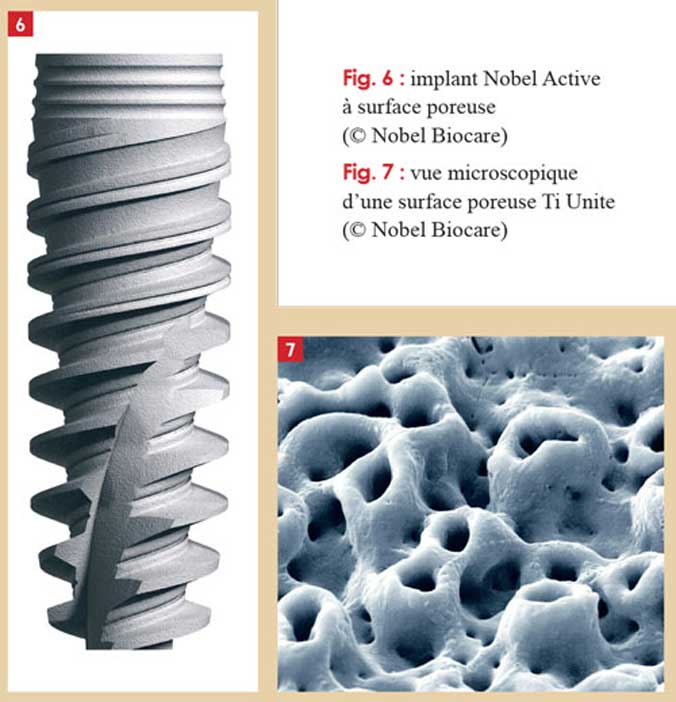
Ex : TiUnite (Nobel Biocare ®) (Fig. 6 et 7) .
Ces différents états de surface jouent un rôle dans l’ostéointégration des implants, car les implants rugueux ou poreux présentent une réaction osseuse de type trabéculisation, ce qui favorise l’ostéointégration par rapport aux surfaces usinées. Dans les phénomènes de péri-implantites, les implants rugueux favoriseraient leur empêcherait l’élimination correcte des bactéries lors d’un nettoyage professionnel.
Plusieurs questions peuvent se poser : y a t-il un lien entre les types de surface implantaire et l’apparition de la péri-implantite ? Est-ce que la réponse au traitement diffère selon le type d’implant ?
Tendances des futures surfaces implantaires
Les surfaces implantaires peuvent être revêtues d’agents stimulant la croissance osseuse, comme les facteurs de croissance afin de stimuler la cicatrisation osseuse. On retrouve les protéines morphogénétiques (BMP), les facteurs de croissance transformant (TGF-1), le facteur de croissance dérivé des plaquettes (PDGF) et le facteur de croissance analogue à l’insuline (IGF-1 et 2).
La surface des implants pourrait également être chargée avec des molécules contrôlant le processus de remodelage osseux. L’incorporation des inhibiteurs de la résorption osseuse, tels que les biphosphonates, pourrait être très pertinente dans certains cas cliniques compromis, comme la résorption avancée des crêtes alvéolaires.
Le mélange des antibiotiques avec des ciments osseux polyméthylméta-acrylate (PMMA) a fourni des concentrations locales d’antibiotiques pendant une période de temps prolongée (Pattanaik et al. 2012).
Relation entre états de surface et développement de la péri-implantite
Une étude rétrospective (Charalampakis et al. 2011) chez l’homme a suivi des implants de leur pose au développement de la maladie et a mis en évidence une association significative entre l’état de surface de l’implant et le développement de la péri-implantite. Les résultats sont dans le tableau 1.
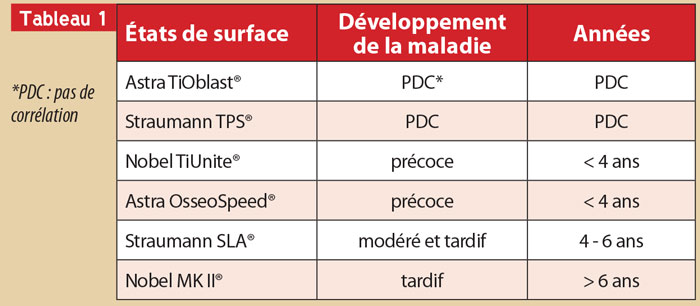
On constate que les surfaces usinées sont associées au développement tardif de la maladie. Pour les surfaces rugueuses, certaines sont associées au développement précoce, d’autres non, mais aucune explication n’est fournie.
Ces associations précitées doivent être interprétées avec prudence, du fait de l’analyse rétrospective des données. Ces résultats doivent être étudiés de manière plus approfondie par des essais cliniques prospectifs randomisés, ce qui est très difficile à réaliser d’un point de vue méthodologique.
L’apparition de péri-implantites est statistiquement plus importante autour des implants avec des surfaces rugueuses sur une période de 3 ans. Mais, à partir de 5 ans après la mise en charge, l’écart diminue car les surfaces usinées sont concernées par le développement tardif de la maladie (Esposito et al. 2008).
Relation entre états de surface et réponse aux traitements
Tout d’abord il faut savoir qu’il existe différentes stratégies thérapeutiques :
- l’approche non chirurgicale qui s’est révélée inefficace dans le traitement de la péri-implantite
- l’approche chirurgicale qui a montré un taux de succès relatif et qui est décrite comme une procédure efficace par Renvert et al. (2012) ; cette approche peut s’accompagner d’une procédure de résection qui permet d’obtenir de bons résultats ou de procédures de régénération qui semblent efficaces par la présence d’un comblement radiographique, mais actuellement les preuves manquent (Renvert et al. 2012)
Le problème est que les études n’ont pas encore réussi à déterminer quel est le meilleur moyen pour décontaminer la surface implantaire, notamment en fonction du type de surface.
C’est pourquoi chez l’homme on ne peut pas encore démontrer l’impact du type de surface sur les résultats des traitements.
On ne sait pas quelle décontamination de surface est la plus efficace (laser, aéropolisseur, curetage, irrigation, traitement antimicrobien) et sur quel type de surface. Mais les études laissent penser que les surfaces usinées sont plus faciles à décontaminer que les surfaces rugueuses.
Que disent les études animales ?
Les études suivantes suggèrent que les caractéristiques de surface des implants influencent la progression de la péri-implantite induite chez le chien (tableau 2).
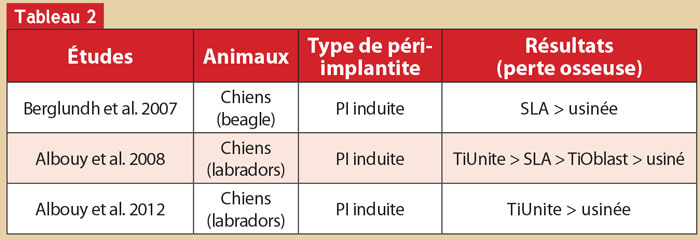
Albouy et al. (2011) analysent l’effet d’un traitement chirurgical sans antibiotique sur une péri-implantite, sur différents types d’implants. Leurs résultats montrent un gain osseux autour des implants avec une surface usinée, TiOblast et SLA. Tandis qu’autour des implants TiUnite, on observe une perte osseuse supplémentaire après le traitement. On constate également la persistance d’une lésion inflammatoire dans les tissus mous autour des implants SLA seulement. Ces résultats sont à prendre avec beaucoup de prudence, la méthodologie de l’étude est discutable et l’extrapolation avec les résultats cliniques est très délicate.
Persson et al. (1999) étudient aussi le traitement chirurgical de la péri-implantite autour des implants avec une surface SLA et usinée. Ils obtiennent des résultats différents, avec la résolution des lésions péri-implantaires pour les deux types d’implants.
La raison de cette différence pourrait être due à l’utilisation d’une antibiothérapie systémique dans son protocole.
Après le traitement peut-on obtenir une ré-ostéointégration ?
Renvert et al. (2009) analysent la littérature à travers plusieurs études animales et concluent que la ré-ostéointégration d’une surface implantaire contaminée est possible chez l’animal, cela a été démontré histologiquement.
Cette ré-ostéointégration dépend des caractéristiques de surface de l’implant, sachant qu’elle est plus importante pour des implants à surface rugueuse (Wetzel et al. 1999).
Mais actuellement aucune méthode chirurgicale pré- dictible n’a été mise en évidence pour obtenir une ré-ostéointégration. Selon Persson et al. (2001), les surfaces rugueuses pourraient fournir un support pour le développement du caillot après la chirurgie, ce qui faciliterait la cicatrisation au contact de la surface implantaire.
Renvert et al. (2011) constatent tout de même un manque d’études sur l’effet des surfaces implantaires au niveau de la péri-implantite. Et selon eux, les preuves suggérant que les caractéristiques de surface peuvent avoir un effet sur la progression et le traitement de la péri-implantite établie chez l’animal, restent limitées. De plus ces données peuvent être critiquées.
La reproductibilité des études animales chez l’homme
Faggion (2009) évalue la réplication des données de recherche, de l’animal à l’homme, dans les études sur le traitement de la péri-implantite. La réplication consiste à réexaminer les résultats dans une seconde expérience en utilisant la même méthodologie que celle employée lors de la première.
Les résultats montrent qu’il n’a pas été possible de comparer une étude humaine directement avec son homologue animale, car ces études n’utilisent pas exactement les mêmes procédures pour un même traitement. Cette revue suggère que les résultats de l’expérimentation animale sur la péri-implantite ne peuvent pas être extrapolées chez l’homme en raison des différences entre les espèces et de la variabilité des conceptions d’étude. Faggion (2010) a aussi démontré que les études animales rapportent des effets de traitement meilleurs que les études réalisées chez l’homme. Donc les résultats de traitement sont peu comparables.
Conclusion
Actuellement la qualité des études animales et humaines dans le traitement de la péri-implantite peut être remise en cause. La qualité des études est affectée par la conception, l’hétérogénéité des critères d’inclusion, le choix de l’intervention de contrôle qui varie beaucoup. Le laser Er-Yag a été considéré à la fois comme une intervention test (Schwarz et al, 2005, 2006a.) et une intervention contrôle (Renvert et al 2011).
Aucune méthodologie n’a été établie comme approche gold standard dans le traitement de la péri-implantite (Kotsovilis et al. 2008). Par conséquent, la majorité des essais a été conçue comme une comparaison entre deux types d’interventions complètement différentes. Ceci diminue l’implication clinique et l’applicabilité des résultats des essais, même dans les études de qualité supérieure.
Ce qu’il faut retenir
- Les nouveaux états de surface cherchent à accélérer et améliorer l’ostéointégration afin de diminuer la durée de nos traitements. Malheureusement ces états de surface qui ont une meilleure mouillabilité, peuvent être des niches à bactéries, difficiles à décontaminer.
- On ne sait toujours pas quel est le traitement le plus adapté pour un type de surface.
- Les études animales suggèrent que les caractéristiques de surface influencent le développement de la péri-implantite, mais cela est à interpréter avec précaution.
- De plus la reproductibilité des études animales chez l’homme reste très difficile
Lectures conseillées
1. CHARALAMPAKIS G, RABE P, LEONHARDT A, DAHLEN G. A follow-up study of peri-implantitis cases after treatment. Journal of Clinical Periodontology 38, no. 9 (septembre 2011): 864-871.
2. DAVARPANAH M, SZMUKLER-MONCLER S. Manuel d’implantologie clinique. Concepts, protocoles et innovations récentes Paris : Édition CdP, 2008.
3. ESPOSITO M, GRUSOVIN M G, TZANETEA E, PIATTELLI A, WORTHINGTON H V. Interventions for replacing missing teeth: treatment of peri-implantitis. Cochrane Database of Systematic Reviews (Online), no. 1 (2012): CD004970.
4. FAGGION C M, SCHMITTER M, YU-KANG T. Assessment of replication of research evidence from animals to humans in studies on peri-implantitis therapy. Journal of Dentistry 37, no. 10 (october 2009): 737-747.
5. RENVERT S, POLYZOIS I, MAGUIRE R. Re-osseointegration on previously contaminated surfaces: a systematic review. Clinical Oral Implants Research 20 Suppl 4 (september 2009): 216-227.
6. RENVERT S, POLYZOIS I, CLAFFEY N. How do implant surface characteristics influence peri-implant disease? Journal of Clinical Periodontology 38 Suppl 11 (march 2011): 214-222.






Un commentaire
passionnant ! très pointu …surtout pour moi !!
félicitations
biz
Nath