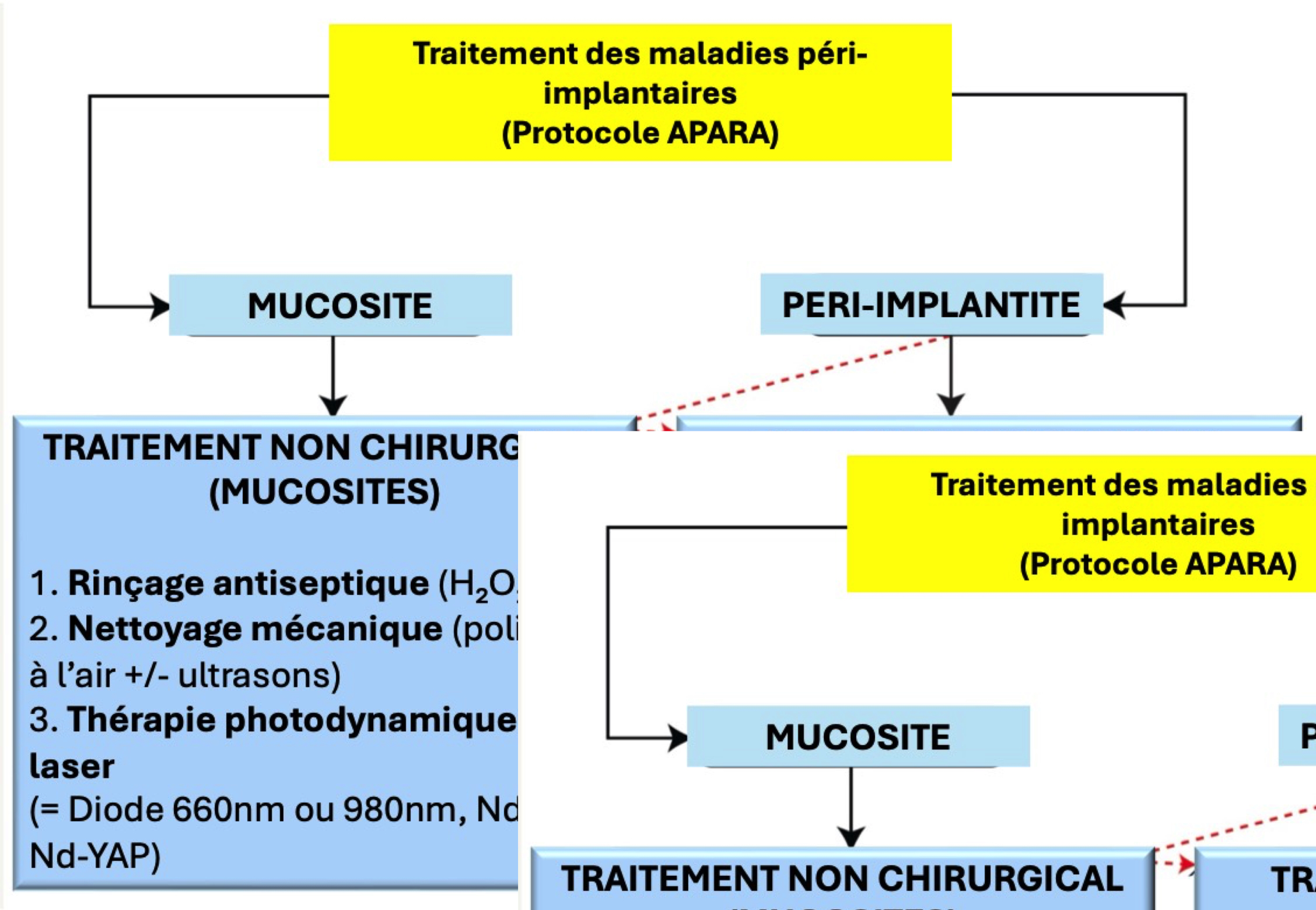
Lors du traitement des infections implantaires, la préoccupation principale de nos patients est de pouvoir conserver leurs implants. pour ce faire, le premier objectif est de maintenir les implants en bon état de fonctionnement, le second est de prévenir la récurrence des infections.
Pour atteindre ces deux objectifs, le protocole APARA (Assessment of Peri-implantitis Appearance and Repairing Approach) propose une approche structurée en trois étapes, basée sur l’utilisation des lasers pour optimiser les résultats thérapeutiques.
POURQUOI UTILISER DES LASERS ?
Les lasers offrent plusieurs avantages cliniques majeurs dans la prise en charge des infections implantaires. Bien qu’ils ne permettent pas directement la régénération osseuse, ils améliorent significativement la décontamination et le processus de cicatrisation. L’application des lasers est stratégique et s’envisage à différentes étapes du protocole.
DIFFÉRENTS TYPES DE LASERS ET LEURS INDICATIONS
Il existe plusieurs types de lasers utilisés en implantologie. Chacun possède des caractéristiques propres qui le rendent plus ou moins indiqué à une étape du traitement :
• laser diode 660 nm : laser froid, il ne génère pas de chaleur et agit uniquement par effet antibactérien. Il agit par le biais d’un colorant « photosensible » dans un processus appelé thérapie photodynamique, ciblant et éliminant efficacement les bactéries pathogènes.
• laser diode 980 nm : doté d’un effet thermique, il pénètre en profondeur dans les tissus et favorise la vasodilatation. Il aide à augmenter le flux sanguin autour des implants, a des capacités de décontamination et aide à la cicatrisation. Bien qu’il ne tue pas directement les bactéries, il perturbe l’environnement local anaérobie et a donc une action indirecte sur leur élimination.
• laser Nd-YAG : recommandé pour traiter les infections parodontales par un protocole appelé LANAP, sa lumière pénètre profondément dans les tissus et combine effets photomécaniques et photothermiques pour réduire l’inflammation et stimuler la cicatrisation.
• laser Erbium-YAG : utilisé dans les approches chirurgicales, il est absorbé dans la superficie des tissus mous constitués d’eau et des tissus durs constitués d’hydroxyapatite. Il permet d’éliminer les tissus infectés par découpe de la gencive et de l’os, de retirer les calculs de tartre et de nettoyer la surface implantaire tout en améliorant la cicatrisation osseuse et gingivale.
• laser CO2 : principalement employé pour la gingivectomie, il fonctionne sans eau et n’est pas indiqué pour impacter l’os ni l’implant.
Dans le cadre du protocole APARA, l’utilisation conjointe du laser diode 660 nm (avec colorant photosensible) pour une décontamination antibactérienne et du laser Erbium-YAG pour le nettoyage de l’implant et la stimulation de la cicatrisation osseuse permet d’obtenir des résultats prédictibles et reproductibles.
Le tableau ci-dessus résume les indications de chaque type de laser dans le traitement des péri-implantites.
OBJECTIFS DU PROTOCOLE DE TRAITEMENT LASER ASSISTÉ APARA
Le Protocole APARA (Assessment of Peri-implantitis Appearance and Repairing Approach) est une approche diagnostique et thérapeutique utilisant des lasers. Ce protocole développe une approche reproductible pour la pratique quotidienne : chaque classe diagnostique correspond à un traitement spécifique, développé dans l’ouvrage « Péri-implantites : approche thérapeutique », (Editions Libraire Garancière, 2019).
Il met en oeuvre deux longueurs d’onde principales : le laser à diode de 660nm et le laser Erbium YAG.
Ces longueurs d’onde n’ont pas d’effet thermique, ce qui les rend sûres et faciles à utiliser pour quelqu’un ayant une expérience limitée en dentisterie laser assistée. Les autres longueurs d’onde ont un effet thermique, donc même si elles sont efficaces en décontamination, elles nécessitent davantage de précautions.
LES TROIS ÉTAPES DU PROTOCOLE APARA
1. Phase de nettoyage et de décontamination L’objectif initial est d’éliminer les tissus de granulation, d’assainir la surface implantaire et de décontaminer la zone infectée. L’utilisation des lasers, notamment pour la décontamination, joue un rôle clé à ce stade.
2. Phase de cicatrisation et de régénération tissulaire Cette étape vise à favoriser la restauration des tissus
osseux et gingivaux autour de l’implant affecté. Contrairement à la phase de nettoyage, les lasers ne sont pas directement impliqués dans la régénération osseuse.
3. Phase de maintenance
Une fois l’implant stabilisé, il est essentiel de préserver un environnement sain pour éviter toute récidive. Les lasers peuvent être employés en soutien pour optimiser le contrôle bactérien et prolonger la stabilité implantaire.
PRINCIPES L’UTILISATION DES LASERS DANS LE PROTOCOLE APARA
L’application des lasers repose sur une approche adaptée à chaque phase du traitement :
1. Thérapie photodynamique (laser diode 660 nm)
Un colorant photosensible est introduit dans la poche infectée, puis activé par le laser pour générer des
radicaux libres oxygénés, ciblant efficacement les bactéries anaérobies.
2. Nettoyage et assainissement implantaire (laser Erbium-YAG)
Ce laser permet d’éliminer le tartre et les tissus inflammatoires sans altérer la structure de l’implant, facilitant ainsi la réintégration osseuse.
3. Stimulation de la régénération osseuse (laser Erbium-YAG)
Son action sur l’os cortical ouvre les canaux haversiens, améliorant la vascularisation locale et accélérant la cicatrisation.
4. Décontamination chimique complémentaire (laser Nd-YAG + eau oxygénée 10 volumes)
L’association de ce laser avec une solution d’eau oxygénée contribue à réduire l’inflammation et stimule les mécanismes de réparation tissulaire.
DÉCONTAMINATION CHIMIQUE PAR THÉRAPIE PHOTODYNAMIQUE
Illustrons pas à pas l’utilisation du laser Diode 660nm utilisé pour la décontamination par thérapie photodynamique, dans les traitements non chirurgicaux et chirurgicaux.
Sa mise en oeuvre nécessite un laser à diode de 660 nm et un colorant dont la couleur dépend de la
longueur d’onde. La démarche est la suivante :
– appliquer quelques gouttes de colorant à l’intérieur de la poche,
– attendre que le colorant se fixe sur la membrane des bactéries anaérobies. Ensuite, rincer l’excès avec de l’eau ou une solution saline, – activer la lumière laser pendant environ une minute autour de chaque implant, c’est à dire pendant dix secondes sur six sites différents, de manière similaire à un bilan de sondage parodontal.
Pendant que la lumière est activée, le colorant va absorber la lumière. Cela crée un excès d’énergie dans le site, conduisant à une réaction qui produit des radicaux libres oxygénés. Ces radicaux attaquent la membrane des bactéries anaérobies. La thérapie photodynamique a ainsi un véritable effet bactéricide.
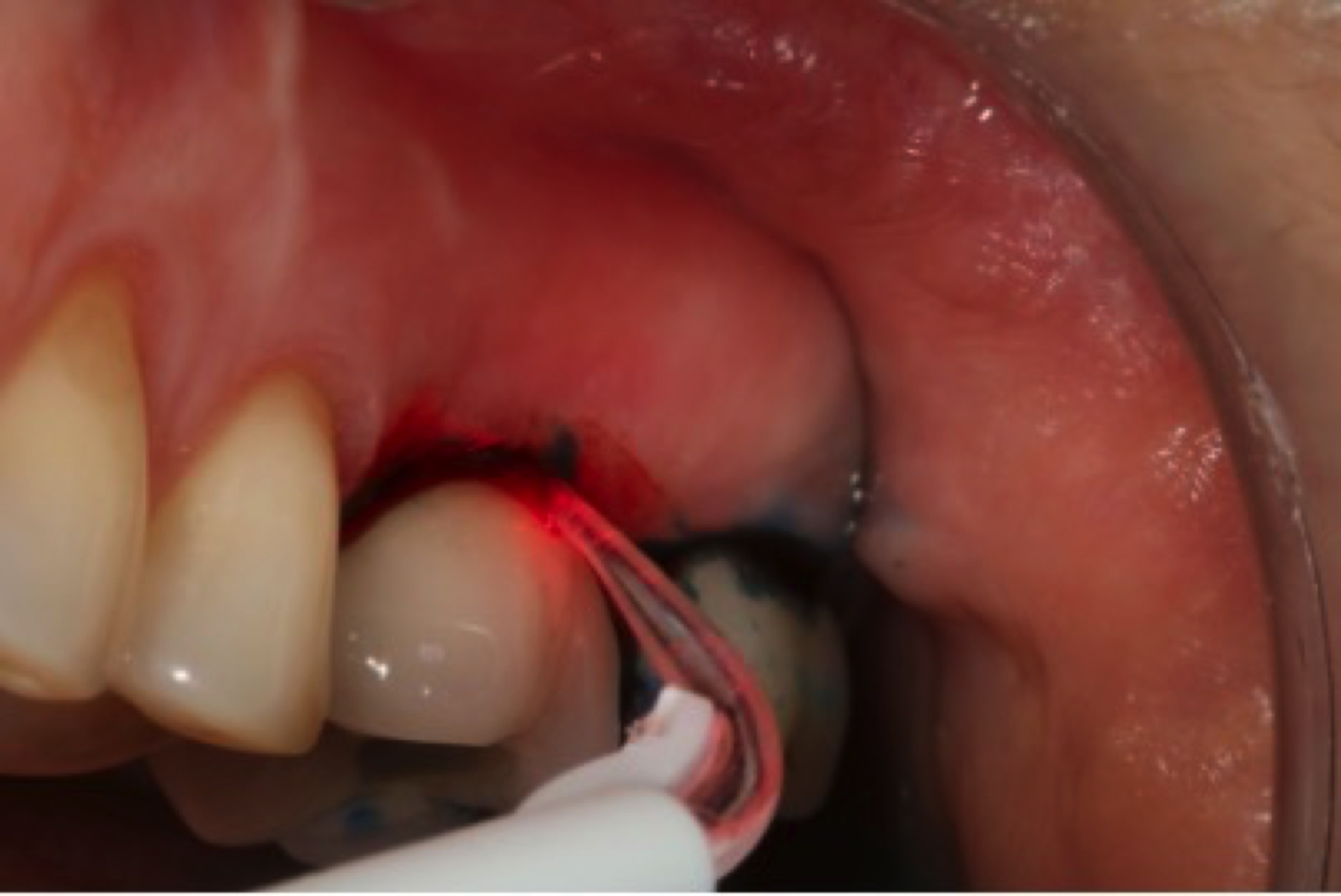
Figure 3: thérapie photodynamique en action à l’aide d’une fibre laser Diode Helbo 660nm dans un colorant photosensible (à base de chlorure de phénothiazine).
La thérapie photodynamique antimicrobienne est-elle un traitement en soi ?
Cela dépend du traitement. Pour un traitement non chirurgical, comme dans les cas de mucosites, cela peut être suffisant. Bien entendu, cette thérapie photodynamique n’ayant aucun effet mécanique d’ablation de tissus, il est nécessaire d’éliminer la plaque et le tartre à l’aide d’ultrasons au préalable.
Pour un traitement chirurgical, comme dans les cas des périimplantites, ce laser est un adjuvant antibactérien à un traitement mécanique de nettoyage de la surface implantaire et d’élimination du tissu de granulation.
NETTOYAGE MÉCANIQUE PAR LE LASER ERBIUM-YAG
Ce laser permet l’élimination sous lambeau du tissu de granulation et du tartre sur la surface implantaire.
Les tissus mous contenant de l’eau, et les tissus durs contenant de l’hydroxyapatite seront découpés par la lumière laser Erbium-YAG.
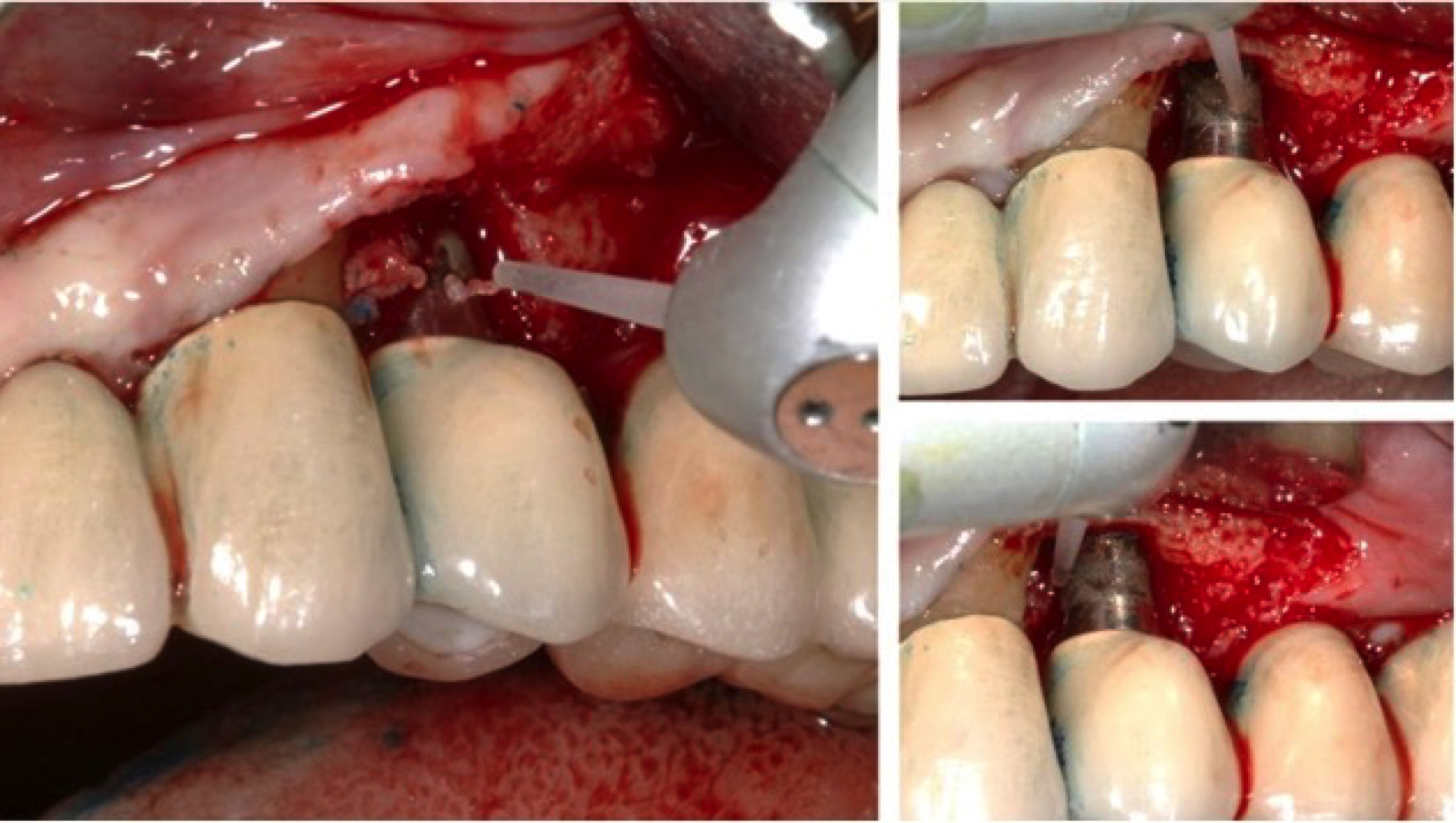
Figure 4: laser Er-YAG en action pour retirer le tissu de granulation
autour de l’implant par effet photoablatif.
Il est aisé d’éliminer le tartre et de nettoyer la surface de l’implant avec le laser Erbium-YAG. C’est une méthode sûre et douce pour la surface car le laser Erbium-YAG ne peut pas couper les surfaces métalliques.
Après le nettoyage, l’os cortical est impacté par le laser (pour ouvrir les canaux haversiens, qui permettent au sang de circuler autour des implants.
Ce sang est le matériau naturel et biologique de la régénération osseuse, et c’est ainsi que l’erbium-YAG
aide au processus de régénération.
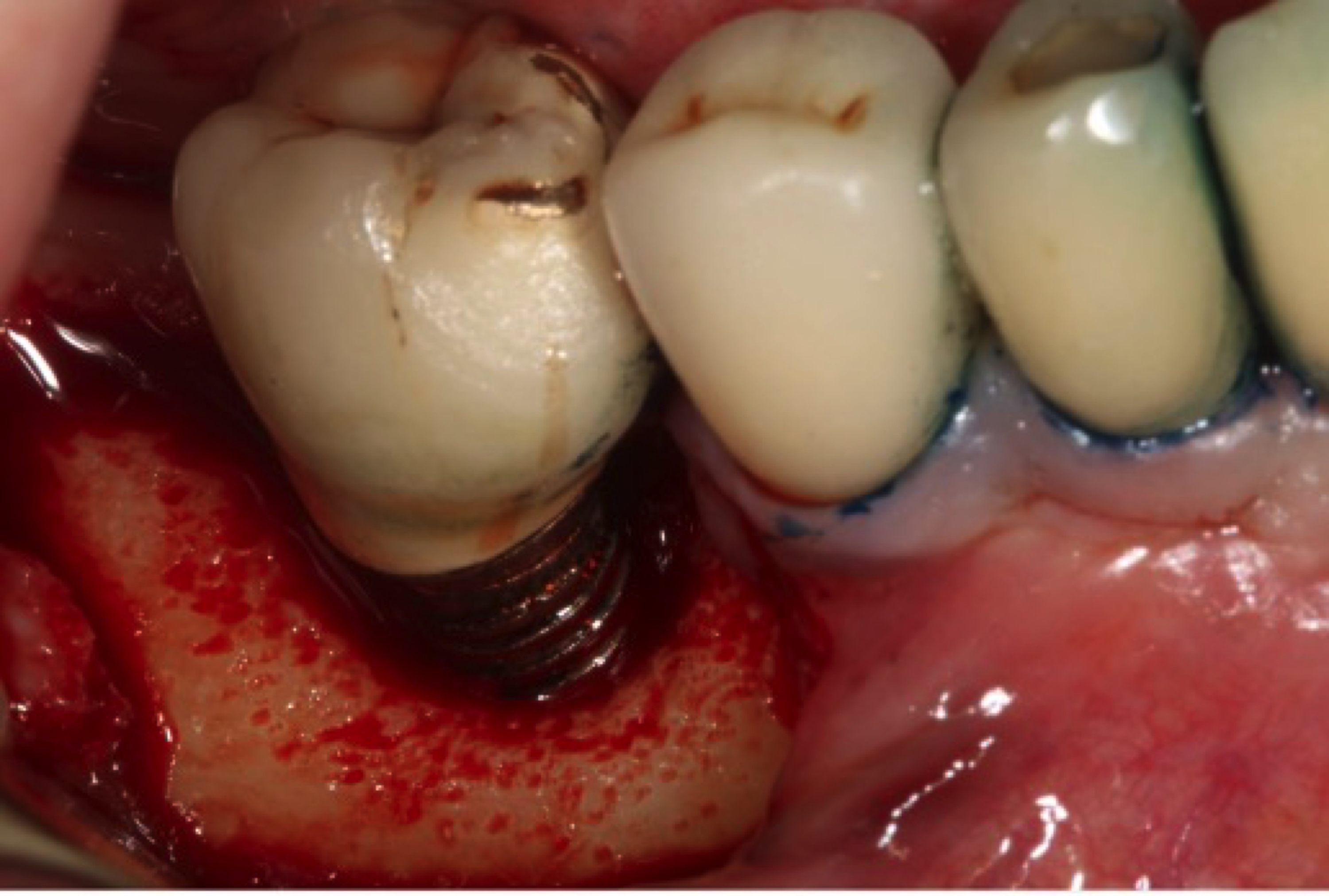
Figure 5: vue de l’os cortical impacté au Er-YAG afin d’ouvrir les canaux de Havers et faire venir du sang sur le site après le nettoyage laser assisté.
La surface implantaire nettoyée est ensuite homogénéisée à l’aide d’une brossette en titane.
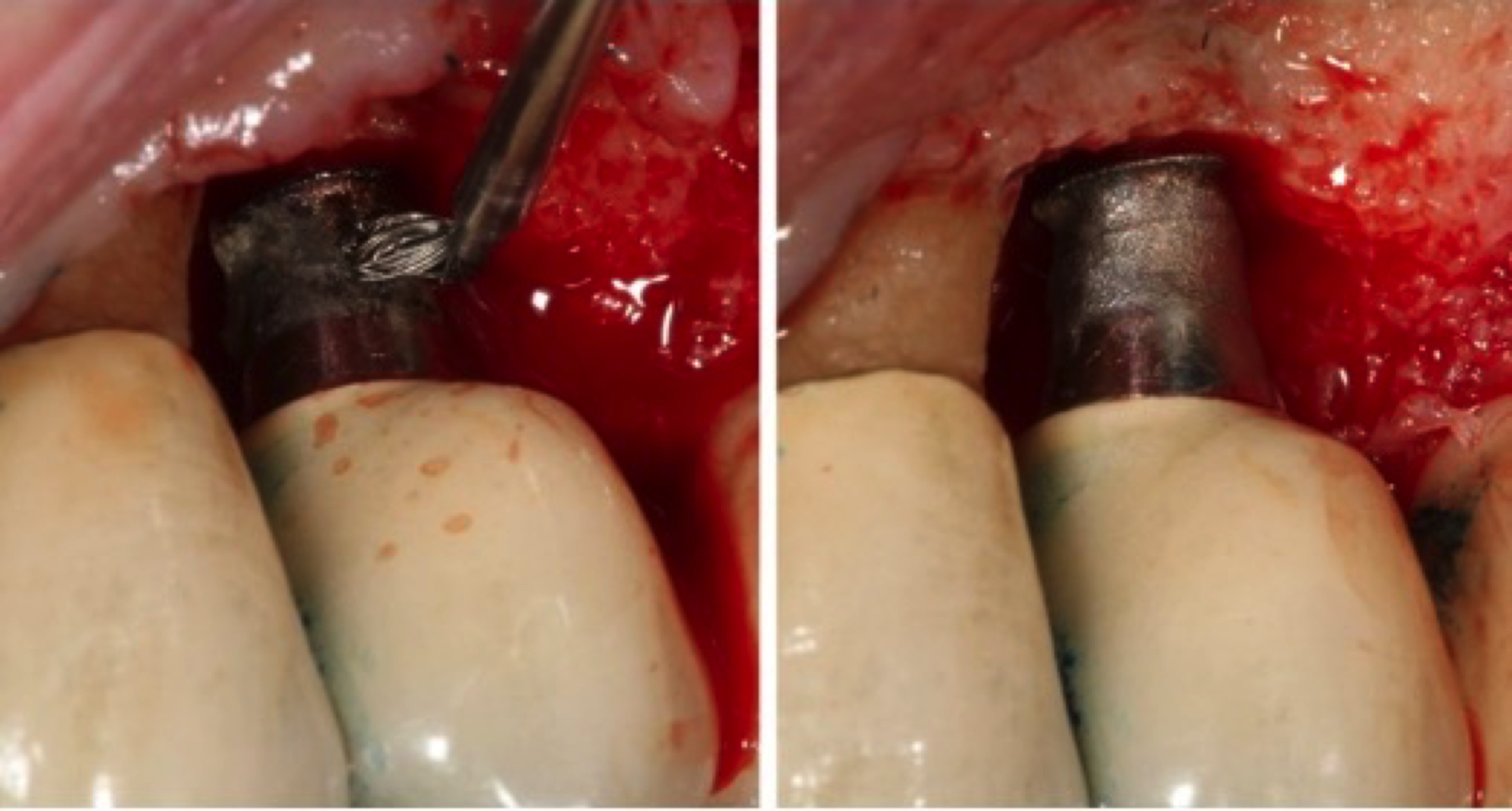
Figure 6: la surface de l’implant est in fine homogénéisée à l’aide d’une brossette en titane. On note la différence de texture de la surface implantaire après le passage de la brossette.
Le laser YAG d’erbium est-il un traitement en soi ?
Oui, il peut être utilisé seul pour traiter la périimplantite.
Bien qu’il soit avantageux d’incorporer des effets chimiques, tels que la thérapie photodynamique sur la surface implantaire, le laser Erbium-YAG est la meilleure option pour une approche chirurgicale aboutie.
La décontamination chimique de l’implant peut ensuite se faire soit à nouveau par thérapie photodynamique avec un laser diode 660nm et son colorant, soit en utilisant un laser Nd-YAG et de l’eau oxygénée à 10 volumes (ou encore un laser à diode 980nm).
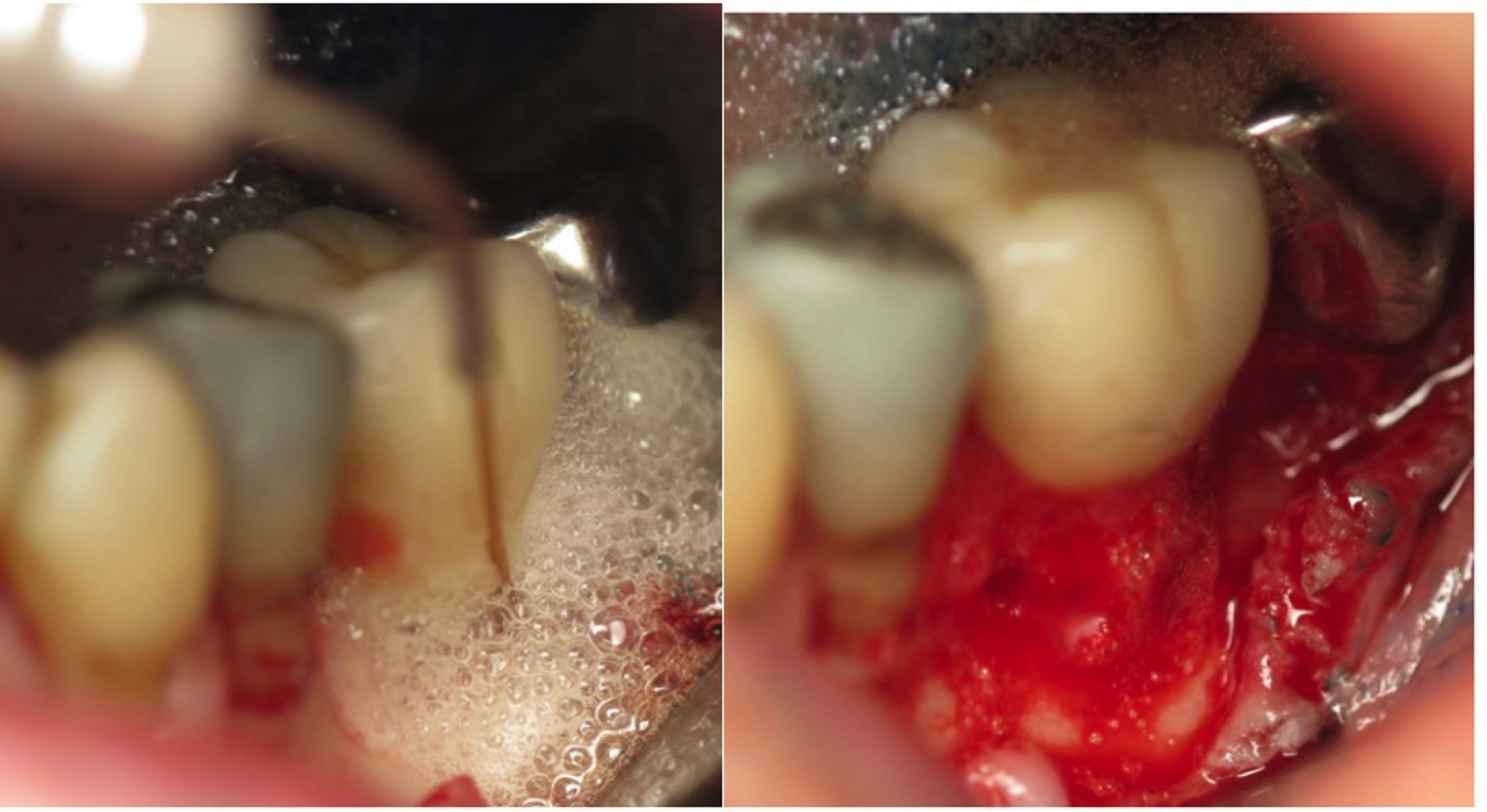
Figure 7: thérapie photochimique pour optimiser la décontamination
photoactivée à l’aide d’un laser Diode 980nm et d’eau oxygénée.
Stratégie chirurgicale : ROG ou pas ROG ? Telle est la question.
Une fois la surface implantaire décontaminée, la gestion de la régénération osseuse est essentielle. Le
protocole APARA recommande de ne pas utiliser de biomatériaux de comblement sur un implant infecté, mais plutôt de protéger le site avec une greffe conjonctive prélevée au palais ou une membrane dermique acellulaire. Cette approche permet de préserver le caillot sanguin, garantissant ainsi une cicatrisation optimale.
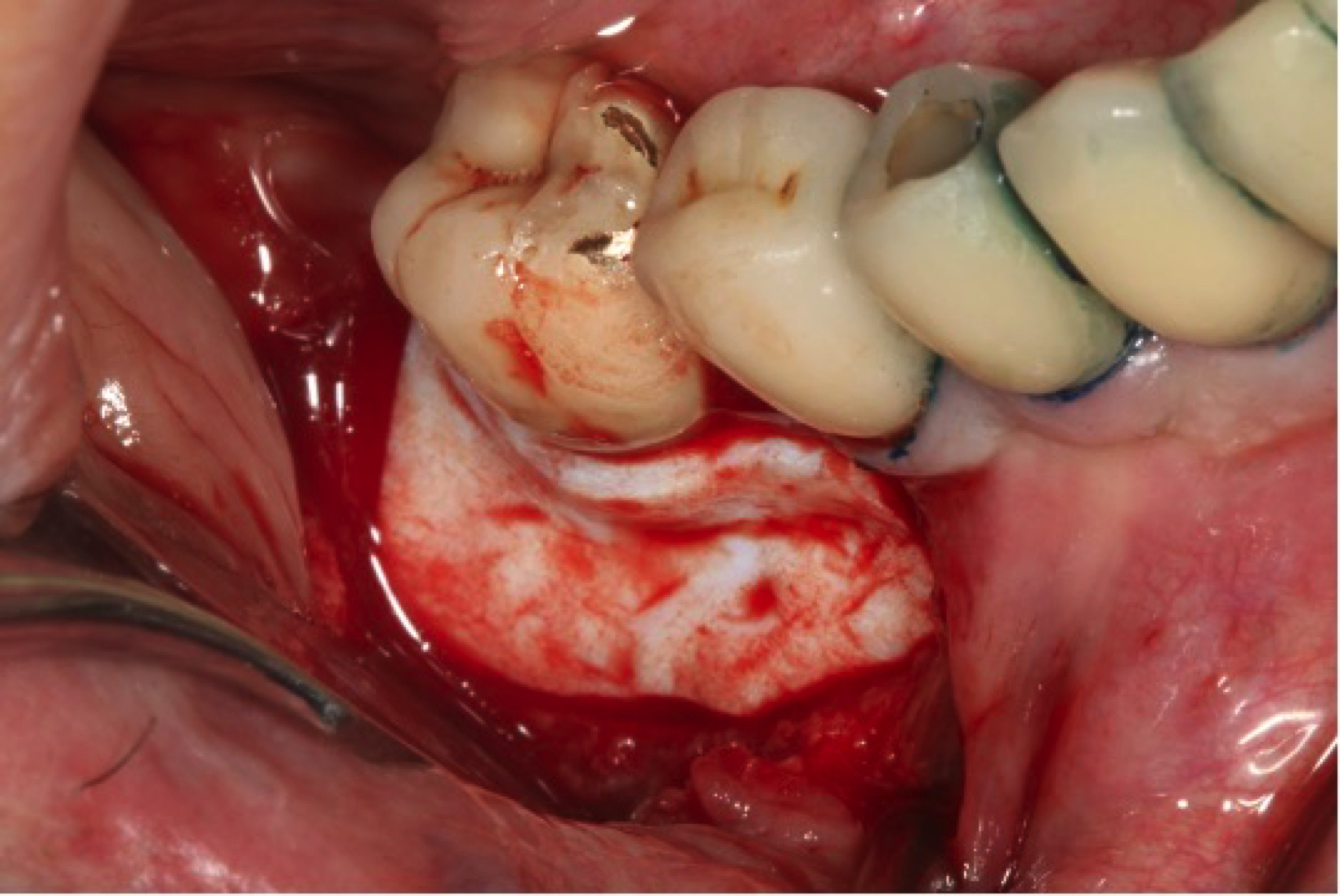
Figure 8: le caillot sanguin est protégé avec une membrane dermique (ici Novomatric, BioHorizons). En absence de cratère, cette protection par une barrière tissulaire permet d’améliorer le biotype gingival péri-implantaire.
ILLUSTRATIONS CLINIQUES DU PROTOCOLE APARA
Passons en revue enfin plusieurs situations cliniques.
1ER CAS : PÉRI-IMPLANTITE DÉBUTANTE
L’implant 46 a perdu 20 % de la hauteur osseuse, c’est une péri-implantite classe PA1a (atteignant un seul implant sur <20 % de la hauteur de l’implant).
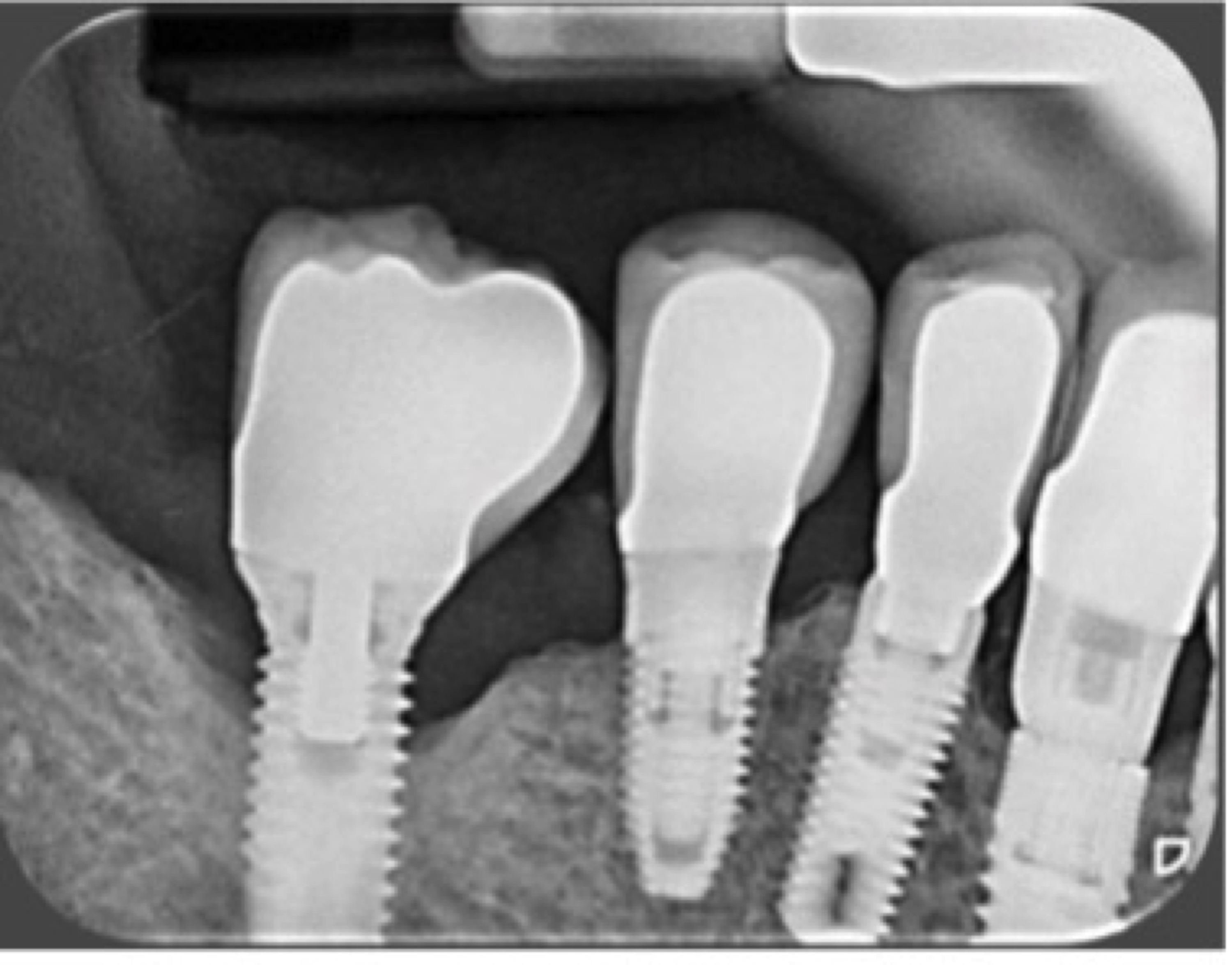
Figure 9: cas 1, situation initiale d’une péri-implantite de classe PA1a (un seul implant atteint avec une perte osseuse de moins de 20 % de sa hauteur).
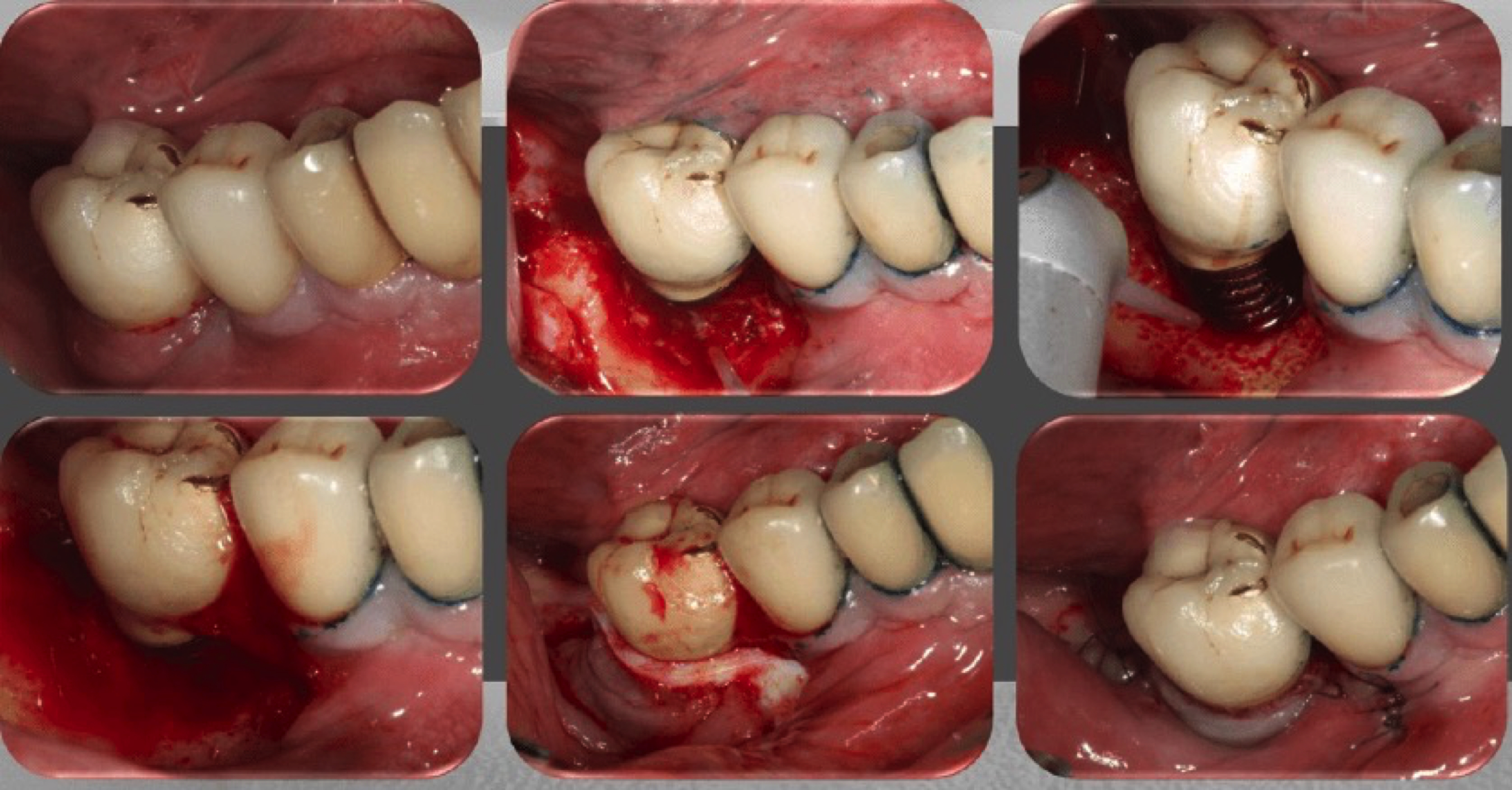
Figure 10: flux de traitement par le protocole APARA, classe thérapeutique RA1. Réalisation d’un lambeau à ciel ouvert au laser Er-YAG, mise à jour du tissu de granulation, nettoyage de
l’os et de l’implant à l’aide d’un laser Er-YAG, création d’un caillot péri-implantaire, protection du caillot avec une membrane collagénique dermique acellulaire, suture.
Le protocole est prévisible et suit toujours la même étape : d’abord, la thérapie photodynamique puis le lambeau est décollé pour appliquer le laser Erbium-YAG. Après quatre mois, on observe la régénération osseuse, sans ROG.
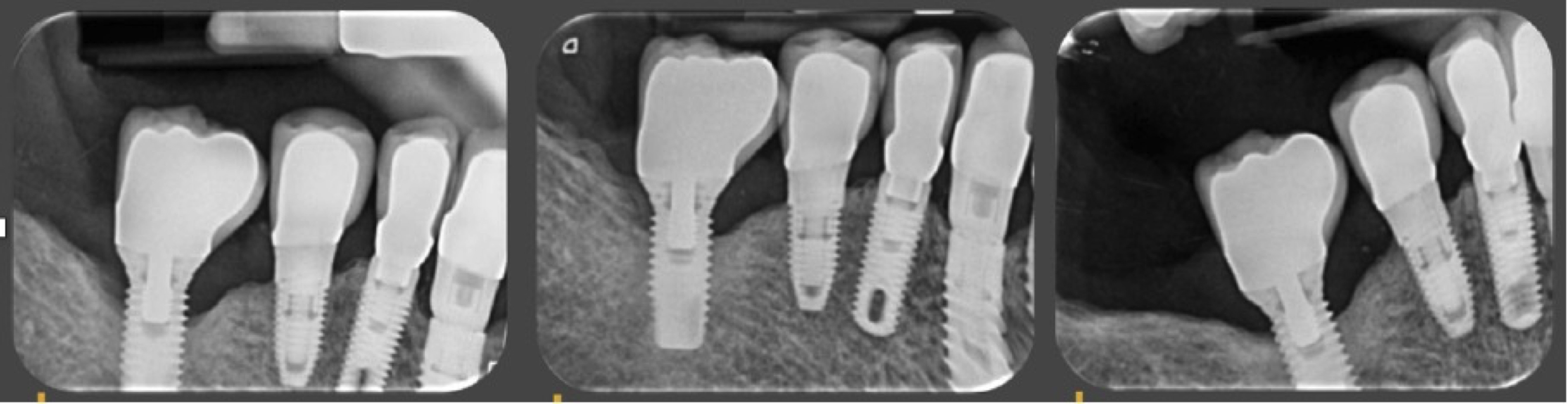
Figure 11: suivi de cicatrisation à 4 mois et 18 mois.
La reformation osseuse est obtenue rapidement de façon satisfaisante sans avoir eu recours à des
biomatériaux de régénération osseuse guidée.
2ÈME CAS : PÉRI-IMPLANTITE MODÉRÉE
L’implant 37 a perdu environ 50 % de la hauteur osseuse, c’est une péri-implantite classe PA1b (atteignant un seul implant sur 20 à 50 % de la hauteur de l’implant).

Figure 12: cas 2, évolution de la cicatrisation d’une péri-implantite PA1b (un seul implant atteint avec perte osseuse entre 20 et 50 % de la hauteur de l’implant). En 2 mois l’os est régénéré suite à un protocole RA1, sans aucune utilisation de biomatériau osseux. A 3 ans de suivi, la cicatrisation reste stable.
3ÈME CAS : PÉRI-IMPLANTITE TRÈS AVANCÉE
L’implant a perdu environ plus de 60 % de la hauteur osseuse, c’est une péri-implantite classe PA1c voire PA1d (atteignant un seul implant sur 50 à 60 % de la hauteur de l’implant). Ce cas très avancé montre l’efficacité et la reproductibilité du protocole APARA pour conserver l’implant et régénérer l’os sans avoir recours à des biomatériaux.
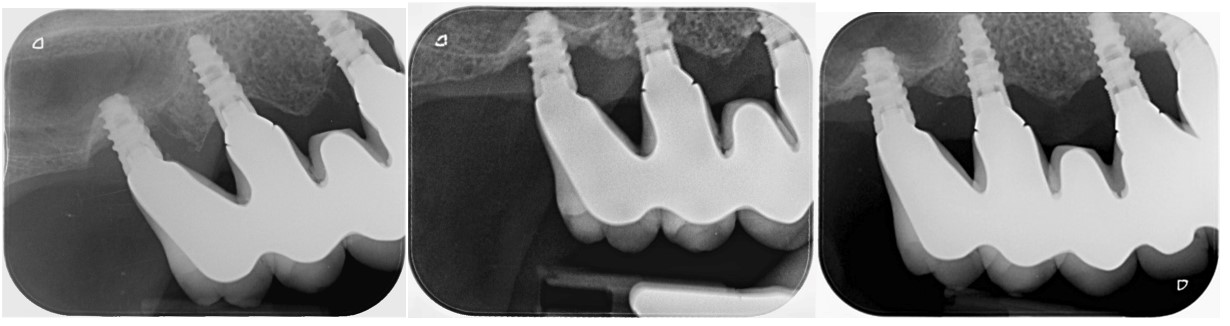
Figure 13: cas 3, évolution de la cicatrisation d’une péri-implantite RA3c (3 implants atteinte
avec une perte osseuse proche de 60 % de la hauteur pour l’implant le plus atteint). La reformation osseuse est rapide (2 mois) et pérenne à 3 ans.
4ÈME CAS : PÉRI-IMPLANTITE MODÉRÉE, AVEC 7 ANS DE RECUL
L’implant a perdu environ 50 % de la hauteur osseuse, c’est une péri-implantite classe PA1b. ce cas illustre la stabilité à long terme de l’os régénéré.
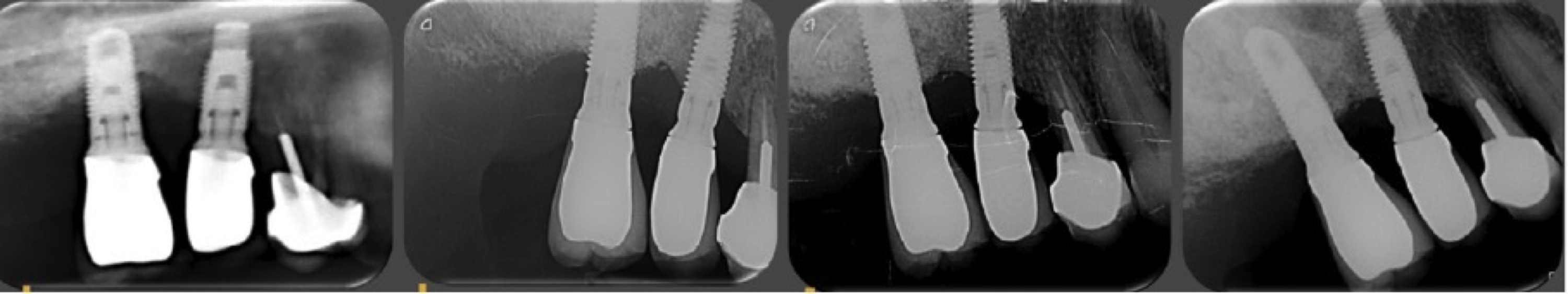
Figure 14: Cas 4, suivi à 7 ans d’une péri-implantite RA1b (un implant atteint avec une perte
osseuse de 20 à 50 % de la hauteur de l’implant). A 5 mois, 36 mois et 7 ans, la régénération
osseuse est stable et satisfaisante. A partir de cinq mois, les résultats sont stables et le restent.
CONCLUSION
L’intégration des lasers dans le traitement des infections implantaires constitue une avancée majeure en implantologie. Le protocole APARA offre une stratégie reproductible permettant d’améliorer la précision des traitements et d’optimiser la régénération tissulaire. Si l’utilisation d’un laser unique est déjà bénéfique, l’association de plusieurs longueurs d’onde permet d’atteindre des résultats encore plus probants. En affinant ces protocoles, nous nous rapprochons d’une prise en charge optimale des infections implantaires, avec l’ambition de pouvoir enfin répondre avec confiance à la question : “Docteur, mon implant durera-t-il toute une vie ?”