INTRODUCTION
La notion d’« ostéologie » a été introduite en 1594 par Barthelemy Cabrol, anatomiste français, dans son ouvrage « Alphabet Anatomic ». En 2000, Arron et Choi [1] présentent pour la première fois les principes de l’ostéo-immunologie : le système immunitaire est en réalité impliqué dans les cascades de synthèse et remodelage osseux, où il contrôle la formation osseuse, régule la résorption osseuse et agit comme un facteur clé de l’homéostasie osseuse [2,3].
Inversement, les fonctions et cellules immunitaires sont influencées par le système osseux [4]. Il a été conclu que les systèmes osseux et immunitaire sont en réalité unifiés dans une seule et même entité : le système ostéo-immunitaire [5].

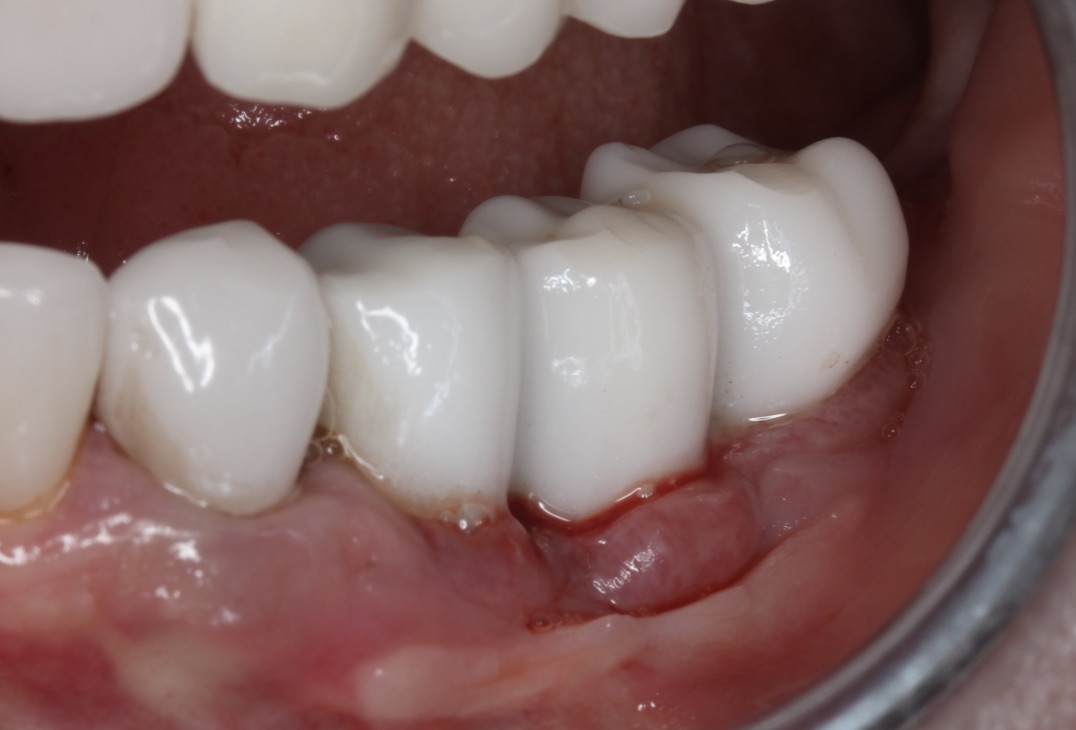
La péri-implantite serait alors une des conséquences d’une réponse immunitaire déficiente, en autorisant l’invasion bactérienne des tissus péri-implantaires. Elle doit être considérée comme une pathologie intimement liée aux conditions immunitaires, dont le traitement et la cicatrisation ne peut logiquement se faire sans une réponse immunitaire efficace.
OXYDANTS, ANTIOXYDANTS & STRESS OXYDATIF
Des réactions d’oxydo-réduction ont lieu de façon continue dans les mitochondries de tous les êtres vivants, et génèrent en permanence des radicaux libres, également appelés oxydants. Les oxydants sont des molécules hautement réactives, par la perte d’un ou plusieurs électrons dans leur enveloppe externe [6,7]. À faible concentration, les radicaux libres sont bénéfiques car ils servent de molécules de signalisation dans l’activation de voies physiologiques spécifiques, contrôlant de nombreux processus vitaux [8]. À des concentrations plus élevées, ils interfèrent avec les lipides, lipoprotéines et composants des membranes cellulaires, provoquant des dommages à la fois moléculaires et cellulaires. Les radicaux libres sont produits en quantité lors des lésions tissulaires, mais également dans plusieurs autres conditions telles que : l’exposition aux polluants, une alimentation déséquilibrée, l’anxiété, le tabagisme ou encore l’inflammation chronique. Les dommages oxydatifs jouent un rôle actif dans l’étiologie d’une grande variété de maladies aiguës et chroniques, telles que le cancer, les maladies cardiovasculaires, l’arthrite, l’ostéoporose et les troubles neurodégénératifs [9-11]. Il a été prouvé qu’ils détériorent le bon fonctionnement du système immunitaire et peuvent favoriser l’apparition de maladies auto-immunes [12]. Ils jouent également un rôle central dans l’accélération du processus de vieillissement [8].
Par ailleurs, le corps humain équilibre la production d’oxydants par celle d’antioxydants. Les antioxydants sont des molécules capables de contrecarrer l’oxydation, soit en empêchant la formation de radicaux libres, soit en les neutralisant en fournissant le ou les électrons manquants. Ils peuvent être produits de manière endogène ou être apportés par une supplémentation orale exogène. Un des principaux avantages des antioxydants est leur capacité à bloquer l’action des cytokines proinflammatoires [13].
Au niveau osseux, ils favorisent les processus de minéralisation et réduisent l’activité ostéoclastique, soit directement, soit en contrecarrant les effets des oxydants [14].
La production d’antioxydants est contrôlée par le Nrf2 (Nuclear Factor Erythroid-2-Related Factor 2), un facteur de transcription régulant plus de 250 gènes humains [15]. Le Nrf2 contrôle principalement les processus de réparation cellulaire et réduit l’inflammation par la production d’antioxydants qu’il induit. Des études récentes ont mis en évidence le rôle crucial de Nrf2 dans la prévention de l’ostéoporose, dans les processus de différenciation des cellules souches ostéogéniques et dans la guérison des fractures osseuses [16-18]. Le Nrf2 a également un effet protecteur certain contre la parodontite [19].
Inversement, une réduction de l’activité du Nrf2 est associée à des retards de cicatrisation osseuse [20].
Le terme « stress oxydatif » est apparu pour la première fois dans la littérature médicale en 1985 [15].
Il est défini lorsque les niveaux d’oxydants et d’antioxydants sont déséquilibrés et que la production de radicaux libres dépasse les défenses antioxydantes cellulaires [21,22].
En cas d’inflammation chronique comme dans la périimplantite, le taux d’oxydants augmentent, et l’oxydation des cellules immunitaires va entraîner une déficience immunitaire.
Au niveau osseux, des quantités élevées de radicaux libres dans les ostéoblastes et ostéocytes inhibent leurs fonctions et conduisent à leur apoptose [23,24,25].
Les oxydants jouent également un rôle crucial dans la différenciation et l’activation des ostéoclastes [26,27].
Une apoptose excessive des ostéocytes et une ostéoclastogenèse accrue perturbent l’équilibre du remodelage osseux en faveur de l’inhibition de l’ostéogenèse et de la minéralisation, augmentant la vitesse du remodelage osseux et compromettant le maintien osseux.
Le stress oxydatif crée un environnement propice à la destruction osseuse, notamment autour des implants [28, 29], par un seul mécanisme : l’échec du remodelage osseux par une inflammation prolongée [30].
L’OSTÉOIMMUNOLOGIE
L’ostéo-immunologie est une science fondée sur les liens étroits qui existent entre le système osseux et le système immunitaire [31]. Les cellules immunitaires et osseuses possèdent un héritage commun dans les cellules souches : elles partagent des voies de signalisation et s’influencent mutuellement de façon permanente [32]. Le système immunitaire contrôle l’os et sa résorption et agit donc comme un facteur clé de l’homéostasie osseuse [2,3].
Au niveau oral, la dysbiose microbienne seule n’est pas suffisante pour déclencher une parodontite ou qui en activant les cellules parodontales, permettent l’expression de molécules dont RANKL, et donc une activité ostéoclastique [33].
On retrouve une distribution particulière des macrophages, ainsi qu’une hausse du taux de lymphocytes NK chez les patients atteints de périimplantites, en comparaison avec les patients sains [34].
Inversement, les cellules et facteurs immunitaires sont aussi les principaux éléments régulateurs de la cicatrisation et contribuent aux premières étapes de l’angiogenèse [35,36].
Après un traumatisme osseux, les cellules immunitaires, en particulier les macrophages, interviennent tout au long du processus de guérison, organisant la défense de l’organisme contre les agents pathogènes [37]. La guérison osseuse commence par une réaction inflammatoire, induite par la libération de cytokines inflammatoires
leucocytaires, principalement angiogéniques [38], aboutissant à la formation d’un « cal osseux mou » [39]. Cependant, deux conditions sont nécessaires pour que cette cascade d’événements se produise : une quantité suffisante d’antioxydants et une activation adéquate des gènes de réparation [40].
CAUSES SYSTÉMIQUES DE STRESS OXIDATIF ET DÉFICIT IMMUNITAIRE EN IMPLANTOLOGIE
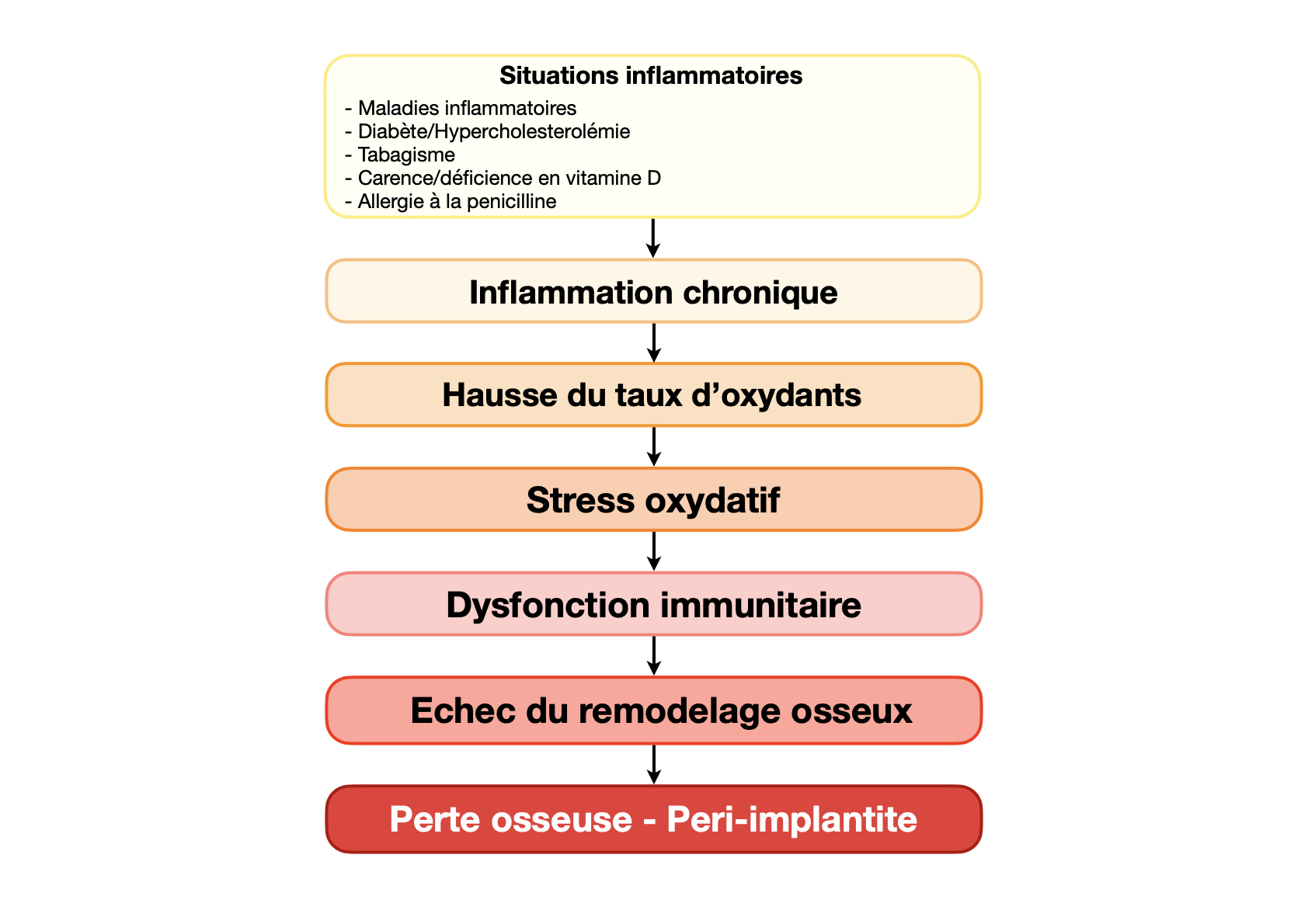
Des niveaux élevés de radicaux libres, associés à des maladies métaboliques ou à une inflammation parodontale, compromettent les fonctions immunitaires et affectent ainsi la formation et le maintien de l’os [41]. Plusieurs pathologies systémiques favorisent l’inflammation chronique et donc le stress oxydatif, rendant le système immunitaire déficient.
Parmi ces troubles, nous pouvons citer :
– Les pathologies inflammatoires chroniques (maladies auto-immunes, maladies inflammatoires chroniques (polyarthrite rhumatoïde, lupus, maladie de Crohn), obésité, VIH, etc.)
– Le diabète, qui est une maladie inflammatoire chronique [42]. Le stress oxydatif qui en découle trouve son origine dans l’hyperglycémie [43]. Les difficultés de cicatrisation, la fragilité parodontale et les complications systémiques (néphropathies, neuropathies, angiopathies…) sont liés au niveau d’oxydation élevé de ces patients [44]. Le diabète est connu pour être un facteur de risque de la parodontite, mais il en serait de même pour la péri-implantite [45].
– Le tabagisme, et plus particulièrement la fumée de cigarette, entraine la destruction des antioxydants des tissus avec lesquels elle entre en contact et augmente la libération de cytokines pro-inflammatoires [46,47].
Ceci aboutit à une gencive inflammatoire et oxydée, qui se fragilise et va rencontrer des difficultés à cicatriser. Le stress oxydatif rencontré dans les tissus mous des patients tabagiques entraîne un risque accru de péri-implantite [48,49].
– L’allergie à la pénicilline, comme toute allergie, est en réalité une dysfonction immunitaire avec deux conséquences majeures : une baisse du recrutement des neutrophiles pour lutter contre les agents pathogènes et une libération continue des cytokines pro-inflammatoires par les lymphocytes T activés [50].
L’inflammation chronique engendre un stress oxydatif qui se traduit cliniquement par un risque d’infection trois à quatre fois plus élevé [51]. Ceci explique pourquoi les alternatives à l’amoxicilline ne présentent pas une efficacité équivalente [52].
– La déficience ou carence en vitamine D crée un déséquilibre systémique par défaut de production d’anti- xydant. La vitamine D, qui est en réalité une hormone, est principalement synthétisée dans la peau après l’exposition aux rayons UV. Son taux sérique normal se situe entre 30 et 100 ng/ml (ou 75 à 250 nmol/ml) [53]. Les niveaux de vitamine D influencent la croissance cellulaire et stimulent la production d’anti-oxydants [54]. En favorisant l’accumulation et l’activation du Nrf2, la vitamine D améliore l’expression de nombreux gènes régulant l’immunité, la croissance et le remodelage osseux [55, 56]. Il a également été démontré qu’elle possède des propriétés antimicrobiennes et anti-inflammatoires [57,58].
De par notre mode de vie moderne, la carence en vitamine D est très répandue et les facteurs de risque sont les suivants : l’âge, la peau mate, la dépression, l’obésité, le tabagisme, le diabète, l’allergie, l’insuffisance rénale. Une insuffisance ou carence en vitamine D est fréquemment retrouvée chez les patients présentant une péri-implantite [59]. Elle pourrait également être reliée à un risque accru d’échecs implantaires précoces (x2 à x4) [60].
– L’hypercholestérolémie, dont de nombreuses études ont établi une corrélation avec une moindre densité osseuse. Le LDL-cholestérol est un oxydant qui va provoquer une oxydation des ostéoblastes. Les cellules souches mésenchymateuses se retrouvent ainsi contraintes de produire des cellules adipeuses plutôt que des cellules osseuses [61], ralentissant le métabolisme et la synthèse osseuse. L’hypercholestérolémie semblerait être un des facteurs de risque de la péri-implantite [62,63]. En revanche, le HDL cholestérol lui est antioxydant [64,65].
SOLUTIONS VISANT À AMÉLIORER LA RÉPONSE IMMUNITAIRE ET RÉDUIRE LE STRESS OXYDATIF
Dans le domaine de l’implantologie, une meilleure compréhension de l’ostéo-immunologie permet la proposition de recommandations et conseils simples à nos patients, visant à réduire leur inflammation systémique et ainsi améliorer leur réponse et défenses immunitaires.
A la fois la prévention de la péri-implantite et le succès de nos traitements péri-implantaires dépend en partie de la stimulation naturelle et physiologique de la production d’anti-oxydants, seuls capables de réduire cette inflammation systémique sans effets adverses [66].
– Les antioxydants d’origine exogène, ou nutraceutiques, ont démontré leur capacité à réduire les dommages oxydatifs. Ils ont montré à eux seuls une réduction significative de 40 % des marqueurs sanguins du stress oxydatif, en particulier chez les fumeurs et les patients à haut risque [67].
Les nutraceutiques peuvent être classés en deux groupes : ceux avec des fonctions d’activation du Nrf2 et ceux avec des propriétés antioxydantes directes.
Il a été prouvé que les activateurs du Nrf2 ont le potentiel de contrôler la perte osseuse due à l’inflammation [68,69]. Parmi ces activateurs, on trouve la vitamine D, la vitamine C, la mélatonine et le zinc [70-77].
La vitamine D par exemple, jouerait un rôle significatif dans la prévention mais également dans l’efficacité des traitements des maladies péri-implantaires [78].
D’autres nutraceutiques peuvent être prescrits aux patients pour augmenter la production d’antioxydants endogènes et ainsi réduire la production des cytokines pro-inflammatoires, comme les probiotiques, la vitamine K2, la vitamine E, la vitamine B6, le cuivre, le magnésium et les acides gras [79-84].
La supplémentation par antioxydants doit être envisagée chez les patients traitées pour une périimplantite, en particulier ceux souffrant de troubles systémiques (diabète, maladies auto-immunes ou inflammatoires). Elle commencera idéalement 10 à 15 jours avant les traitements envisagés.
– La réduction du LDL-cholestérol est obligatoire car l’hypercholestérolémie a été identifiée comme un facteur de risque pour la stabilité osseuse. Elle doit être traitée avant toute intervention si les niveaux sériques de LDL dépassent 1,4 g/l [85]. Le traitement peut être réalisé par l’administration d’une combinaison de médicaments hypocholestérolémiants et l’amélioration du mode de vie (réduction drastique de la consommation de viande rouge, tabac et d’alcool, limitation des boissons et aliments sucrées riches en glucides simples, ainsi que des aliments à indice glycémique élevé (pain blanc, pommes de terre)).
Une supplémentation en vitamine D permet également de faire baisser les taux de LDL cholestérol [86].
– L’autophagie, décrit la régénération cellulaire dans des conditions de jeûne. Ce concept a valu le prix Nobel à Christian de Duve en 1974 [87] et plus récemment à Yoshinori Ohsumi en 2016. Lors d’un jeûne, les cellules subissent une autophagie, formant des vacuoles inhabituellement grandes qui fonctionnent comme des « décharges cellulaires », collectant et recyclant les substances indésirables [88].
L’autophagie améliore les réponses immunitaires innées et adaptatives et accélère la cicatrisation des
plaies par l’angiogenèse. Le jeûne intermittent, d’une durée d’au moins 16 heures par jour (en sautant le
petit-déjeuner par exemple), représente un moyen simple et efficace d’exploiter les bénéfices de
l’autophagie pour nos patients.
– La marche à pied fait également partie des moyens permettant d’améliorer les défenses immunitaires de nos patients. En effet, l’exercice physique à faible intensité permet la mobilisation des cellules souches hématopoïétiques et mésenchymateuses dans la circulation sanguine [89]. Elles permettent la modulation des réponses immunitaires et anti inflammatoires avec un effet direct sur la cicatrisation et la régénération. Une séance quotidienne de marche à pied d’une durée de 30 minutes à 5km/h représente le moyen le plus simple et le plus efficace d’exploiter le potentiel immunitaire de ce type d’exercice physique.
CONCLUSION
L’ostéo-immunologie, en mettant en lumière l’interaction complexe entre l’os et le système immunitaire, a considérablement élargi les connaissances sur l’inflammation et ses conséquences sur l’immunité et les
maladies parodontales et péri-implantaires. Il est désormais évident que le système immunitaire joue un
rôle prépondérant dans la prévention et la survenue des péri-implantites.
Les solutions proposées dans cet article tiennent évidemment compte de cette nouvelle approche scientifique. Ces protocoles appliqués en parodontologie et en implantologie pourraient réduire le taux d’échecs et augmenter celui de réussite des thérapeutiques envisagées.
Toutefois, l’absence d’études cliniques randomisées ou de protocoles de ce type dans la littérature scientifique actuelle souligne la nécessité de poursuivre la recherche scientifique.
L’ostéo-immunologie a fourni des informations précieuses sur la pathogenèse de la parodontite et peut offrir une nouvelle perspective sur la compréhension de la péri-implantite, car elles présentent toutes deux des symptômes similaires : inflammation chronique du tissu parodontal et destruction subséquente de l’os alvéolaire autour des dents ou des implants. Il est naturellement logique de considérer ces deux pathologies comme le résultat d’un dysfonctionnement immunitaire.
Bibliographie
- Arron JR, Choi Y. Bone versus immune system. Nature. 2000 Nov 30;408(6812):535-6.
- Suda T, Takahashi N, Udagawa N, Jimi E, Gillespie MT, Martin TJ. Modulation of osteoclast differentiation and function by the new members of the tumor necrosis factor receptor and ligand families. Endocr Rev. 1999 Jun;20(3):345-57.
- Yasuda H, Shima N, Nakagawa N, Yamaguchi K, Kinosaki M, Goto M, Mochizuki SI, Tsuda E, Morinaga T, Udagawa N, Takahashi N, Suda T, Higashio K. A novel molecular mechanism modulating osteoclast differentiation and function. Bone. 1999 Jul;25(1):109-13.
- Yang N, Liu Y. The Role of the Immune Microenvironment in Bone Regeneration. Int J Med Sci. 2021 Sep 21;18(16):3697-3707.
- Okamoto K, Nakashima T, Shinohara M, Negishi-Koga T, Komatsu N, Terashima A, Sawa S, Nitta T, Takayanagi H. Osteoimmunology: The Conceptual Framework Unifying the Immune and Skeletal Systems. Physiol Rev. 2017 Oct 1;97(4):1295-1349.
- Giorgio M, Migliaccio E, Orsini F, Paolucci D, Moroni M, Contursi C, Pelliccia G, Luzi L, Minucci S, Marcaccio M, Pinton P, Rizzuto R, Bernardi P, Paolucci F, Pelicci PG. Electron transfer between cytochrome c and p66Shc generates reactive oxygen species that trigger mitochondrial apoptosis. 2005 Jul 29;122(2):221-33.
- Auten RL, Davis JM. Oxygen toxicity and reactive oxygen species: the devil is in the details. Pediatr Res. 2009 Aug;66(2):121-7
- Finkel, T.; Holbrook, N.J. Oxidants, oxidative stress and the biology of ageing. Nature 2000, 408, 239–247.
- Iantomasi T, Favilli F, Catarzi S, Vincenzini MT. GSH role on platelet-derived growth factor receptor tyrosine phosphorylation induced by H2O2. Biochem Biophys Res Commun. 2001 Feb 9;280(5):1279-85.
- Blanco RA, Ziegler TR, Carlson BA, Cheng PY, Park Y, Cotsonis GA, Accardi CJ, Jones DP. Diurnal variation in glutathione and cysteine redox states in human plasma. Am J Clin Nutr. 2007;86:1016-1023.
- Koh JM, Lee YS, Byun CH, Chang EJ, Kim H, Kim YH, Kim HH, Kim GS. Alpha-lipoic acid suppresses osteoclastogenesis despite increasing the receptor activator of nuclear factor kappaB ligand/osteoprotegerin ratio in human bone marrow stromal cells. J Endocrinol. 2005;185:401-413.
- Brunetti G, D’Amelio P, Mori G, Faienza MF. Editorial: Updates on Osteoimmunology: What’s New on the Crosstalk Between Bone and Immune Cells. Front Endocrinol (Lausanne). 2020 Feb 20;11:74.
- Sardaro N, Della Vella F, Incalza MA, DI Stasio D, Lucchese A, Contaldo M, Laudadio C, Petruzzi M. Oxidative Stress and Oral Mucosal Diseases: An Overview. In Vivo. 2019 Mar-Apr;33(2):289-296.
- Yousefzadeh G, Larijani B, Mohammadirad A, Heshmat R, Dehghan G, Rahimi R, Abdollahi M. Determination of oxidative stress status and concentration of TGF-beta 1 in the blood and saliva of osteoporotic subjects. Ann N Y Acad Sci. 2006 Dec;1091:142-50.
- Sies H. Oxidative stress. London: Academic Press; 1985.
- Yang, R.; Li, J.; Zhang, J.; Xue, Q.; Qin, R.; Wang, R.; Goltzman, D.; Miao, D. 17β-estradiol plays the anti-osteoporosis role via a novel ESR1-Keap1-Nrf2 axis-mediated stress response activation and Tmem119 upregulation. Radic. Biol. Med. 2023, 195, 231–244
- Huang, L.; Lu, S.; Bian, M.; Wang, J.; Yu, J.; Ge, J.; Zhang, J.; Xu, Q. Punicalagin attenuates TNF-α-induced oxidative damage and promotes osteogenic differentiation of bone mesenchymal stem cells by activating the Nrf2/HO-1 pathway. Cell. Res. 2023, 430, 113717.
- Wang, L.; Liang, Y.; Zhou, X.; Tian, Y.; Miao, Z.; Ko, C.-C.; Hu, X. Nrf2 differentially regulates osteoclast and osteoblast differentiation for bone homeostasis. Biophys. Res. Commun. 2023, 674, 19–26.
- Li S, Yang W, Li A, Zhang L, Guo L. Protective effect of Nrf2 in periodontitis – A preclinical systematic review and meta-analysis. Arch Oral Biol. 2023 Jul;151:105713
- Nabeshima, T.; Tsukamoto, M.; Wang, K.-Y.; Mano, Y.; Arakawa, D.; Kosugi, K.; Tajima, T.; Yamanaka, Y.; Suzuki, H.; Kawasaki, M.; et al. Delayed cortical bone healing due to impaired nuclear Nrf2 translocation in COPD mice. Bone 2023, 173, 116804
- Glasauer, A.; Chandel, N.S. ROS. Curr. Biol. 2013, 23, R100–R102.
- Valko, M.; Leibfritz, D.; Moncol, J.; Cronin, M.T.; Mazur, M.; Telser, J. Free radicals and antioxidants in normal physiological functions and human disease. J. Biochem. Cell Biol. 2007, 39, 44–84.
- Filaire E, Toumi H. Reactive oxygen species and exercise on bone metabolism: friend or enemy? Joint Bone Spine. 2012 Jul;79(4):341-6.
- Almeida M, Martin-Millan M, Ambrogini E, Bradsher R 3rd, Han L, Chen XD, Roberson PK, Weinstein RS, O’Brien CA, Jilka RL, Manolagas SC. Estrogens attenuate oxidative stress and the differentiation and apoptosis of osteoblasts by DNA-binding-independent actions of the ERalpha. J Bone Miner Res. 2010 Apr;25(4):769-81.
- Lean JM, Jagger CJ, Kirstein B, Fuller K, Chambers TJ. Hydrogen peroxide is essential for estrogen-deficiency bone loss and osteoclast formation. Endocrinology. 2005 Feb;146(2):728-35.
- Baek KH, Oh KW, Lee WY, Lee SS, Kim MK, Kwon HS, Rhee EJ, Han JH, Song KH, Cha BY, Lee KW, Kang MI. Association of oxidative stress with postmenopausal osteoporosis and the effects of hydrogen peroxide on osteoclast formation in human bone marrow cell cultures. Calcif Tissue Int. 2010 Sep;87(3):226-35.
- Golbidi S, Li H, Laher I. Oxidative Stress: A Unifying Mechanism for Cell Damage Induced by Noise, (Water-Pipe) Smoking, and Emotional Stress-Therapeutic Strategies Targeting Redox Imbalance. Antioxid Redox Signal. 2018 Mar 20;28(9):741-759.
- Wang J, Hu C, Ma X, Zhang Y, Zhang X, Hong X, Chen L, Wang Y, Wang J, Chen S, Zhang Q, Wu Y, Wu M, Chen Y, Song Z, Sun X, Zhao S, Huang S. The role of oxidative stress biomarkers in the development of peri-implant disease: A systematic review and meta-analysis. J Dent. 2024 Jul;146:105026
- Hajishengallis G, Sahingur SE. Novel inflammatory pathways in periodontitis. Adv Dent Res. 2014 May;26(1):23-9
- Sczepanik FSC, Grossi ML, Casati M, Goldberg M, Glogauer M, Fine N, Tenenbaum HC. Periodontitis is an inflammatory disease of oxidative stress: We should treat it that way. Periodontol 2000. 2020 Oct;84(1):45-68
- Mori G, D’Amelio P, Faccio R, Brunetti G. The Interplay between the bone and the immune system. Clin Dev Immunol. 2013:720504 .
- Guder C, Gravius S, Burger C, Wirtz DC, Schildberg FA. Osteoimmunology: A Current Update of the Interplay Between Bone and the Immune System. Front Immunol. 2020 Jan 31;11:58.
- Ikeuchi T, Moutsopoulos NM. Osteoimmunology in periodontitis; a paradigm for Th17/IL-17 inflammatory bone loss. Bone. 2022 Oct;163:116500
- Villalobos V, Silva I, Morales D, Canelo J, Garrido M, Carreño LJ, Cavalla F, Dutzan N, Caceres M. Topological insight of immune-vascular distribution in peri-implantitis lesions. Oral Dis. 2024 Nov;30(8):5305-5314
- Su L, Zheng J, Wang Y, Zhang W, Hu D. Emerging progress on the mechanism and technology in wound repair. Biomedicine & Pharmacotherapy. 2019 Sep;117:109191.
- Ribatti D, Crivellato E. Immune cells and angiogenesis. J Cell Mol Med. 2009 Sep;13(9A):2822-33
- Brylka LJ and Schinke T. Chemokines in Physiological and Pathological Bone Remodeling. Immunol. 2019. 10:2182.
- Schmidt-Bleek K, Kwee BJ, Mooney DJ, Duda GN. Boon and Bane of Inflammation in Bone Tissue Regeneration and Its Link with Angiogenesis. Tissue Eng Part B Rev. 2015 Aug;21(4):354-64.
- Motoki DS, Mulliken JB. The healing of bone and cartilage. Clin Plast Surg. 1990 Jul;17(3):527-44
- Tsukasaki M, Takayanagi H. Osteoimmunology: evolving concepts in bone-immune interactions in health and disease. Nat Rev Immunol. 2019 Oct;19(10):626-642.
- Mohideen K, Chandrasekaran K, Veeraraghavan H, Faizee SH, Dhungel S, Ghosh S. Meta-Analysis of Assessment of Total Oxidative Stress and Total Antioxidant Capacity in Patients with Periodontitis. Dis Markers. 2023 Oct 30;2023:9949047
- Liu R, Nikolajczyk BS. Tissue Immune Cells Fuel Obesity-Associated Inflammation in Adipose Tissue and Beyond. Front Immunol. 2019 Jul 17;10:1587.
- Murray CE, Coleman CM. Impact of Diabetes Mellitus on Bone Health. Int J Mol Sci. 2019 Sep 30;20(19):4873.
- Karam BS, Chavez-Moreno A, Koh W, Akar JG, Akar FG. Oxidative stress and inflammation as central mediators of atrial fibrillation in obesity and diabetes. Cardiovasc Diabetol. 2017 Sep 29;16(1):120.
- Nibali L, Gkranias N, Mainas G, Di Pino A. Periodontitis and implant complications in diabetes. Periodontol 2000. 2022 Oct;90(1):88-105
- Sawa M, Ushiyama A, Inaba Y, Hattori K. Increased oxidative stress and effects on inflammatory cytokine secretion by heated tobacco products aerosol exposure to mice. Biochem Biophys Res Commun. 2022 Jun 25;610:43-48.
- Golbidi S, Li H, Laher I. Oxidative Stress: A Unifying Mechanism for Cell Damage Induced by Noise, (Water-Pipe) Smoking, and Emotional Stress-Therapeutic Strategies Targeting Redox Imbalance. Antioxid Redox Signal. 2018 Mar 20;28(9):741-759.
- Javed F, Rahman I, Romanos GE. Tobacco-product usage as a risk factor for dental implants. Periodontol 2000. 2019 Oct;81(1):48-56.
- Reis INRD, do Amaral GCLS, Hassan MA, Villar CC, Romito GA, Spin-Neto R, Pannuti CM. The influence of smoking on the incidence of peri-implantitis: A systematic review and meta-analysis. Clin Oral Implants Res. 2023 Jun;34(6):543-554.
- Sanchez-Borges M, Shiohara T, Thong BY. International Consensus on drug allergy. Allergy. 2014 Apr;69(4):420-37.
- French D, Noroozi M, Shariati B, Larjava H. Clinical retrospective study of self-reported penicillin allergy on dental implant failures and infections. Quintessence Int. 2016;47(10):861-870.
- Basma HS, Misch CM. Extraction Socket Grafting and Ridge Augmentation Failures Associated with Clindamycin Antibiotic Therapy: A Retrospective Study. Int J Oral Maxillofac Implants. 2021 Jan-Feb;36(1):122-25.
- Michael F Holick. Vitamin D deficiency. N Engl J Med. 2007 Jul 19;357(3):266-81.
- Bikle DD. Vitamin D metabolism, mechanism of action, and clinical applications. Chem Biol. 2014 Mar 20;21(3):319-29.
- Chen L, Yang R, Qiao W, Zhang W, Chen J, Mao L, Goltzman D, Miao D. 1,25-Dihydroxyvitamin D exerts an antiaging role by activation of Nrf2-antioxidant signaling and inactivation of p16/p53-senescence signaling. Aging Cell. 2019 Jun;18(3):e12951.
- Liu PT, Stenger S, Li H, Wenzel L, Tan BH, Krutzik SR, Ochoa MT, Schauber J, Wu K, Meinken C, Kamen DL, Wagner M, Bals R, Steinmeyer A, Zügel U, Gallo RL, Eisenberg D, Hewison M, Hollis BW, Adams JS, Bloom BR, Modlin RL. Toll-like receptor triggering of a vitamin D-mediated human antimicrobial response. Science. 2006 Mar 24;311(5768):1770-3.
- Wang Q, He Y, Shen Y, Zhang Q, Chen D, Zuo C, Qin J, Wang H, Wang J, Yu Y. Vitamin D inhibits COX-2 expression and inflammatory response by targeting thioesterase superfamily member 4. J Biol Chem. 2014 Apr 25;289(17):11681-11694.
- Zhou A, Hyppönen E. Vitamin D deficiency and C-reactive protein: a bidirectional Mendelian randomization study. Int J Epidemiol. 2023 Feb 8;52(1):260-271.
- Acipinar S, Karsiyaka Hendek M, Olgun E, Kisa U. Evaluation of FGF-23 and 25(OH)D3levels in peri-implant sulcus fluid in peri-implant health and diseases. Clin Implant Dent Relat Res. 2019 Oct;21(5):1106-1112
- Mangano F, Mortellaro C, Mangano N, Mangano C. Is Low Serum Vitamin D Associated with Early Dental Implant Failure? A Retrospective Evaluation on 1625 Implants Placed in 822 Patients. Mediators Inflamm. 2016;2016:5319718
- Mandal CC. High Cholesterol Deteriorates Bone Health: New Insights into Molecular Mechanisms. Front Endocrinol (Lausanne). 2015 Oct 23;6:165.
- Papi P, Di Murro B, Pranno N, Bisogni V, Saracino V, Letizia C, Polimeni A, Pompa G. Prevalence of peri-implant diseases among an Italian population of patients with metabolic syndrome: A cross-sectional study. J Periodontol. 2019 Dec;90(12):1374-1382
- Blanco C, Liñares A, Dopico J, Pico A, Sobrino T, Leira Y, Blanco J. Peri-implantitis, systemic inflammation, and dyslipidemia: a cross-sectional biochemical study. J Periodontal Implant Sci. 2021 Oct;51(5):342-351.
- Armand Keuroghlian, Ana Dilza Viana Barroso, Gary Kirikian, Olga Bezouglaia, Yin Tintut, Sotirios Tetradis, Peter Moy, Flavia Pirih, Tara Aghaloo. The effects of hyperlipidemia on implant osseointegration in the mouse femur J Oral Implantol. 2015 Apr;41(2):e7-e11.
- Truong TQ, Brodeur MR, Falstrault L, Rhainds D, Brissette L. Expression of caveolin-1 in hepatic cells increases oxidized LDL uptake and preserves the expression of lipoprotein receptors.J Cell Biochem. 2009 Nov 1;108(4):906-15.
- Choukroun E, Parnot M, Surmenian J, Gruber R, Cohen N, Davido N, Simonpieri A, Savoldelli C, Afota F, El Mjabber H, Choukroun J. Bone Formation and Maintenance in Oral Surgery: The Decisive Role of the Immune System-A Narrative Review of Mechanisms and Solutions. Bioengineering (Basel). 2024 Feb 16;11(2):191
- Morganti P, Fabrizi G, Bruno C. Protective effects of oral antioxidants on skin and eye function. 2004 Nov-Dec;3(6):310-6.
- McCarty MF, Lewis Lujan L, Iloki Assanga S. Targeting Sirt1, AMPK, Nrf2, CK2, and Soluble Guanylate Cyclase with Nutraceuticals: A Practical Strategy for Preserving Bone Mass. Int J Mol Sci. 2022 Apr 26;23(9):4776
- Benjamin M. Savasky, David P. Mascotti , Naren Patel, and Edgardo Rodriguez-Collazo. Nutritional and Pharmacological Effects on Oxidative Stress in Soft Tissue and Bone Remodeling. Journal of Nutrition and Metabolism Volume 2018, 4183407
- Holick MF, Binkley NC, Bischoff-Ferrari HA, Gordon CM, Hanley DA, Heaney RP, Murad MH, Weaver CM; Endocrine Society. Evaluation, treatment, and prevention of vitamin D deficiency: an Endocrine Society clinical practice guideline. J Clin Endocrinol Metab. 2011 Jul;96(7):1911-30.
- Carr AC, Maggini S. Vitamin C and Immune Function. Nutrients. 2017 Nov 3;9(11):1211.
- Gęgotek A, Skrzydlewska E. Antioxidative and Anti-Inflammatory Activity of Ascorbic Acid. Antioxidants (Basel). 2022 Oct 7;11(10):1993.
- Li X, Tang L, Lin YF, Xie GF. Role of vitamin C in wound healing after dental implant surgery in patients treated with bone grafts and patients with chronic periodontitis. Clin Implant Dent Relat Res. 2018 Oct;20(5):793-798.
- Ustianowski Ł, Ustianowska K, Gurazda K, Rusiński M, Ostrowski P, Pawlik A. The Role of Vitamin C and Vitamin D in the Pathogenesis and Therapy of Periodontitis-Narrative Review. Int J Mol Sci. 2023 Apr 5;24(7):6774.
- Chitimus DM, Popescu MR, Voiculescu SE, Panaitescu AM, Pavel B, Zagrean L, Zagrean AM. Melatonin’s Impact on Antioxidative and Anti-Inflammatory Reprogramming in Homeostasis and Disease. Biomolecules. 2020 Aug 20;10(9):1211.
- Wu X, Qiao S, Wang W, Zhang Y, Shi J, Zhang X, Gu W, Zhang X, Li Y, Ding X, Wei J, Gu Y, Lai H. Melatonin prevents peri‑implantitis via suppression of TLR4/NF-κB. Acta Biomater. 2021 Oct 15;134:325-336.
- O’Connor JP, Kanjilal D, Teitelbaum M, Lin SS, Cottrell JA. Zinc as a Therapeutic Agent in Bone Regeneration. Materials (Basel). 2020 May 12;13(10):2211.
- Makke A. VitaminD Supplementation for Prevention of Dental Implant Failure: A Systematic Review. Int J Dent. 2022 Jan 12;2022:2845902
- Hsu E, Pacifici R. From Osteoimmunology to Osteomicrobiology: How the Microbiota and the Immune System Regulate Bone. Calcif Tissue Int. 2018 May;102(5):512-521.
- Akbari S, Rasouli-Ghahroudi AA. Vitamin K and Bone Metabolism: A Review of the Latest Evidence in Preclinical Studies. Biomed Res Int. 2018 Jun 27;2018:4629383.
- Vallibhakara SA, Nakpalat K, Sophonsritsuk A, Tantitham C, Vallibhakara O. Effect of Vitamin E Supplement on Bone Turnover Markers in Postmenopausal Osteopenic Women: A Double-Blind, Randomized, Placebo-Controlled Trial. 2021 Nov 25;13(12):4226.
- Rondanelli M, Faliva MA, Infantino V, Gasparri C, Iannello G, Perna S, Riva A, Petrangolini G, Tartara A, Peroni G. Copper as Dietary Supplement for Bone Metabolism: A Review. Nutrients. 2021 Jun 29;13(7):2246.
- Veronese N, Pizzol D, Smith L, Dominguez LJ, Barbagallo M. Effect of Magnesium Supplementation on Inflammatory Parameters: A Meta-Analysis of Randomized Controlled Trials. 2022 Feb 5;14(3):679.
- Bao M, Zhang K, Wei Y, Hua W, Gao Y, Li X, Ye L. Therapeutic potentials and modulatory mechanisms of fatty acids in bone. Cell Prolif. 2020 Feb;53(2):e12735.
- Keuroghlian A, Barroso AD, Kirikian G, Bezouglaia O, Tintut Y, Tetradis S, Moy P, Pirih F, Aghaloo T. The effects of hyperlipidemia on implant osseointegration in the mouse femur. J Oral Implantol. 2015 Apr;41(2):e7-e11.
- Choukroun J, Khoury G, Khoury F, Russe P, Testori T, Komiyama Y, Sammartino G, Palacci P, Tunali M, Choukroun E. Two neglected biologic risk factors in bone grafting and implantology: high low-density lipoprotein cholesterol and low serum vitamin D. J Oral Implantol. 2014 Feb;40(1):110-4.
- Duve C. Influence of glucagon, an inducer of cellular autophagy, on some physical properties of rat liver lysosomes. J Cell Biol. 1967 May;33(2):437-49.
- Ohsumi Y, Mizushima N. Two ubiquitin-like conjugation systems essential for autophagy. Semin Cell Dev Biol. 2004 Apr;15(2):231-6.
- Emmons R, Niemiro GM, De Lisio M. Exercise as an Adjuvant Therapy for Hematopoietic Stem Cell Mobilization. Stem Cells Int. 2016;2016:7131359