Entre 4 et 6 millions d’implants dentaires sont posés chaque année en Europe et les volumes progressent avec le vieillissement de la population. La pose de 3 implants sur 10 en moyenne nécessite le recours à une procédure d’augmentation osseuse. Le principe la Régénération Osseuse Guidée (ROG) est de créer un espace entre le défaut osseux et le tissu mou gingival afin de promouvoir le remodelage osseux. Différentes solutions en ROG sont utilisées par les chirurgiens-dentistes.
L’os autologue prélevé sur le ramus ou le menton du patient est le plus souvent utilisé car il contient des cellules ostéoprogénitrices, des facteurs de croissance et une matrice support de la régénération osseuse. Néanmoins, cette approche de transplantation osseuse nécessite la création de deux sites chirurgicaux avec une extension significative du temps opératoire. De plus, le stock osseux du patient est limité et la greffe osseuse autologue présente souvent une résorption importante et imprévisible.
L’os de banque allogénique sous forme de blocs ou granulés constitue une première alternative à la greffe osseuse autologue en ROG. L’os allogénique provient le plus souvent de têtes fémorales prélevées sur donneurs vivants lors de la pose de prothèses de hanche. Ce matériau est débarrassé de tout élément cellulaire par différentes techniques telles que la cryogénation, la lyophilisation, la déminéralisation ou le lavage par différents solvants avant sa stérilisation par irradiation gamma. Cet os de banque contient du collagène le plus souvent minéralisé et des facteurs de croissance qui vont favoriser l’adhésion et la différenciation des cellules ostéoprogénitrices et la revascularisation du site. Cependant, les risques de rejet immunologique ou de transmission d’agents pathogènes ne peuvent être totalement exclus avec l’os allogénique. De plus, la grande variabilité de la qualité des greffons en fonction de l’origine et des traitements effectués ne peuvent pas totalement garantir une constance dans la régénération osseuse.
Les xenogreffres provenant d’os bovin, équin ou de la transformation de corail sont des biomatériaux très populaires en ROG car ils font l’objet de nombreuses publications cliniques. Ils sont composés de phosphate de calcium apatitiques dont la cristallinité est proche du minéral osseux. Ces biomatériaux issus de ressources animales possèdent des priorités d’ostéoconduction qui ne permettent pas la régénération osseuse de grands volumes et présentent toujours des risques de rejet ou de transmission de pathogènes.
Les substituts osseux synthétiques, à base de phosphate de calcium, sont également utilisés en ROG car ils présentent des propriétés ostéoconductrices. En modulant leur composition chimique et la température de frittage, il est possible de contrôler dans une certaine mesure leur bioactivité et leur dégradation. Néanmoins, ces biomatériaux ont des propriétés de ROG insuffisantes pour régénérer de grands défauts et se retrouvent très souvent encapsulés dans un tissu fibreux.
Une membrane de ROG est fréquemment associée au matériau d’augmentation osseuse. Apposée entre le matériau de comblement et la surface intérieure du lambeau gingival, l’action de la membrane est triple : empêcher la prolifération des cellules épithéliales, favoriser la migration des cellules osseuses et s’opposer à la résorption du greffon. La grande majorité des membranes sont à base de collagène d’origine animale (ex. peau de porcs, péricarde bovin) et sont réticulées chimiquement pour ralentir leur resorption et accroître leur fonction de barrière dans le temps. Néanmoins, ces membranes collagéniques se résorbent en quelques semaines alors que le ROG nécessite en général 6 mois pour permettre l’insertion des implants.
Nous avons développé une nouvelle membrane synthétique bicouche résorbable pour la ROG (Tisseos®, Biomedical Tissues). Composée d’Acide Polylactique-Polyglycolique (PLGA) un polymère largement utilisé dans les dispositifs médicaux (ex. sutures), cette membrane est totalement biocompatible et biodégradable. Elle présente une structure bicouche avec un film dense pour un effet barrière optimal et une couche de microfibres enchevêtrée dont la structure est favorable à la prolifération cellulaire et à la ROG [1].
Cette structure bicouche procure également des propriétés mécaniques facilitant sa pose chirurgicale et sa fixation au tissu osseux. Enfin, sa composition chimique garantit un effet barrière optimal pendant la phase cicatrisation gingivale et une résorption totale entre 4 et 6 mois compatible avec le temps nécessaire à la ROG. A titre d’exemple, un cas clinique de ROG avec un substitut osseux et la membrane synthétique est présenté sur la Figure 1. Lors de la découverture à 6 mois, la membrane s’est dégradée et le biomatériau est encore bien visible. Le volume osseux reconstruit permet la mise en place d’implants mais le biomatériau est toujours présent et l’analyse histologique montre une néoformation osseuse incomplète.
Dans le cadre du projet Européen REBORNE, nous avons proposé une alternative thérapeutique à la greffe osseuse autologue qui utilise les cellules souches mésenchymateuses amplifiées en culture et associées extemporanément au biomatériau [2].
Ces cellules souches adultes sont multi-potentes capables de se différencier en ostéoblastes, chondrocytes ou adipocytes et ainsi régénérer différents tissus. Cependant, ces cellules de la cicatrisation sont présentes en très faible proportion (0.01-0.001%) dans nos tissus et la proportion diminue fortement avec l’âge. La moelle osseuse est un réservoir naturel de cellules souches mésenchymateuses (CSM). On sait depuis longtemps isoler les CSM par leurs propriétés d’adhésion au plastique et les multiplier en culture. Dans le cadre du projet Reborne, nous avons standardisé la production de CSM de grade clinique dans les unités de thérapie cellulaire en France, Allemagne, Italie et Espagne (EFS Créteil, Toulouse, DRK Ulm, Policlinico Milan, UAM Hospital La Paz à Madrid). La culture cellulaire s’effectue dans des salles blanches dans un milieu de culture contenant du lysat plaquettaire humain [3].
Figure 1 : cas clinique de ROG avec biomatériau de beta-TCP et membrane PLGA synthétique avant pose d’implants.
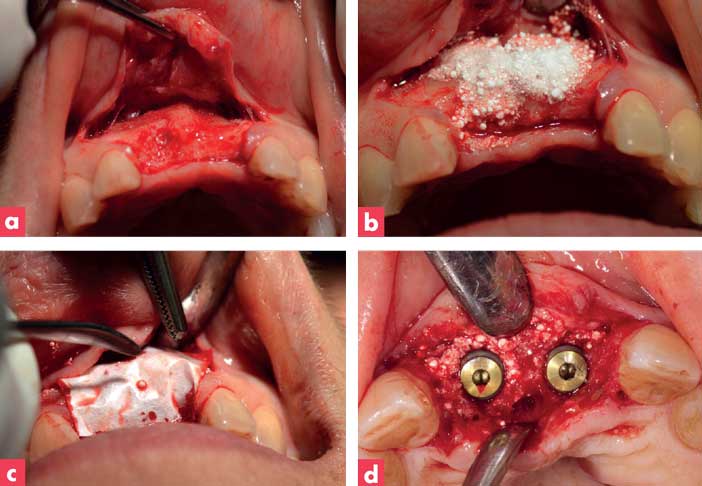
(a) défaut osseux, (b) apposition de granules beta-TCP, (c) couverture avec la membrane, (d) insertion des implants à 6 mois.
A partir d’un prélèvement de 30 ml de moelle osseuse, plusieurs centaines de millions de CSM sont produites en 3 semaines de culture. Comme le montre la Figure 2, les CSM humaines associées à des granules de phosphate de calcium, permettent la formation d’un tissu osseux après 8 semaines en site sous-cutané chez la souris [4,5]. Cette préparation extemporanée de cellules fixée au biomatériau peut également régénérer des défauts osseux de taille critique chez le gros animal. Après avoir démontré l’efficacité et la sécurité pré-clinique de cette “cellule médicament”, nous avons proposé un protocole clinique aux comités éthiques et aux agences réglementaires.
Figure 2
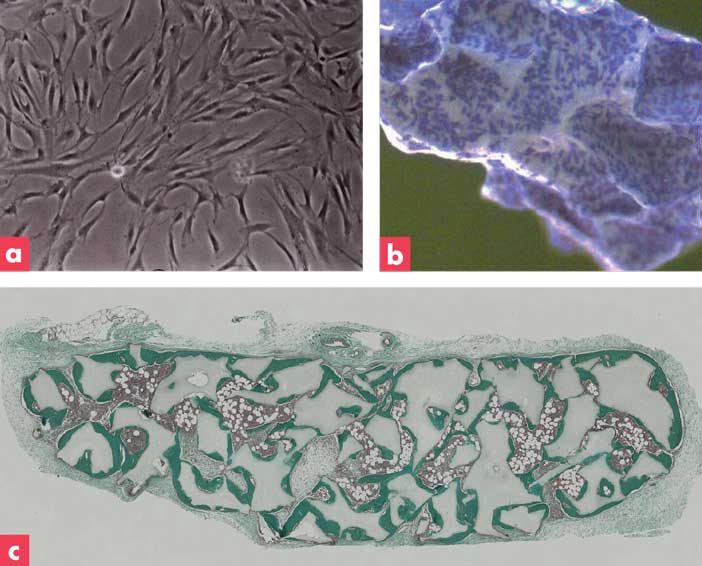
(a) cellules souches mésenchymateuses humaines en culture, (b) adhésion ex-temporané des CSM sur les granulés de phosphate de calcium (bleu de méthylène), (c) formation d’os ectopique en site sous cutané chez la souris (coloration trichrome de Masson).
En 2014, un essai clinique sur l’augmentation de la crête osseuse mandibulaire avec des CSM autologues associées au biomatériau a été autorisé à Bergen en Norvège. Nous avons démontré la sécurité et l’efficacité en régénération osseuse de cette nouvelle approche thérapeutique sur 11 patients. A 6 mois, l’augmentation osseuse a été validée en clinique, par imagerie scanner et par histologie sur des biopsies (Figure 3).
Figure 3 : essai clinique d’augmentation osseuse avec cellules souches et biomatériau
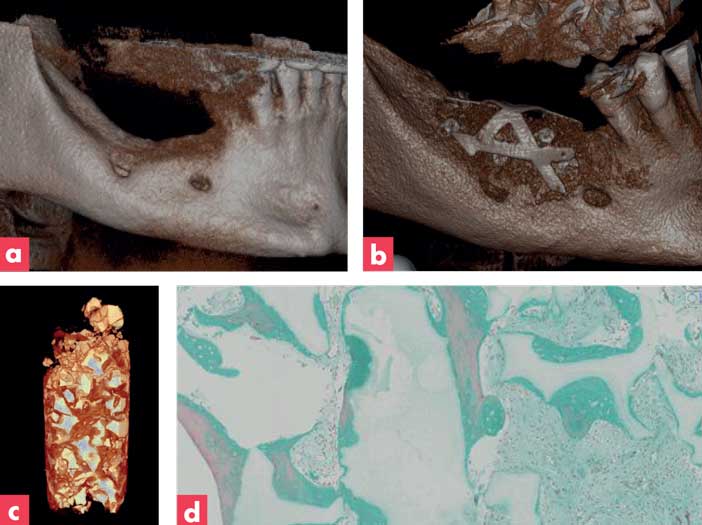
(a) scanner pré opératoire, (b) scanner à 6 mois, (c) micro-scanner, (d) histologie de la biopsie 6 mois après la ROG (coloration trichrome de Masson).
L’insertion d’implants dans ces sites reconstruits a été possible et leur ostéointégration démontrée par analyse radio fréquence [6,7]. L’ensemble de cette recherche clinique constitue une première médicale et est en cours de publication.
Nous souhaitons poursuivre ces recherches cliniques par la réalisation d’un essai comparatif randomisé à l’échelle européenne sur 150 patients avec le soutien du programme européen H2020.
Autre piste d’amélioration : la source de cellules souches. Certes, pour l’instant, les cellules souches mésenchymateuses issues de la propre moelle osseuse du patient ont démontrées leur efficacité, mais nous envisageons de développer les greffes allogéniques faisant appel à des cellules souches mésenchymateuses provenant de donneurs sélectionnés et conservées dans des banques de cellules. On peut imaginer cultiver ces cellules dans des bioréacteurs, pour produire de grandes quantités dont on disposerait à volonté. Cela éviterait la très lourde logistique actuelle, avec un aller-retour des cellules entre l’hôpital où elles sont prélevées et le centre agréé de thérapie cellulaire où elles sont cultivées, sans compter le temps nécessaire – deux ou trois semaines –, pour en obtenir une quantité suffisante. C’est certain : la ROG, née dans les années 1990, n’a pas fini d’évoluer.
Bibliographie
1. Brennan MÁ, Renaud A, Gamblin AL, D’Arros C, Nedellec S, Trichet V, Layrolle P. 3D cell culture and osteogenic differentiation of human bone marrow stromal cells plated onto jet-sprayed or electrospun micro-fiber scaffolds. Biomed Mater. (2015) 10(4):045019.
2. Rosset P, Deschaseaux F, Layrolle P. Cell therapy for bone repair. Orthop Traumatol Surg Res. (2014) 100(1 Suppl):S107-12.
3. Chevallier N, Anagnostou F, Zilber S, Bodivit G, Maurin S, Barrault A, Bierling P, Hernigou P, Layrolle P, Rouard H. Osteoblastic differentiation of human mesenchymal stem cells with platelet lysate. Biomaterials. (2010) 31(2):270-8.
4. Gamblin AL, Brennan MA, Renaud A, Yagita H, Lézot F, Heymann D, Trichet V, Layrolle P. Bone tissue formation with human mesenchymal stem cells and biphasic calcium phosphate ceramics: the local implication of osteoclasts and macrophages. Biomaterials. (2014) 35(36):9660-7.
5. Brennan MÁ, Renaud A, Amiaud J, Rojewski MT, Schrezenmeier H, Heymann D, Trichet V, Layrolle P. Pre-clinical studies of bone regeneration with human bone marrow stromal cells and biphasic calcium phosphate. Stem Cell Res Ther. (2014) 5(5):114.
6. Rozé J, Babu S, Saffarzadeh A, Gayet-Delacroix M, Hoornaert A, Layrolle P. Correlating implant stability to bone structure. Clin Oral Implants Res. (2009) 20(10):1140-5.
7. Rozé J, Hoornaert A, Layrolle P. Correlation between primary stability and bone healing of surface treated titanium implants in the femoral epiphyses of rabbits. J Mater Sci Mater Med. (2014) 25(8):1941-51.





