L’utilisation des implants dentaires comme alternative à la perte dentaire, représente la thérapeutique de choix validée scientifiquement depuis de nombreuses années (1). L’utilisation des implants dans le traitement des édentements unitaires, sectoriels ou totaux permet aux patients de retrouver l’intégrité de leur denture (2). Le remplacement de dents par des implants peut avoir simplement un but fonctionnel comme restaurer la mastication chez les édentés totaux en réalisant des prothèses supra implantaires ou bien fixes.
Dans les secteurs antérieurs, l’implantation doit respecter des objectifs esthétiques pour harmoniser les tissus péri-implantaires et les éléments cosmétiques.
Les implants sont capables de remplacer les dents avec succès mais, comme pour la dent naturelle, se pose le problème de la pérennité à long terme des prothèses implanto-portées.
Les implants se comportent-ils différemment des dents ? Sont-ils susceptibles aux maladies parodontales (2) ? Le pronostic implantaire est-il supérieur au pronostic dentaire (3) ?
Les données actuelles sur ce sujet montrent malheureusement que l’idée d’un implant exempt de pathologie est remise en question (4). La pathologie infectieuse péri-implantaire est bien une réelle et nouvelle entité. Il nous faut reconsidérer notre position sur les états de surface macro et micro texturés (5-6) potentialisant l’ostéointégration et rendre fiable à long terme les restaurations implanto-portées (7). Les états de surface implantaires, lisses à l’origine ont évolué vers des textures micro et macro texturées, ceci afin d’augmenter la qualité et la rapidité de l’ostéointégration. A l’inverse, ces surfaces semblent très sensibles à l’infection en facilitant la colonisation bactérienne et diminuant la fiabilité des restaurations implantaires au long terme (8). L’enjeu va être de trouver la possibilité d’enrayer la perte osseuse péri-implantaire et de régénérer les tissus lésés.
Prévalence et différentes formes de péri implantites
Déjà en 1986, ALBRETISSON se posait la question de savoir s’il était normal qu’un implant perde de l’os au delà de sa première année. Nous constatons que le taux de péri-implantites évolue avec le temps. Le nombre d’implants posés a augmenté, c’est un fait, mais le type de poseurs aussi.
A l’origine, seuls des praticiens expérimentés posaient des implants mais actuellement avec la simplification de l’acte, nous trouvons des praticiens généralistes poseurs occasionnels, des praticiens généralistes poseurs confirmés et des spécialistes en implantologie.
Nos critères de succès se sont modifiés ainsi que les implants eux-mêmes : design, état de surface et type de restauration. Il faut dans les résultats prendre en compte ces critères mais aussi comparer entre eux les mêmes types d’implants. La prévalence des péri-implantites (9) semble se situer entre 7 et 9 %
On constate aussi que le taux de péri-implantites augmente avec le temps. Le pourcentage de péri-implantites est supérieur chez les édentés totaux aussi bien porteurs d’overdentures que de reconstitutions fixes en comparaison avec les bridges sectoriels ou les unitaires (10). Les résultats des études varient de 15 % (11) à 25 % ou 28 % (12). Ces mucosités sont comparables aux gingivites avec les mêmes signes cliniques (rougeur, œdème, saignement, etc.) et la même réversibilité. Leur prévalence avoisinerait 77 % à 15 ans. Les péri-implantites par analogie avec les parodontites c’est à dire perte d’attache et perte osseuse, présentent 2 formes principales : les péri implantites apicales et les péri-implantites proprement dites.
Elles se présentent sous 3 formes :
- les péri-implantites précoces, à différencier du défaut d’osteo-intégration, caractérisées par une perte extrêmement rapide de l’implant (moins d’un mois après la pose) avec des douleurs, suppurations et une expulsion spontanée des implants. Elles représenteraient environ 0.5 % des cas.
- la péri-implantite modérée dont la perte osseuse avoisine les 3 mm.
- la péri-implantite avancée, entre 1/3 et 1/2 de la hauteur de l’implant. Ces péri-implantites présentent une prévalence comprise entre 6 et 9 % des implants posés au-delà de 5 ans.
Après 10 ans, les études semblent montrer une stabilisation de la fréquence des pertes osseuses.
Quelle attitude adopter face à une péri-implantite ?
L’origine des péri-implantites est tout à fait superposable aux lésions parodontales (13), qu’il s’agisse de l’agent étiologique bactérien composé des bactéries destructrices anaérobies strictes, des complexes rouge et orange aussi bien que l’histopathologie de l’attache (14,15).
Au niveau histologique, le système d’attache de l’implant est différent de celui de la dent
Il faut le souligner, l’absence de desmodonte est extraordinairement défavorable à la réponse immune face aux agressions. L’implant est très fragile et répond mal aux attaques bactériennes. L’os, surtout l’os cortical, peu irrigué est très susceptible à l’infection et donc à la l’ostéolyse.
Le desmodonte représente en effet le système de défense de la dent, moyen de réparation (vascularisation et cellules pro génitrices in situ), d’adaptation et d’amortissement des surcharges occlusales (16).
D’autres facteurs associés, comme l’hygiène, la présence de foyers infectieux parodontaux, péri-apicaux dentaires, l’environnement mucogingival (17), le bruxisme et les maladies générales ou spécifiques intéressant le métabolisme osseux sont des facteurs aggravants ou favorisants.
Encore une fois, toute agression en l’absence de réparation desmodontale induira une destruction directe de l’os péri-implantaire.
Autre facteur : le tabac
Seul ou associé à l’alcoolisme, au stress (18) ; (19) : il induirait un risque de perte 30 fois plus élevé.
Enfin, au niveau de l’implant lui-même, positionnement, design, état de surface, matériau, volume osseux, proximités radiculaires ou implantaires (20), influeraient sur la survie des implants.
L’acte thérapeutique devra donc avoir pris en considération les facteurs aggravants précédemment cités, tenir compte du niveau d’alvéolyse mais aussi du type de lésion (verticale ou horizontale).
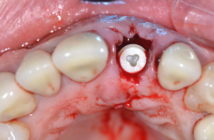
Dans le cas des péri-implantites modérées ou débutantes, la dépose des éléments prothétiques et un ré- enfouissement associé à des matériaux de comblements ou l’utilisation de membranes de régénération tissulaire donne d’excellents résultats(20) ; (21).
Une alvéolyse importante va conduire à envisager deux alternatives :
- soit les lésions sont horizontales – La meilleure attitude semble être une apicalisation des tissus avec ou non une modification de l’état de surface implantaire exposé à la maladie. Dans ce cas de figure, la surface sera meulée puis polie pour potentialiser l’efficacité des thérapeutiques de maintenance.
- soit nous interviendrons pour traiter les lésions osseuses angulaires en utilisant l’arsenal thérapeutique dont nous disposons pour traiter les lésions parodontales dentaires : débridement, comblements, régénération tissulaire, Emdogain®, etc.
La décontamination de la surface du titane reste le problème majeur dans ce type de chirurgie. Comment peut-elle être traitée ? Surtout, il ne faut en aucun cas en modifier les caractéristiques (22).
Les thérapeutiques non chirurgicales apparaissent inappropriées et inefficaces (23, 24, 25).
L’utilisation d’antiseptiques (Chlorhexidine, Hexetidine, H2O2, etc.) (26, 27) est sans effet sur la réparation osseuse aussi bien en non chirurgical qu’en per chirurgical.
Notre attitude doit surtout consister à modifier l’anatomie locale, faciliter le nettoyage, enlever les tissus infectés et traiter la surface implantaire (28).
En présence de lésions supra-osseuses La suppression des macro et microporosités présente un effet positif pour la cicatrisation et la maintenance des surfaces exposées à la maladie et contaminées. Dans les techniques chirurgicales additives ou reconstructrices en revanche, la modification de la surface implantaire n’a en aucun cas d’utilité ou d’indication. Il faut, de ce fait, être extrêmement prudent lors de l’élimination des tissus pathologiques en utilisant des curettes spécifiques ou en évitant de toucher la surface implantaire.
Les techniques de sablage ou polissage sont néfastes car elles détériorent de façon irréversible les qualités de la surface implantaire et par voie de conséquence les possibilités de réparation.
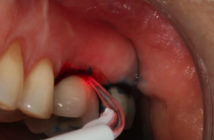
L’intérêt de techniques physiques efficaces sans détériorer la surface implantaire prend alors tout son sens (29). L’utilisation des lasers répond à cet impératif et semble donner les meilleurs résultats (30 ; 31 ; 32).
Dans le cas d’alvéolyse avancée, il faut être vigilant et ne pas compromettre les chances de pouvoir réimplanter ultérieurement. La quantité d’os résiduel doit être évaluée. Si besoin, il ne faut pas hésiter à explanter de façon à éviter par la suite des techniques de reconstruction osseuse lourdes.
Même dans les cas d’explantation, de surcroît quand le milieu est infecté, le traitement laser est utile.
L’effet de bio stimulation de l’os semble activer le potentiel de réparation local.
Les sources du rayonnement laser donnent des effets très différents : CO2, Diode, Er-Yag, Nd-Yag, etc. et tous ne sont pas adaptés au traitement des lésions péri-implantaires et de la décontamination des surfaces implantaires (33).
Les lasers CO2 en particulier, augmentent trop la température localement (34 ; 35 ; 36).
Les diodes très utiles en chirurgie des tissus mous ont un effet négatif sur les surfaces métalliques (37).
Les lasers Er-Yag semblent actuellement les plus polyvalents et les plus indiqués pour ce type de traitement (38).
L’action principale des lasers se fera à trois niveaux :
- l’élimination du tissu de granulation qui s’effectue sans risque de modifier ou endommager l’état de surface (39 ; 40). Le laser permet d’éliminer le tissu de granulation dans les zones difficiles à traiter par des moyens classiques une puissance de 400Mj et une fréquence de 17 Hz produiraient une énergie suffisante pour volatiliser les tissus sans altérations pour l’os ou l’implant (41 ; 42).
- le remodelage osseux obtenu avec une énergie de 300 mJ pour une fréquence de 25 Hz ne concernerait qu’environ 30 μm d’épaisseur osseuse. L’effet obtenu de volatilisation des tissus infiltrés permettrait aussi la bio stimulation de la vascularisation. L’effet de bio stimulation augmente la production de PDGF et la réparation osseuse. La production de PDGF qui s’arrête normalement au 2ème jour, resterait active au-delà de la 2ème semaine (43). La revascularisation serait aussi plus intense dans les zones traitées.
- enfin, l’utilisation du rayonnement laser sur la surface implantaire apparaît supérieure à toute autre technique pour nettoyer les porosités de surface de la smear layer, des débris tissulaires et des bactéries. Une puissance de 60 mJ supprimerait 99,5 % des bactéries (44) tandis qu’une puissance de 120 mJ permettrait le nettoyage de 99,94 % toujours sans altération de la surface. L’effet obtenu est aussi positif sur l’élimination des dépôts tartriques pouvant recouvrir la surface de l’implant.
Quelques précautions sont à prendre comme veiller à n’être pas trop près de la surface implantaire et éviter les énergies fortes. On parle de rayonnement Low dose ou Low energy. Ce sont des puissances de 120 à 150 mJ pour des fréquences ne dépassant pas 45 Hz qui sont conseillées (45).
En conclusion
- Quelles questions doit-on se poser lorsque nous posons des implants ?
- Quel pourcentage de nos patients revoyons-nous ?
- Quelle est la fréquence des visites de contrôle ?
- Quels sont nos critères d’examen ?
- Y-a-t-il des cas favorables ? Des patients qui résistent mieux ?
- A-t-on des problèmes avec les patients à haut degré d’hygiène ?
- Avons-nous évalué lors de la pose, les facteurs de risque ?
- Existe-t-il des états de surface plus favorables ?
Notre activité doit alors viser à arrêter la progression de la maladie en changeant l’environnement péri-implantaire et agissant à la fois sur la flore bactérienne et les agents favorisants.
Les traitements chirurgicaux sont la seule voie à utiliser pour mettre en place ces thérapies.
La fragilité de la surface implantaire est le point faible de la réparation. Actuellement, les thérapies utilisant le laser et en particulier les lasers Er-Yag, montrent une efficacité maximale. L’action des lasers cible en effet l’élimination des tissus infectés, le traitement des surfaces osseuses et la bio-stimulation de la réponse histologique des tissus ainsi que la production de PGF.
Enfin, le laser reste le moyen le plus efficace de stériliser et de nettoyer sans modifier la surface de l’implant.
Les surfaces implantaires sont à la fois clé de l’ostéointégration mais aussi de l’apparition de péri-implantites. Si les surfaces très texturées apparaissent comme les meilleures pour l’ostéointégration, à l’inverse elles semblent les moins bonnes pour l’évolution des péri-implantites.
En dehors des traitements réparateurs, l’effort de la recherche devra donc se porter sur la découverte de nouveaux états de surface voire de nouveaux matériaux.
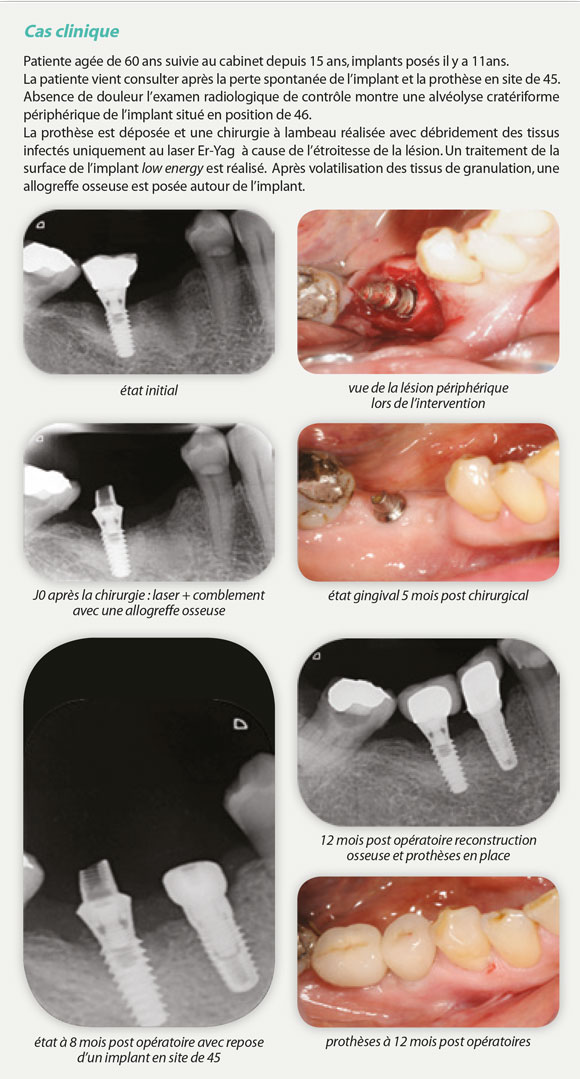
Bibliographie
1. Adell R, Eriksson B, Branemark PI, Jemt T. Long term follow-up study of osseointegrated implants in the treatment of totally edentulous jaws. Int J Oral Maxillofac Implants 1990; 5:347-359)
2. Lindhe J, Berglundh T, Ericsson I, liljenberg B, Marinello C (1992). Experimental breakdown of peri-implant and periodontal tissues: a study in the beagle dog. Clinical oral implant research3, 9-16
3. Berglundh T,Zitmmann NU, Donati M (2011). Are peri-implantitis lesions different from periodontitis lesions? Journal of clinical periodontology 38 (suppl.11), 188-202)
4. Lang NP, Berglundh T (2001) Peri-implant diseases: where are we now? Consensus of the European Workshop on periodontology. Journal of clinical periodontology 38 (suppl.11), 178-181
5. Albouy JP, Abrahamson I, Person LG, Berglundh T (2008). Spontaneous progression of ligatured induced peri-implantitis at implants with different surface characteristics: an experimental study in dogs II histological observations. Clinical oral implant research 20, 366-371
6. Ranvert S, Polyzois I, Claffey N (2011). How do implant surface characteristics influence peri-implant disease? Journal of Clinical Periodontology 38 (Suppl. 11), 214-222
7. Wennerberg A, Albrektsson T (2009). Effects of titanium surface topography one bone integration: a systematic review. Clinical Oral Implant Implant Research 20(suppl. 4), 172-184,
8. Quirynen M, Van Der Meil HC, Bollen et al. An in vivo study of the influence of the surface roughness of implants on the microbiology of supra and subgingival plaque. J Dent Res 1993; 72: 1304-1309
9. Zitzmann NU, Berglundh T. Definition and prevalence of peri-implant diseases. J. Clin Periodontol 2008; 35(8supl); 286-291
10. Roos-Jansaker AM, Lindahl C, Ranvert H, Ranvert S. Nine–to fourteen year follow-up of implant treatment. Part II: presence of peri-implant lesions. J Clin Periodontol 2006; 33: 290-295…)
11. Lindhe J, Meyle J, Group D of European workshop on periodontology; Peri-implant diseases: consensus report of the sixth European workshop on periodontology. J Clin Periodontol 2008; 35 (8suppl); 282-285
12. Koldsland OC, Scheie AA, Aass AM. Prevalence of subjects with progressive bone loss at implants. Clin Oral Implants Res 2005; 16: 440-446
13. Rams TE, Link CC. Microbiology of failing dental implants in humans: electron microscopic observations. J Oral implantol 1983; 11: 93-100
14. Monbelli A. Etiology, diagnosis and treatment considerations in perimplantatis : our opin Periodontol 1997; 4: 127-136
15. Monbelli A. Microbiology and antimicrobial therapy of peri-implantitis. Periodontl 2000-2002; 28: 177-189
16. Costa FO, Takena -Martinez S, Cota LOM et al . Peri-implant disease in subjects with and without preventive maintenance : a 5 year follow-up. J Clin Periodontol 2012; 39: 173-181
17. Linkevicius T, Apse P, Pros D Grybauskas et al. The influence of soft tissue thickness on crestal bone changes around implants : a 1-year prospective controlled clinical trial. Int J Oral Maxillofac Implants 2009; 24: 712-719
18. Stretzel FP, Reichert PA, Kale A, Kulkarni M, Wegner B, Kucher I. Smoking interferes with the prognosis of dental implant treatment : a systematic review and meta-analysis. J Clin Periodontol 2007; 34; 523-544
19. Galindo-Moreno P, Fauri M, Avila G, Fernandez JE, Cabrera A, Sanchez E. Influence of alcohol and tobacco habits on peri-implant marginal bone loss : a prospective study. Clin Oral Implants Res 2005; 16/579-586…
20. Albouy JP, AbrahamsonI, Person LG, Breglundh T. (2008) – Spontaneous progression of peri-implantitis at different types of implants: an experimental study in dogs I: clinical and radiographic observations. Clinical oral implants research 19, 997-1002
21. Casati MZ, Sallum EA, Nociti FH et al. Enamel matrix derivative and bone healing after guided bone regeneration in dehiscence–type defects around implants : a histomorphometric study in dogs. J Periodontol 2012; 39: 666-673
22. Schwarz F, Sculean A, Berakdar M, Szathmari L, Georg T, Becker J. In vivo and in vitro effects of an Er:YAG laser, a GaAlAs diode laser, and scaling and root planning on periodontally diseased root surfaces: a comparative histologic study. Lasers Surg Med 2003; 32(5): 359- 366.
23. Schou S, Berglundh T, Lang NP. Surgical treatment of peri-implantitis. Int J Oral Maxillofac Implants 2004; 19:140-149
24. Schwarz F, Sculean A, Rothamel D, Schwenzer K, Georg T, Becker J. Clinical evaluation of an Er:YAG laser for nonsurgical treatment of peri-implantitis : a pilot study. Clin Oral Implants Res 2005; 16(1):44 – 52.
25. Muthukuru M, Zaivi A, Esplugues EO, Flemming TF. Non-surgical therapy for management of perimplantitis : a systematic review. Clin Oral Implants Res 2012; 23: 77-83
26. Schartz F , Bieling K , Bonsamann M et al Nonsurgical treatment of moderate and advanced peri-implantitis lesions : a controlled clinical study. Clin Oral Invest 2006; 10:279-288
27. Eriksson I, Persson LG, Berglundh T, Edlund T, Lindhe J. The effect of antimicrobial therapy on peri-implantitis lesions : an experimental study in dog. Clin Oral Implants Res 1996; 7: 320-328
28. Esposito M, Grusovin MG, Worthington HV. Treatment of peri-implantitis; what interventions are effective? A Cochrane systematic review. Eur J Oral Implantol 2012; 5 suppl.: 21-41
29. Matsuyama T, Aoki A, Oda S, Yoneyama T, Ishikawa I. Effects of the Er:YAG laser irradiation on titanium implant materials and contaminated implant abutment surfaces. J Clin Laser Med Surg 2003; 21(1):7-17.
30. BachG, Neckel C, Mall C, Krekeler G. Conventional versus laser assisted therapy of periimplantitis : a five years comparative study. Implant Dent 2000; 9: 257-251
31. Schwarz F, Rothamel D, Sculean A, Georg T, Scherbaum W,
Becker J. Effects of an Er:YAG laser and the Vector ultrasonic system on the biocompatibility of titanium implants in cultures of human osteoblast-like cells. Clin Oral Implants Res 2003; 14(6): 784-792.
32. Marotti J, Tortamano P, Cai S et al. Decontamination of dental implant surfaces by means of photodynamic therapy. Lasers Med Sci 2013; 28: 303-309
33. Geisinger ML, Holmes C, Vassipoulos P, Reddy M (2013). Is laser disinfection an effective adjunctive treatment to bone augmentation for peri-implantitis? A rewiev of current evidence. Journal of periodontology, 2013; 10:1-11
34. Tosun E, Tasar F, Strauss R et al. Comparative evaluation of antimicrobial effects of Er-YAG, diode and C02 Lasers on titanium discs : an experimental study. J Oral Maxillofac Surg 2012; 70: 1064-1069
35. Romanos GE and Nentwig GH .Regenerative therapy of deep peri-implant infrabony defect after C02 laser implant surface decontamination? Int J Periodontics Restorative Dent 2008; 2-
36. Mouhyi J, Sennerby L, Nammour S, Guillaume P Van Reck J. Temperature increases during surface decontamination of titanium implants using CO2 laser. Clin Oral Imp Res 1999; 10:54-618: 245-255
37. Takasi AA, Aoki A, Mitzutani K et al. Application of antimicrobial photodynamic therapy in periodontal and peri-implant diseases. Periodontol 2000-2009; 52: 109-140 Hayeek RRA, Araujo NS, Gioso MA. Comparative study between the effects of photodynamic therapy and conventional therapy on microbial reduction in ligature induced peri-implantitis in dogs. J Periodontol 2005; 76/1275-1281
38. Kreisler M, Kohnen W, Cristoffers AB. et al. In vitro evaluation of biocompatibility of contamined implant surfaces treated with an Er:YAG Laser and an air powder system. Clin Oral Implants Res 2005; 16: 36-43
39. Haas R, Dortbudak O, Mensdorff G. Elimination of bacteria on different surfaces trough photosensitization and soft laser. Clin Oral Implants res. 1997; 8: 249 – 254
40. Ando Y, Aoki A, Watanabe H, Ishikawa I. Bactericidal effect of erbium YAG laser on periodontopathic bacteria. Lasers Surg Med 1996; 19 (2):190 – 200.
41. Eberhard J, Ehlers H, Falk W, Acil Y, Albers HK, Jepsen S. Efficacy of subgingival calculus removal with Er:YAG laser compared to mechanical debridement: An in situ study. J Clin Periodontol 2003; 30 (6): 511 – 518
42. Ranvert S, Lindhal C, Roos – Jansaker AM , Person GR . Treatment of peri-implantitis using an Er-YAG laser or an air abrasive device: a randomized clinical trial. J Clin Periodontol 2011; 38: 65-73
43. Kesler G, Kesler D, Siman Y, Romanos G. Platelet derived growth factors secretion and bone healing after Er -YAG laser bone irradiation. Journal of Oral Implantol 2011; vol 37:195-204
44. Bader C, Krejc I.indications and limitations of Er-Yag laser applications .American Journal Of Dentistry 2009; June, vol.19; 3:178-186)
45. Romanos GE, Gutknecht N, Dietr S et al. Laser wavelenghts and oral implantology. Laser med sci 2009; 24: 961-970