Les implants se sont banalisés pour restaurer ou maintenir la fonction masticatrice et préserver l’esthétique des patients. cependant, les praticiens ont constatés que des manifestations inflammatoires ou infectieuses se produisaient dans des situations cliniques particulières. En outre, l’expérience du praticien(1) ou la qualité médiocre d’un système implantaire(2) semblent avoir une influence sur la fréquence des complications ou la survie implantaire.
Diagnostic
Les critères de santé péri-implantaire sont l’absence d’inflammation péri-implantaire (la muqueuse est rose) et d’œdème, les tissus mous sont fermes. Le saignement au sondage léger (0,25N) ne provoque éventuellement qu’un saignement punctiforme. Après un an de fonction, la lyse osseuse marginale ne doit pas dépasser 2 mm(3). La mucosite ou lésion inflammatoire des tissus mous péri implantaires, sans lyse osseuse de l’os péri-implantaire de soutien est due essentiellement à un déséquilibre entre l’accumulation microbienne et la réponse de l’hôte. Cette inflammation caractérisée cliniquement par une augmentation de la profondeur de sondage, un saignement marginal marqué après sondage avec parfois une suppuration, de la rougeur, de l’œdème de la muqueuse marginale est réversible après un contrôle optimal du
biofilm(3,4) Les mécanismes d’évolution vers la péri-implantite ne sont pas complètement élucidés. Les signes cliniques d’inflammation de la mucosite sont parfois plus marqués
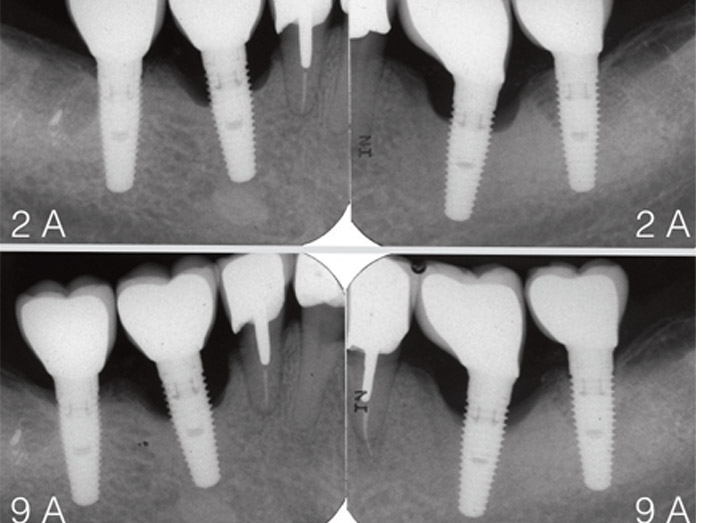
Fig.1. : parodontite de stade 3, grade B chez une patiente de 46 ans, fumeuse, avec un diabète de type 1. Absence de suivi parodontal et péri-implantites constatées 2 ans après prothèse. Réévaluation 7 ans après, toujours sans suivi parodontal. La patiente consulte pour des signes inflammatoires muqueux. La progression de la lyse osseuse est limitée.
mais le diagnostic est conforté par l’augmentation, sur des radiographies, de la lyse osseuse péri-implantaire par rapport à une radiographie de référence prise 1 an après la mise en fonction prothétique. En l’absence de cette référence une lyse osseuse ≥3mm et un sondage ≥6mm associés à un saignement abondant révèlent une péri implantite. cette lyse osseuse peut-être aussi évaluée en clinique en calculant la progression par année(3). Mais comme en parodontie, une évolution lente peut succéder à une progression rapide de la lyse osseuse, malgré des facteurs de risque non contrôlés (Fig. 1).
Prévalence
Des études longitudinales ou rétrospectives ont mis en évidence le risque élevé de péri-implantite avec un passé de parodontite, un contrôle de plaque insuffisant, une maintenance parodontale irrégulière. Les évidences sont contradictoires sur l’importance du tabac, du diabète(5). Ces conclusions sont nuancées par une autre revue systématique qui estime que le tabac est un facteur de risque, mais pas un facteur déterminant pour le développement d’une maladie péri-implantaire(6). ce risque de développer une péri-implantite serait 4 fois supérieur par rapport aux non fumeurs et anciens fumeurs(7). Le patient diabétique de type 2 avec une glycémie mal contrôlée basculerait quant à lui vers un état hyper-inflammatoire du fluide péri-implantaire(8). Les implants à surface rugueuse présenteraient malgré une maintenance régulière un taux de survie implantaire réduit(9). La prévalence moyenne pondérée, par sujet, de la mucosite et de la parodontite déterminées par une revue systématique avec meta-analyse est respectivement de 43 % (19 % à 65 %) et 22 % (1 % à 47 %)(10). La durée d’observation après mise en fonction devrait être d’au moins 10 ans, car la prévalence de péri-implantite augmente avec la durée du suivi. Ainsi dans une étude rétrospective, une augmentation de la prévalence par patient de 8,4 % à 16 % est constatée entre 5 et 10 ans de suivi(11). Pour une lyse osseuse >2 mm et un suivi moyen à plus long terme de 23,3 ans la prévalence de péri-implantite par patient est de 22 %(12).
Il est important de comprendre les mécanismes étio pathogéniques et les facteurs/indicateurs de risque associés à la péri-implantite afin d’adapter le traitement aux conditions du patient. L’étude du biofilm péri-implantaire est complexe en raison des caractéristiques physiques et chimiques de la surface implantaire et de l’interaction avec le microbiome parodontal(13). Des différences entre la composition de la flore parodontale et péri-implantaire dans des conditions de santé ou de maladie n’ont pas été démontrées dans une revue systématique. Les auteurs suggérant que le traitement anti-infectieux de la parodontite ou de la péri-implantite pourrait être comparable(14). toutefois, l’étude du microbiome montre par rapport à la
parodontite une flore plus complexe avec des espèces gram- non cultivables(15).
En parodontie, la dysbiose du microbiome parodontal provoquerait une altération du micro-environnement, ce qui induirait une sélection et une prolifération de bactéries
spécifiques modulée par la réaction inflammatoire. Les bactéries parodonto-pathogènes seraient le résultat d’une modification du biofilm et de la présence des poches parodontales. La demande d’un contrôle de plaque performant pour tous, devrait évoluer vers un traitement adapté au patient : contrôler l’inflammation pour contrôler l’infection(16).
Chez des patients à maintenance régulière stricte et à contrôle de plaque plutôt performant sur 5 ans (indice de plaque moyen initial 8,6 % et 15,2 % à 5 ans), il n’y a pas d’incidence de la variation de hauteur de muqueuse kératinisée sur l’état péri-implantaire(17). Néanmoins, deux études ont constatées qu’une hauteur péri-implantaire ≥2 mm réduisait le risque de mucosite et de péri-implantite chez des patients à maintenance irrégulière(18,19).
Principesdestraitement
La perception par les cliniciens du pronostic défavorable du traitement des péri-implantites est soutenue par une revue systématique(20) qui montrait pour certaines études une récidive de 100 % des cas, lors d’un suivi supérieur à 1 an. cependant des meta-analyses plus récentes observent 5 ans après des traitements divers, une survie implantaire pour 90 % des implants et 85 % des patients et une survie
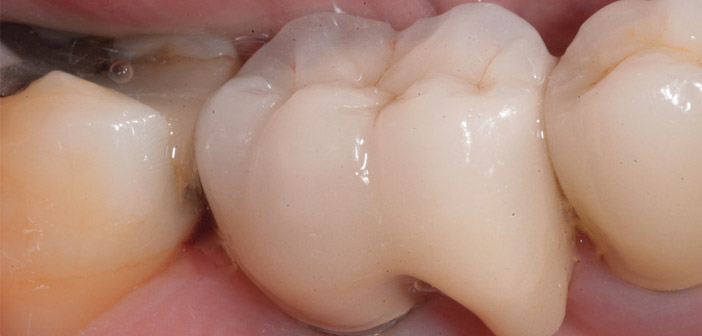
Fig.2a : péri-implantites chez un patient de 53 ans, présentant un diabète de type 2 avec HbA1c de 8 associé à une parodontite de stade 3, grade B. Les dépôts de tartre sont abondants et l’indice de plaque est de 64 %. Une thérapeutique nonchirurgicale d’assainissement par détartrage-surfaçage radiculaire a été réalisée sous anesthésie locale en 1 séance. L’objectif initial était de contrôler la parodontite et de déposer ultérieurement l’implant en 46. Aspect cyanotique de la muqueuse marginale. Le sondage périphérique sur 46 est de 8 à 10 mm. Plaque et saignement au sondage sur tous les sites. Sur 46 débridement par ultrasons avec insert plastique, irrigations sousgingivales par eau-oxygénée, puis polyvidone iodée. Antibiothérapie systémique par amoxicilline-metronidazole.
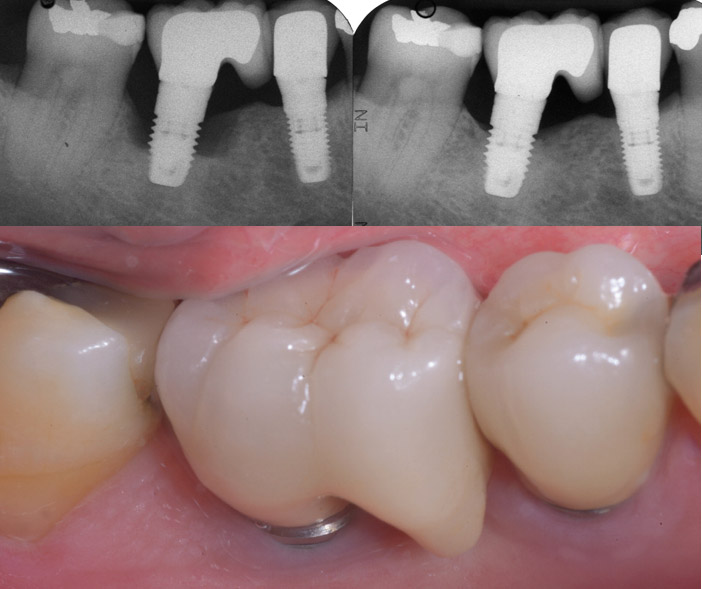
Fig.2b : radiographie initiale avec lyse osseuse exposant 4 à 5 spires. Radiographie 3 ans après l’assainissement parodontal. La reminéralisation osseuse atteint la 1ère spire. / Fig.2c : la muqueuse marginale est normale. Récession de 1 mm et sondage limité à 3 mm. La cicatrisation est obtenue malgré un contrôle de plaque difficile (indice de plaque réduit à 50 %). Les dépôts (tartre et plaque) sont contrôlés par des visites de maintenance tous les 3 mois.
implantaire sur 80 % des patients après 7 ans si une maintenance parodontale régulière est réalisée sur les dents et les implants(21). Une thérapeutique non-chirurgicale doit toujours précéder le traitement chirurgical d’une péri implantite. cela permet de réduire la charge microbienne de la cavité orale, de réduire ou de supprimer l’inflammation de la muqueuse péri-implantaire et de s’assurer de la coopération du patient.
Un traitement non-chirurgical efficace est toujours possible(22) (Fig. 2) mais le plus souvent en cas d’échec ou de résultat insuffisant les alternatives seront la dépose de l’implant (Fig. 3) ou le traitement chirurgical(23,24) (Fig. 4).
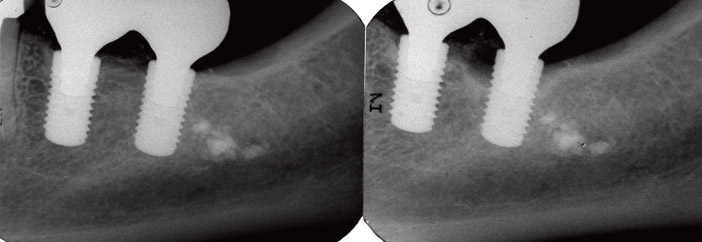
Fig.3a : radiographies sur 37 après 3 ans de fonction. Noter l’excès de ciment transitoire qui n’a pas pu être éliminé malgré un débridement sous-gingival.
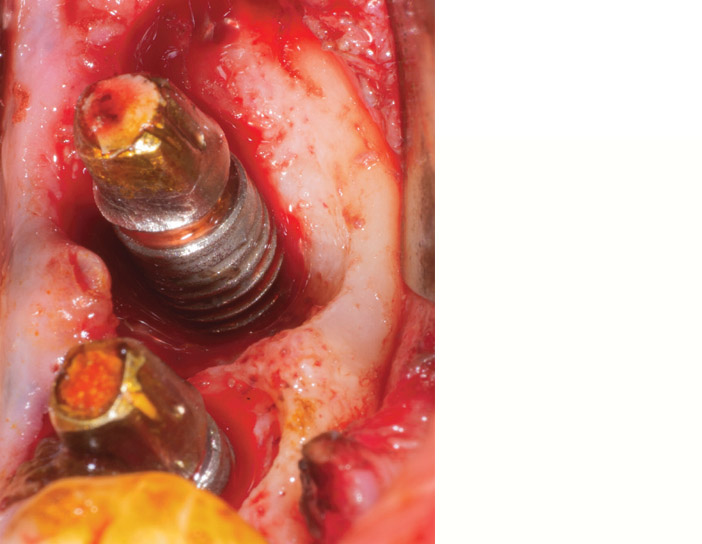
Fig.3b : le patient présente un contrôle de plaque performant, sans problème parodontal et l’état général est satisfaisant. L’os alvéolaire est épais et favorable pour une cicatrisation spontanée, après dépose. L’implant de remplacement, posé 3 mois après est fonctionnel depuis 4 ans, sans signe inflammatoire.
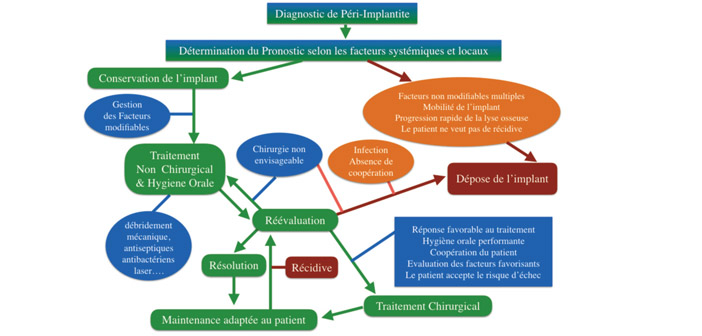
Fig.4 : arbre de décision. Adapté à partir de Wang et al.(24)
L’association d’une décontamination de l’état de surface par aéro-polisseur avec poudre de glycine et irrigations sous-gingivales répétées de polyvidone iodée montre sur des péri implantites et après un an, une amélioration des paramètres cliniques(25), tandis que la prescription systémique d’amoxicilline-metronidazole ne montre pas d’amélioration(25,26).
Débridementchirurgical
Dans une étude rétrospective et un suivi moyen de 3,3 ans l’accès chirurgical diminuait fortement la progression des péri-implanties, par rapport au traitement non
chirurgical(27).
Une revue systématique sur le débridement chirurgical des lésions supra-osseuses avec ou sans implantoplastie (élimination des spires et polissage) souligne le manque d’étude randomisée(28). L’accès chirurgical réduit l’inflammation la première année, tandis que l’implanto plastie améliore les paramètres cliniques et radiographiques à 3 ans(29). Mais cette intervention doit-être réservée à des secteurs non-esthétiques en raison de l’apicalisation des tissus mous pour supprimer les poches(28) (Fig. 5)
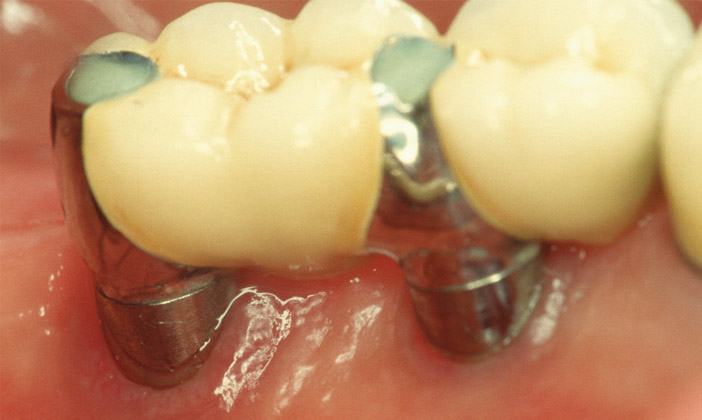
Fig.5a : péri-implantite chez un patient de 66 ans, sans suivi parodontal malgré une parodontite avancée et du bruxisme. L’inflammation est diffuse en lingual de l’implant en 36. Le sondage est de 6 mm.
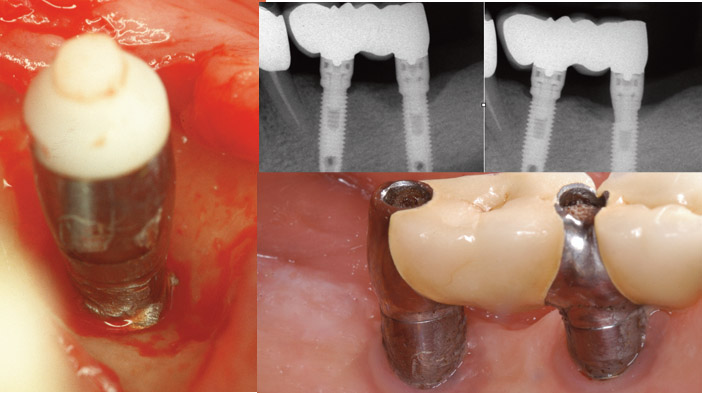
Fig.5b : lambeau d’accès. Ostéoplastie linguale et préservation de l’os crestal vestibulaire. Implantoplastie. L’implant est en titane lisse mais l’accès de l’instrumentation rotative est difficile. Le polissage obtenu sur ce cas ancien est insuffisant. / Fig.5c : radiographie avant implantoplastie et contrôle à 13 ans post-opératoire montrant une stabilité de l’os marginal après ostéoplastie.. / Fig.5d : vue clinique à 13 ans après, toujours sans suivi parodontal. La mucosite linguale persiste et le niveau osseux crestal est stable.
Pour une décontamination de la surface implantaire, l’acide citrique, le delmopinol, les irrigations par de la chlorhexidine, la pulvérisation de poudre abrasive, le polissage avec de la ponce, le laser CO2 , les applications de coton imbibé de sérum physiologique ou de chlorhexidine ont été proposés avec des succès divers(30). cependant, aucun protocole de décontamination n’apparaît déterminant dans le succès chirurgical et l’approche photodynamique ou laser sont des alternatives intéressantes qui restent à valider(31).
Une technique d’augmentation chirurgicale avec des granules de titane poreux comparée au débridement chirurgical d’une lésion intra-osseuse ≥3 mm avec un angle ≤35° montrait après 1 an de suivi, un comblement radiographique significativement différent de 79 % contre 22 % pour le groupe contrôle. Une absence de différence entre les deux groupes était observée pour les valeurs cliniques de saignement au sondage et de profondeur des poches. La résolution de la maladie objectivée par une absence de saignement sur 6 sites et des poches parodontales superficielles était obtenue dans 30 % des sites comblés et 23 % des sites débridés(32). Le dilemmereste complexe pour les cliniciens car une revue systématique constate l’absence d’évidence sur la supériorité d’un matériau de comblement ou de membrane pour le bénéfice à long terme(33) (Fig. 6).
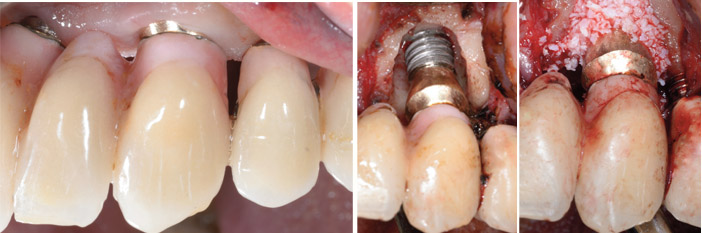
Fig.6a : patient de 65 ans, fumeur de cigare occasionnel, présentant de nombreux implants. L’état parodontal est contrôlé par une maintenance régulière. Périimplantite constatée 7 ans après la pose d’un implant à surface rugueuse. Le sondage de 7 mm est associé à du saignement et suppuration. L’inflammation de la muqueuse marginale est discrète. Le morphotype gingival est épais. / Fig.6b : après débridement de la lésion osseuse par curettes et inserts d’ultrasons, visualisation d’une lésion intra-osseuse périphérique avec préservation de la corticale linguale et fénestration vestibulaire exposant 5 spires. Décontamination de la surface implantaire par brosse titane, applications successives d’acide phosphorique, eau oxygénée, polyvidone iodée. / Fig.6c : régénération osseuse par des particules de xenogreffe d’origine bovine (Bio-Oss®, Geistlich) et recouvrement par membrane collagène porcin (Bio-Gide®, Geistlich).
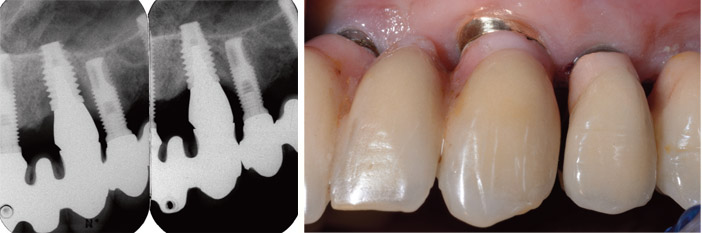
Fig.6d : radiographies sur l’implant en 23, de la lyse osseuse avant traitement chirurgical de la péri-implantite et 6 ans après. / Fig.6e : vue clinique 6 ans après traitement. La récession de la muqueuse marginale est inférieure à 1 mm et le sondage est de 5 mm. Le patient n’a plus présenté de signe inflammatoire sur ce site.
Le résultat chirurgical (lambeau apicalisé ou augmentation) ne serait pas dépendant de la présence ou non d’une bande initiale de muqueuse marginale kératinisée de 2 mm, mais plutôt de la sévérité de la lyse osseuse initiale(34). des facteurs chirurgicaux ou prothétiques complémentaires entraînant des difficultés d’hygiène orale pourraient prédisposer ou accélérer la péri-implantite, mais les évidences sur les thèmes suivants sont pour le moment limitées : malposition implantaire, épaisseur de l’os cortical marginal <1,5 mm, type de surface implantaire, enfouissement du plateau implantaire ≥6 mm par rapport à la jonction amélo cémentaire des dents adjacentes, proximités implantaires, torque de serrage de l’implant, connection pilier-implant, résidus de ciment de scellement, morphologie de l’émergence prothétique, durée de mise en fonction(35,36).
Le sur-contour du profil d’émergence sur un implant à plateau juxta-osseux interfère probablement avec le contrôle de plaque et augmente le risque de développer une pathologie péri-implantaire(37,38) (Fig. 7)
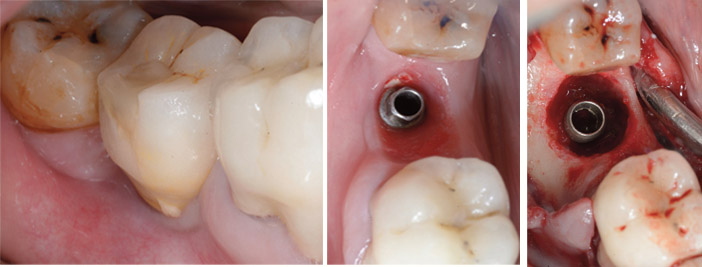
Fig.7a : péri-implantite sur implant transvissé sur 46. La patiente de 71 ans fume le cigare et présente une parodontite de stade 3, degré B, avec un indice de plaque de 83 %. Sondage de 8 à 10 mm en lingual de 46 et 7 à 9 mm en vestibulaire. / Fig.7b : une thérapeutique nonchirurgicale a été réalisée (semblable à la situation 2a). La patiente a arrêté de fumer, est devenue performante dans son contrôle de plaque, mais les signes locaux ne se sont pas améliorés. Après dépose de la couronne, vue du pilier prothétique lui aussi transvissé. Noter le bandeau vestibulaire étroit de muqueuse kératinisée et l’état inflammatoire de la muqueuse au niveau du profil d’émergence avec débris alimentaires en distal. / Fig.7c : accès chirurgical après débridement. La lésion circonférentielle est favorable à une technique de régénération osseuse. Décontamination de la surface rugueuse implantaire par ultrasons et curettes. Lésion intra-osseuse de 8 à 10 mm. Détoxification par applications successives, d’eau oxygénée, polyvidone iodée, aéropolissage avec glycine, comblement par Bio-Oss® puis Bio-Oss collagène® (Geistlich) en marginal pour contrôler le saignement abondant. Recouvrement par membrane en collagène porcin (Creos Xeno-Protect® (NobelBiocare) puis lambeaux coaptés. La couronne transvissée étant aussi replacée.
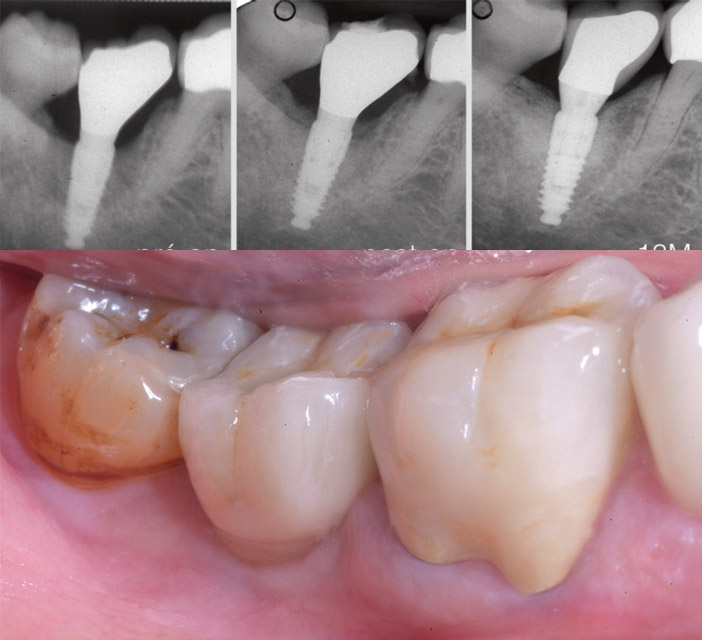
Fig.7d : radiographies de gauche à droite : pré-opératoire, post-opératoire, et 13 mois après l’intervention et le remplacement des couronnes en 46-47. / Fig.7e : à court terme, absence d’inflammation et sondage limité à 3 mm. Le contrôle de plaque reste performant.
Maintenance
La maintenance est caractérisée par l’élimination de la plaque par le patient et par le praticien, afin d’éviter ou de contrôler l’inflammation La nécessité d’associer des agents chimiques reste à démontrer et la périodicité des visites de rappel doit être adaptée comme en parodontie aux facteursde risque et aux spécificités liées à l’état général, l’âge élevé(39,40). Nos connaissances évoluent et les patients doivent être informés des facteurs limitant la survie implantaire.
Il est important au cours des visites de rappel d’alerter le patient et de traiter les premiers signes de mucosite, mais une résolution n’est pas constatée chez tous les patients(41). La réévaluation au cours des visites de maintenance doit considérer les modifications par rapport à la visite précédente. Elle implique d’évaluer l’état général, la cavité buccale, une dent et/ou un implant, un site. Les radiographies doivent être sélectives. L’interprétation des résultats sera ensuite discutée avec le patient afin d’adapter ou de modifier les mesures de prévention et décider s’il y a lieu de réaliser un traitement complémentaire(42).
Cas cliniques traités avec les Drs : Halhal R, Joly R, Menger PL, Murat A, Simonet P, Touati B.
Bibliographie
1. Chrcanovic BR, Kisch J, Albrektsson t, Wennerberg A. Impact of different surgeons on dental Implant failure. Int J Prosthodont. 2017;30:445–454.
2. Qian J, Wennerberg A, Albrektsson t. Reasons for marginal bone loss around oral implants. clin Implant dent Relat Res. 2012;14:792-807.
3. Renvert s, PerssongR, PirihfQ, camargo PM. Periimplant health, peri-implant mucositis, and peri-implantitis: case definitions and diagnostic considerations. J clinPeriodontol. 2018;45suppl 20:s278-s285.
4. Heitz-Mayfield LJ etsalvigE. Peri-implant mucositis. J clinPeriodontol. 2018;45suppl 20:s237-s245.
5. schwarz f, derks J, Monje A, Wang HL. Peri-implantitis. J clinPeriodontol. 2018;45suppl 20:s246-s266.
6. casado PL, Aguiar t, fernandesPinheiro MP, Machado A , da Rosa Pinheiro A. smoking as a Risk factor for the development of Periimplant diseases. Implant dent. 2019 ;28:120-124.
7. Meyle J, casado P, fourmousis I, Kumar P, Quirynen M, salvigE. general genetic and acquired risk factors, and prevalence of peri-implant diseases – consensus report of working group 1. Int dent J. 2019;69suppl 2:3-6.
8. corrêa Mg, Pimentel sP, Ribeirofv, ciranofR, casati MZ. Host response and peri-implantitis.Braz oral Res. 2019;33 (suppl 1):e066
9. Lin cy, chen Z, Pan WL, Wang HL. Is History of Periodontal disease still a Negative Risk Indicator for Peri-implant Health Under supportive Post-implant treatment coverage?A systematic Review and Metaanalysis.Int J oral Maxillofac Implants. 2020;35:52-62.
10. derks J, tomasi c. Peri-implant health and disease. A systematic review of current epidemiology. J clin Periodontol2015 ; 42 (suppl 16): s158–s171.
11. Pandolfi A, Rinaldo f, Pasqualotto d, sorrentino f, La torre g, guerra f. A retrospective cohort study on peri-implant complications in implants up to 10 years of functional loading in periodontally compromised patients. J Periodontol. 2019 dec 20. [Epubahead of print]
12. Renvert S, Lindahl C, Persson GR. Occurrence of cases with peri-implant mucositis or peri-implantitis in a 21-26 years follow-up study. J Clin Periodontol 2018b; 45:233–240.
13. Daubert DM, Weinstein BF. Biofilm as a risk factor in implant treatment. Periodontol 2000. 2019;81:29-40.
14. Retamal-Valdes B, Formiga MC, Almeida ML, Fritoli A, Figueiredo KA, Westphal M, Gomes P, Feres M. Does subgingival bacterial colonization differ between implants and teeth? A systematic review. Braz Oral Res. 2019;33(suppl 1):e064.
15. Lafaurie GI, Sabogal MA, Castillo DM, Rincón MV, Gómez LA, Lesmes YA, Chambrone L. Microbiome and Microbial Biofilm Profiles of Peri-Implantitis: A Systematic Review. J Periodontol. 2017;88:1066-1089.
16. Bartold PM, Van Dyke TE. Host modulation: controlling the inflammation to control the infection. Periodontol 2000. 2017;75:317-329.
17. Lim HC, Wiedemeier DB, Hämmerle CHF, Thoma DS. The amount of keratinized mucosa may not influence peri-implant health in compliant patients: A retrospective 5-year analysis. J Clin Periodontol. 2019;46:354-362.
18. Romanos G, Grizas E, Nentwig GH. Association of Keratinized Mucosa and Periimplant Soft Tissue Stability Around Implants With Platform Switching. Implant Dent. 2015;24:422-426.
19. Monje A, Blasi G. Significance of keratinized mucosa/gingiva on peri-implant and adjacent periodontal conditions in erratic maintenance compliers. J Periodontol. 2019;90:445-453.
20. Esposito M, Grusovin MG, Worthington HV. Treatment of peri-implantitis: what interventions are effective? A Cochrane systematic review. Eur J Oral Implantol. 2012;5 Suppl:S21-41.
21. Roccuzzo M, Layton DM, Roccuzzo A, Heitz-Mayfield LJ. Clinical outcomes of peri-implantitis treatment and supportive care: A systematic review. Clin Oral Implants Res. 2018;29 Suppl 16:331-350.
22. Renvert S, Hirooka H, Polyzois I, Kelekis-Cholakis A, Wang HL; Working Group 3. Diagnosis and non-surgical treatment of peri-implant diseases and maintenance care of patients with dental implants – Consensus report of working group 3. Int Dent J. 2019;69 Suppl 2:12-17.
23. Heitz-Mayfield LJ, Mombelli A. The therapy of peri-implantitis: a systematic review. Int J Oral Maxillofac Implants. 2014;29 Suppl:325-45.
24. Wang CW, Renvert S, Wang HL. Nonsurgical Treatment of Periimplantitis. Implant Dent. 2019 ;28:155-160.
25. Stein JM, Hammächer C, Michael SS. Combination of ultrasonic decontamination, soft tissue curettage, and submucosal air polishing with povidone-iodine application for non-surgical therapy of peri-implantitis: 12 Month clinical outcomes. J Periodontol. 2018;89:139-147.
26. Shibli JA, Ferrari DS, Siroma RS, Figueiredo LC, Faveri M, Feres M. Microbiological and clinical effects of adjunctive systemic metronidazole and amoxicillin in the non-surgical treatment of peri-implantitis: 1 year follow-up. Braz Oral Res. 2019;33(suppl 1):e080.
27. Karlsson K, Derks J, Håkansson J, Wennström JL, Petzold M, Berglundh T. Interventions for peri-implantitis and their effects on further bone loss: A retrospective analysis of a registry-based cohort. J Clin Periodontol. 2019;46:872-879.
28. Keeve PL, Koo KT, Ramanauskaite A, Romanos G, Schwarz F, Sculean A, Khoury F. Surgical Treatment of Periimplantitis with Non-Augmentative Techniques. Implant Dent. 2019;28:177-186.
29. Romeo E, Lops D, Chiapasco M, Ghisolfi M, Vogel G. Therapy of peri-implantitis with resective surgery. A 3-year clinical trial on rough screw-shaped oral implants. Part II: radiographic outcome. Clin Oral Implants Res. 2007;18:179-87.
30. Madi M, Htet M, Zakaria O, Alagl A, Kasugai S. Re-osseointegration of dental implants after periimplantitis treatments: a systematic review. Implant Dent. 2018;27(1):101-10.
31. Koo KT, Khoury F, Keeve PL, Schwarz F, Ramanauskaite A, Sculean A, Romanos G. Implant Surface Decontamination by Surgical Treatment of Periimplantitis: A Literature Review. Implant Dent. 2019;28:173-176.
32. Jepsen K, Jepsen S, Laine ML, Anssari Moin D, Pilloni A, Zeza B, Sanz M, Ortiz-Vigon A, Roos-Jansåker AM, Renvert S. Reconstruction of Peri-implant Osseous Defects : A Multicenter Randomized Trial. J Dent Res 2016;95 :58-66.
33. Ramanauskaite A, Obreja K, Sader R, Khoury F, Romanos G, Koo KT, Keeve PL, Sculean A, Schwarz F. Surgical Treatment of Periimplantitis With Augmentative Techniques. Implant Dent. 2019;28:187-209.
34. Ravidà A, Saleh I, Siqueira R, Garaicoa-Pazmiño C, Saleh MHA, Monje A, Wang HL. Influence of keratinized mucosa on the surgical therapeutical outcomes of peri-implantitis. J Clin Periodontol. 2020 Jan 7. doi: 10.1111/jcpe.13250. [Epub ahead of print]
35. Monje A, Insua A, Wang HL. Understanding Peri-Implantitis as a Plaque-Associated and Site-Specific Entity: On the Local Predisposing Factors. J Clin Med. 2019;8:E279
36. Zandim-Barcelos DL, Carvalho GG, Sapata VM, Villar CC, Hämmerle C, Romito GA. Implant-based factor as possible risk for peri-implantitis. Braz Oral Res. 2019;33(suppl 1):e067.
37. Katafuchi M, Weinstein B, Leroux B, Chen YW, Daubert D. Restoration Contour Is a Risk Indicator for Peri-Implantitis: A Cross-Sectional Radiographic Analysis J Clin Periodontol. 2018;45, 225-232.
38. Salvi GE, Cosgarea R, Sculean A. Prevalence of Periimplant Diseases. Implant Dent. 2019;28:100-102.
39. Heitz-Mayfield LJA, Salvi GE, Mombelli A, Loup PJ, Heitz F, Kruger E, Lang NP. Supportive peri-implant therapy following anti-infective surgical peri-implantitis treatment: 5-year survival and success. Clin Oral Implants Res. 2018;29:1-6.
40. Kelekis-Cholakis A, Rothney J. Maintenance of Implant Patients: A Narrative Review. Implant Dent. 2019;28:161-172.
41. Jepsen S, Berglundh T, Genco R, Aass AM, Demirel K, Derks J, et al. Primary prevention of peri-implantitis: managing peri-implant mucositis. J Clin Periodontol. 2015;42 Suppl 16:S152-7.
42. Mombelli A. Maintenance therapy for teeth and implants. Periodontology 2000. 2019 ;79 :190-199.