MOTS CLÉS : Microbiote/ Entamoeba gingivalis / Trichomonas tenax / Trogocytose / Microbiome
MICROBIOTE ORAL
Songez, en lisant ces lignes, que nous avons, tous, environ 10 milliards de microorganismes dans notre cavité buccale… Ce qui en fait le deuxième microbiote après le microbiote intestinal (100 000 milliards). Notre mission de chirurgien-dentiste est de maintenir ou de rétablir la santé orale de nos patients, d’apporter des solutions afin de redonner confort, fonction, esthétique à des femmes et des hommes qui ont été affectés dans leur santé buccale. Mission importante quand on sait que les pathologies parodontales peuvent-être impliquées dans des maladies systémiques (diabète, maladies cardiovasculaires, polyarthrites rhumatoïdes, maladies pulmonaires, Alzheimer…). (1)
COMMENT SE CONSTITUE CE MICROBIOTE ORAL
Sa mise en place est très rapide, des communautés microbiennes sont détectées dans la bouche et le nasopharynx dans les minutes qui suivent la naissance. Ce « kit de démarrage » microbien maternel est généralement constitué de bactéries d’origine vaginale, anorectale et cutanée. Il n’en demeure pas moins que 85% des microbiotes buccaux de la mère et du nourrisson sont communs les premiers mois de la vie. Le microbiote oral serait acquis vers 2 ans. Vers 6 mois, la mise en place des dents va favoriser l’apparition des bactéries capables d’adhérer à l’émail ainsi que la création de nouvelles niches écologiques telles que le sillon gingival, l’anatomie dentaire, s’intégrant dans les structures déjà existantes, comme la langue hérissée de papilles, les gencives, le palais, le versant interne des lèvres, les joues. Chacune de ces niches, dotées de caractéristiques physicochimiques propres (acidité, teneur en oxygène, température…) abrite un microbiote singulier. La salive et le fluide gingival fournissent des nutriments pour la croissance bactérienne, mais contiennent également des composés anti-microbiens. Cette dichotomie de l’écosystème buccal tout à la fois nourricier et hostile est nécessaire au développement d’un microbiote équilibré, garant d’un bon état de santé. (2) Cependant, cet équilibre peut être rompu sous l’effet de plusieurs paramètres intrinsèques ou hexogènes, comme les changements transitoires et réversibles (changements hormonaux, puberté-grossesse) mais aussi dysfonctionnement salivaire, mauvaise hygiène buccale, traitement iatrogène, tabagisme, stress (3), défaillance immunitaire, mode de vie, échange salivaire, alimentation…
En 2018, l’équipe de Jesse WILLIS, de l’IST de Barcelone (4), montre que l’hygiène dentaire, les habitudes alimentaires, la qualité des eaux de boisson, influent notablement la composition des microbiotes buccaux. La rupture de l’équilibre au sein du microbiote buccal, structure complexe, peut entrainer une dysbiose, qui est une perturbation de l’ensemble de l’écosystème. (5) Par exemple, le genre Neisseria serait associé à un parodonte sain, alors que les genres Prevotella et Veillonella seraient plus abondants dans le cas de maladies parodontales. (6)
Cependant, il s’agit d’une approximation sommaire et la compréhension de ces phénomènes nécessite une analyse taxonomique plus importante et la prise en compte plus exhaustive de la communauté des microorganismes réunis au sein du biofilm.
En l’absence d’action mécanique (brossage dentaire), le biofilm croit en trois dimensions et accueille toujours plus de microorganismes. La compréhension de la biologie des différents « acteurs » du biofilm passe donc par la connaissance de leurs interactions ainsi que par l’analyse du milieu (sillon gingival, poche parodontale par exemple), dans lequel ils se développent.
VARIATION DES MICROORGANISMES DURANT LES PARODONTITES
Les micro-organismes présents dans les parodontites ne sont pas limités aux bactéries. La microscopie (Fig. 1-2-3) et les évolutions récentes des technologies de séquençage permettent d’aborder la question de la présence d’organismes non bactériens dans le microbiome de la parodontite.
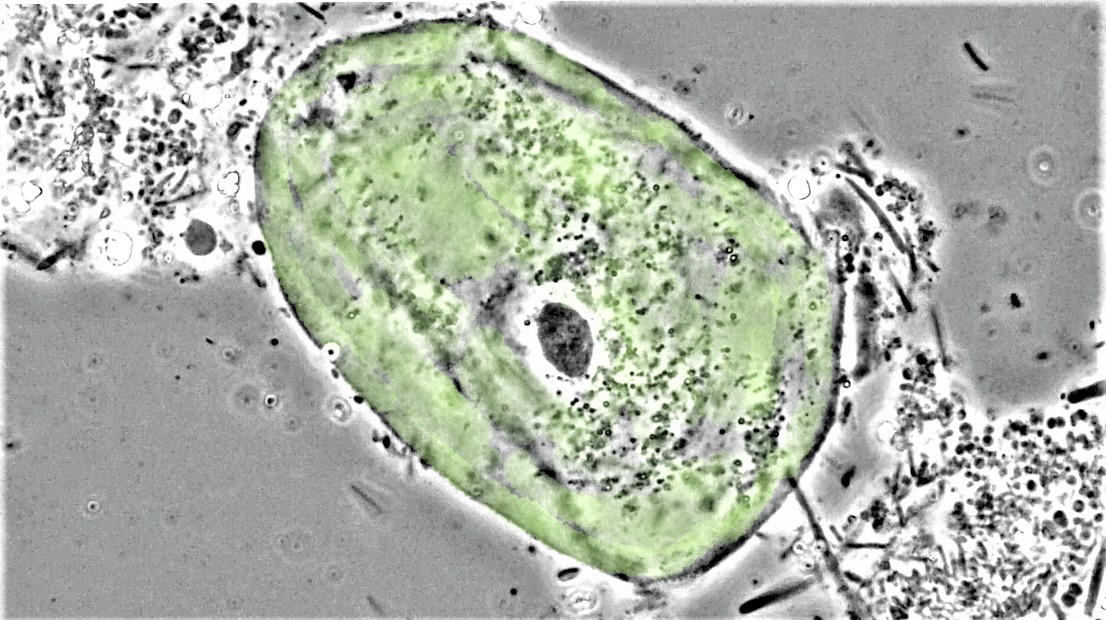
Fig.1 : biofilm tiré de la crevasse gingivale en santé parodontale contenant des bactéries de forme coccoïdes et filamenteuses généralement non motile accompagnées d’une cellule épithéliale.
(Microscopie à contraste de phase, 1000x, colorisation ajoutée de la cellule épithéliale).
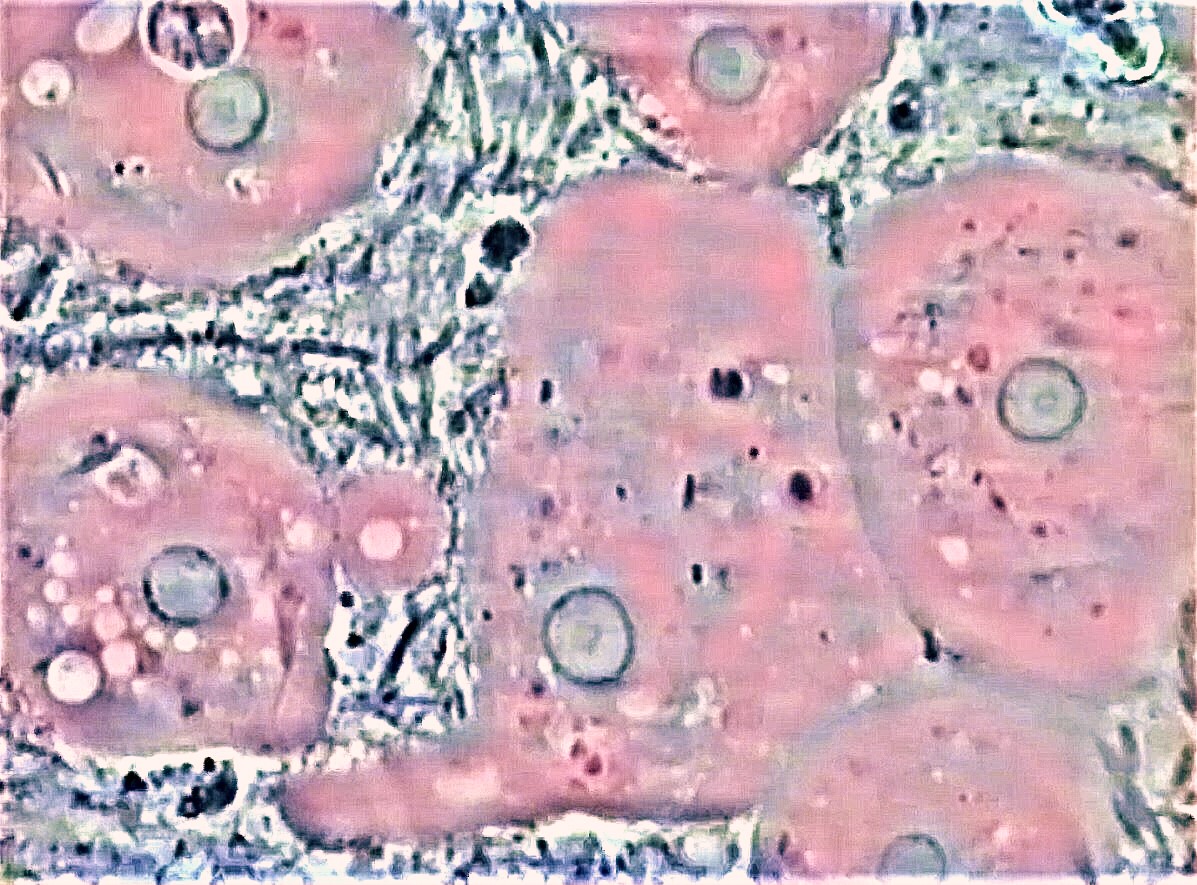
Fig.2 : biofilm d’une jeune patiente adulte affecté par une
parodontite chronique laissant apparaitre quantités du protozoaire
Entamoeba gingivalis caractérisé par des pseudopodes lisses,
quelques vacuoles digestives et leur noyaux arrondis contenant le
karyosome central. (Colorisation ajoutée des amibes).
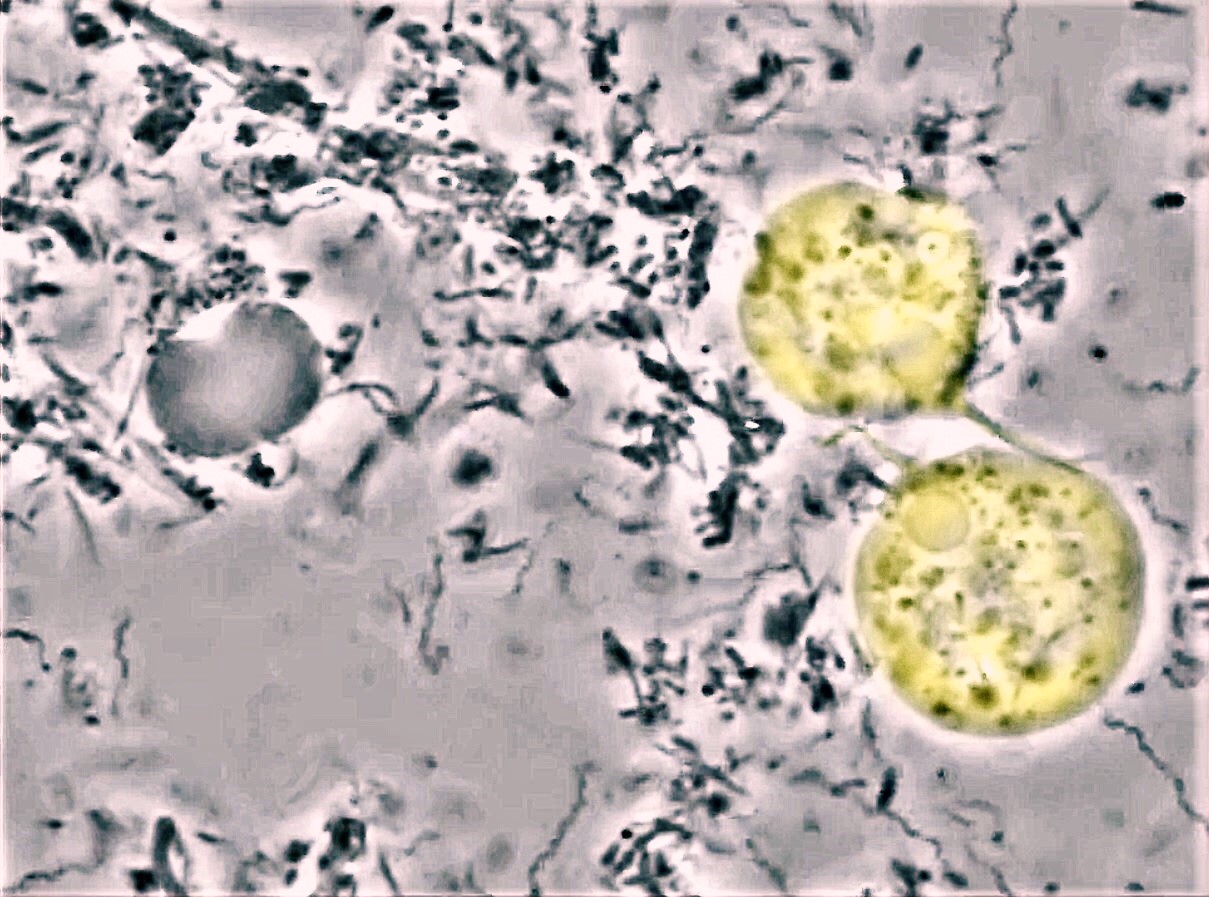
Fig.3 : trichomonas tenax (colorisés) présents dans le biofilm d’une
patiente de 50 ans affecté par une parodontite agressive. Ces
flagellés sont particulièrement actifs et laissent entrevoir quatre
flagelles agissant comme des fouets. On remarque les restes du
noyau d’un neutrophile (à gauche) et les nombreuses bactéries
motiles de type spirochètes et vibrions.
L’amibe Entamoeba gingivalis et le flagellé Trichomonas tenax dans le microbiote sous-gingival des parodontites, ainsi que leur association avec la charge bactérienne totale démontrent que les parasites sont relativement peu affectés par traitement parodontal non chirurgical (7).
L’analyse métagénomique montre une fréquence fortement accrue du protozoaire E. gingivalis dans les poches parodontales enflammées, où il a fourni le deuxième ARNr le plus abondant après l’ARNr humain (8). Cette observation et la relation biologique étroite avec Entamoeba histolytica, ont généré l’inquiétude quant à son rôle présumé dans la pathogenèse de la parodontite. En cas de rupture de la barrière épithéliale, l’amibe envahit le tissu gingival, où elle se déplace et se nourrit de cellules hôtes (Fig. 4-5).
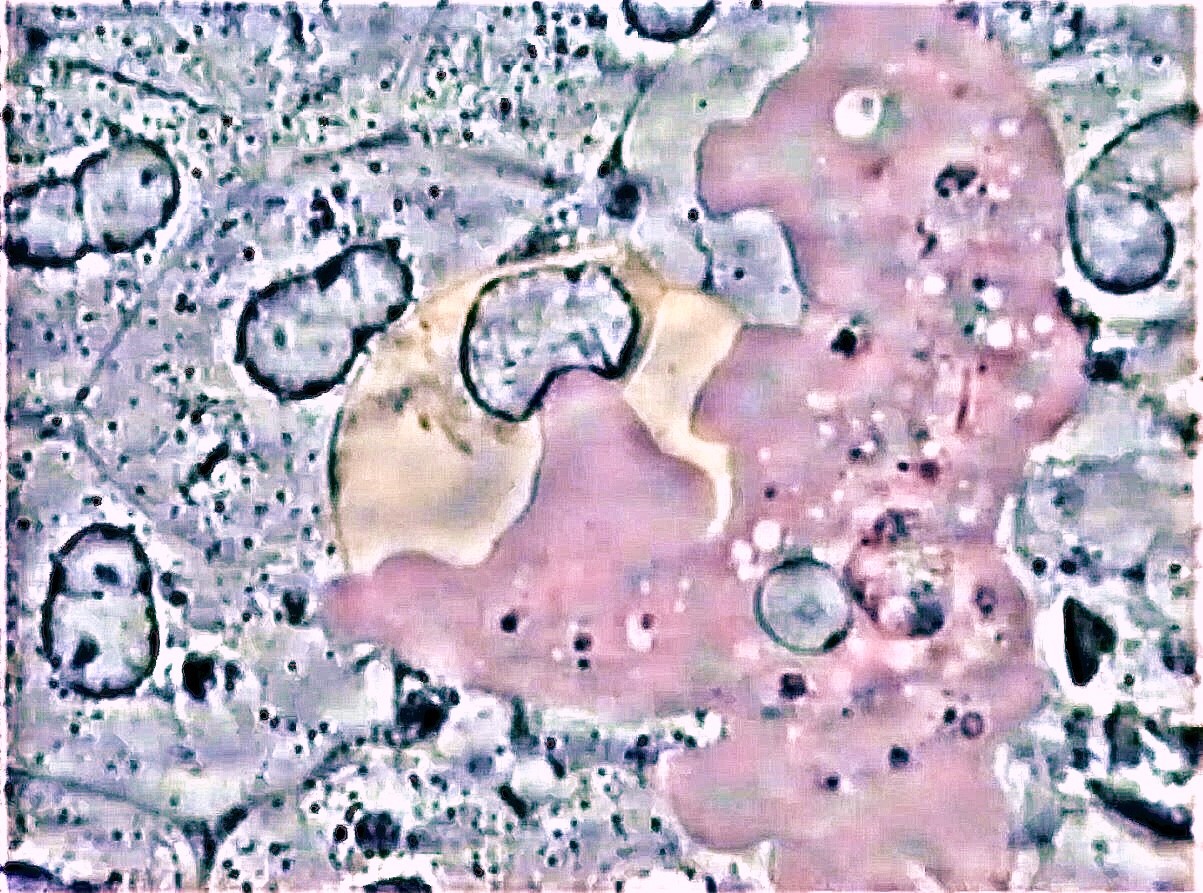
Fig.4 : durant les parodontites l’amibe Entamoeba gingivalis
adhère fortement à la cellule granulocyte (centre) et annihile
l’activité des granules azurophiles contenus dans la cellule
immunitaire, préalablement à la trogocytose du noyau. Les
granulocytes à gauche présentent encore l’activité brownienne
des granules contenus dans la cellule.
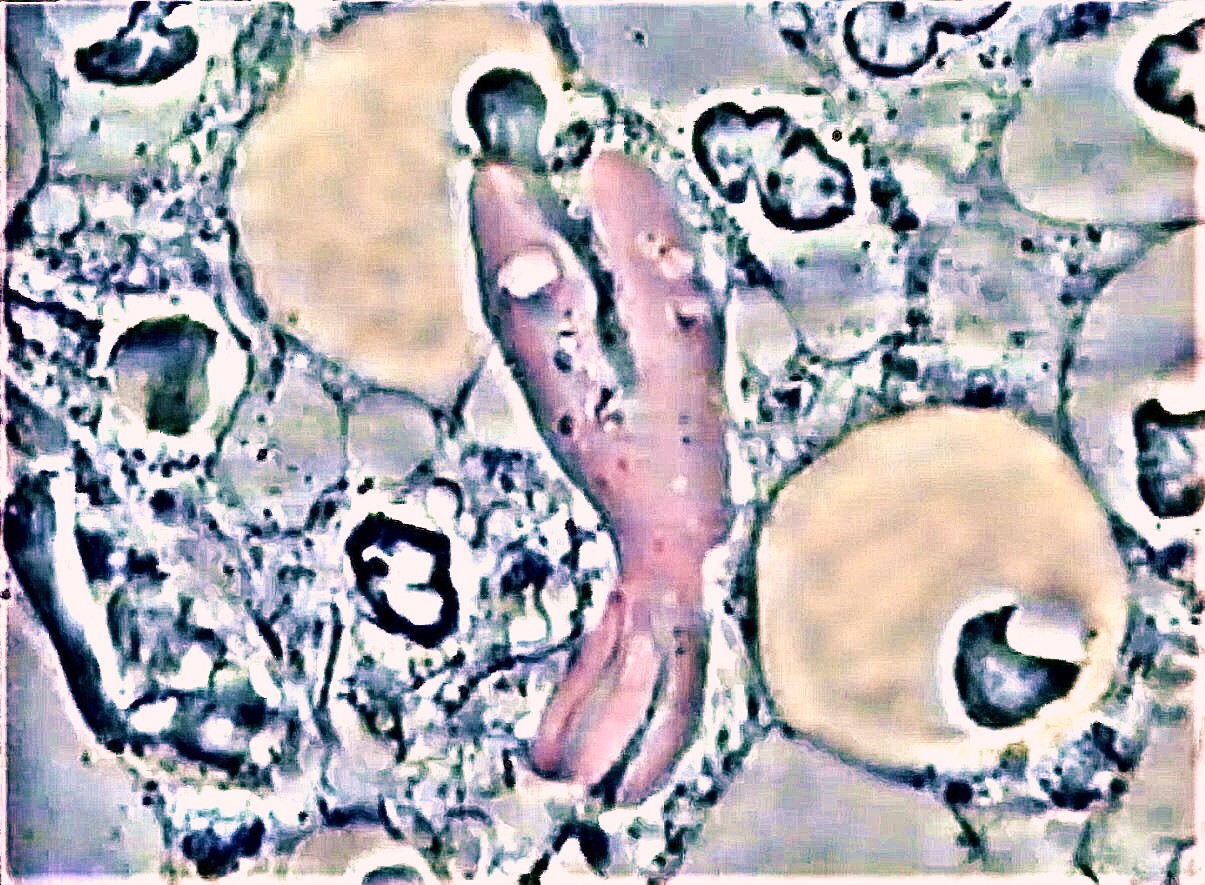
Fig.5 : l’amibe Entamoéba gingivalis ingère activement le noyau
du globule blanc grâce à son pseudopode unipolaire après
l’apparente « dégranulation » de la cellule immunitaire. Nous
appellerons ce processus fréquemment rencontré dans les
parodontites « Exonucléophagie ». Remarquez la seconde cellule
immunitaire dégranulée en bas à droite, future proie de
l’agressante.
L’infection par E. gingivalis a fortement régulé à la hausse la cytokine inflammatoire et le gène de la barrière épithéliale (9). Dans les fibroblastes gingivaux, une régulation positive de la collagénase est démontrée. Le contact direct d’E. gingivalis avec les cellules épithéliales gingivales inhibe la prolifération cellulaire. Plusieurs facteurs nous permettent de croire à la pathogénicité de ce parasite : motilité de l’animalcule, apparente adhésion aux cellules granulocytes et interaction sur le noyau du polymorphonucléaire neutrophile et de la cellule épithéliale (10).
Le déplacement du parasite en regard des cellules cibles et l’ingestion d’une portion des granulocytes durant la parodontite est facilement observable à la microscopie.
Les études récentes ont démontré qu’aucun E. gingivalis n’a été détecté dans aucun des sites sains de la gencive à partir des analyses PCR ni dans une poche saine d’un patient diagnostiqué comme ayant la maladie parodontale (11). Avec son abondance dans les sites parodontaux inflammés et dans le contexte de la résistance connue des espèces Entamoeba aux neutrophiles, aux peptides antimicrobiens et aux antibiotiques, ce colonisateur de la muqueuse buccale ne peut pas être considéré comme un micro-organisme opportuniste (12). E.gingivalis doit être perçu comme un puissant moteur microbien des formes destructrices de parodontite qui est restée, principalement non appréciée à ce jour.
T. tenax présente des similitudes morphologiques avec T. vaginalis (Fig. 6) dans les analyses d’interaction du protozoaire avec des cellules humaines en culture qui ont été examinés par microscopie électronique à balayage. T. tenax présent dans environ 30% des parodontites, et surtout plutôt agressives, produit des projections de membranes plasmatiques et des portions phagocytées des cellules mammifères. En outre, T. tenax a causé des saignements membranaires et des corps apoptotiques dans les cellules cultivées, induisant ainsi la mort cellulaire (13). En conclusion T. tenax remplit les exigences d’un parasite, causant des dommages à différentes cellules mammifères lorsqu’il est en contact avec des cellules cibles in vitro, ce qui en fait un parasite a fort potentiel pathogène dans les parodontites.
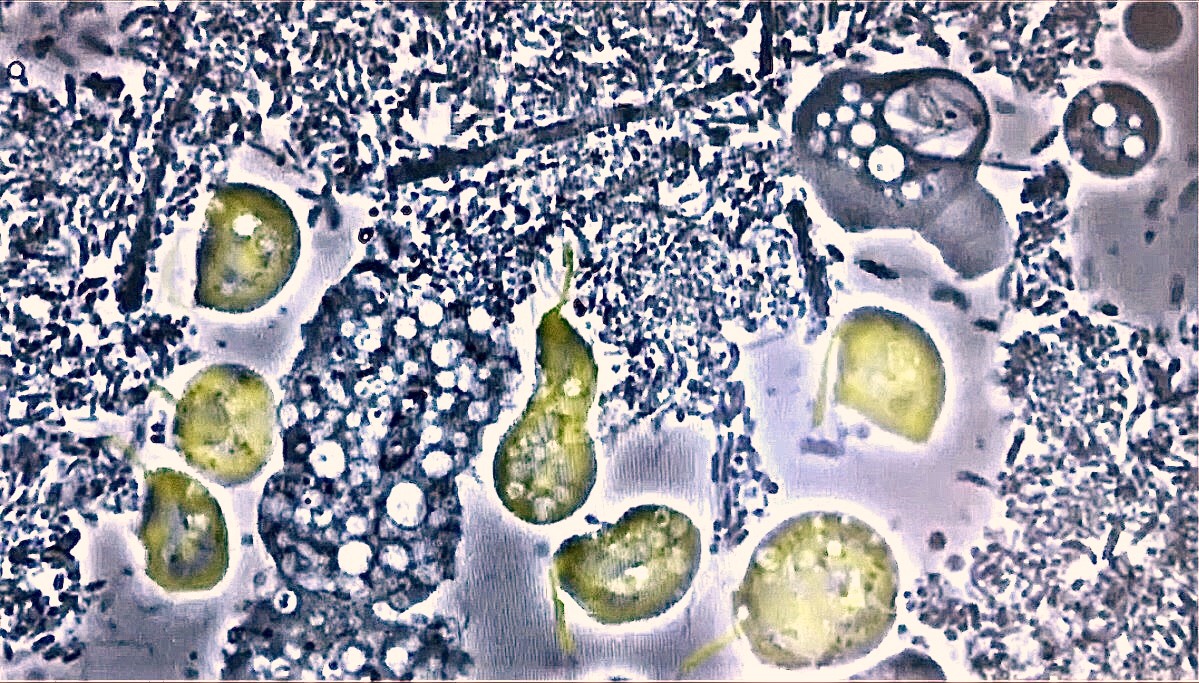
Fig.6 : présence de plusieurs flagellés Trichomonas tenax durant les parodontites de type plutôt agressives. Les animalcules virevoltent allègrement pour se rassasier grâce à leur mastigonte servant d’orifice masticatoire.
Les étude observationnelles (14) démontrent facilement le caractère pathogène de ces parasites et les résultats de traitements non chirurgicaux axés sur la disparition de la dysbiose observable au microscope semblent donner des résultats plus que prometteurs avec disparition des poches parodontales et des saignements au sondage (15).
Dr Mark Bonner déclare être président de L’Institut International de Parodontie, école privée d’enseignement.
Dr LP Gayrard déclare ne pas avoir de lien d’intérêt avec le sujet abordé.
CONCLUSION
Les parasites E. gingivalis et T. tenax semblent agir dans diverses formes de parodontites comme des pathogènes envahissants à la lueur de leur activité hématophage et de la dégradation de l’immunité cellulaire de l’hôte. Les dentistes praticiens doivent s’assurer que les poches et les tissus parodontaux enflammés sont débarrassés de ces protozoaires pathogènes.
7 points essentiels
-
Le microbiote oral se constitue au départ à partir des bactéries de la mère.
-
Les parasites présents dans les parodontites ont des similitudes avec ceux rencontrés dans l’amibiase du colon.
-
Des parasites attaquent les cellules humaines cibles dans les parodontites.
-
Entamoeba gingivalis doit être perçu comme un moteur microbien dans les parodontites actives.
-
Durant les parodontites Entamoeba gingivalis adhère aux granulocytes et réduit leur activité préalablement à la trogocytose.
-
Trichomonas tenax remplit les exigences d’un parasite causant des dommages aux cellules humaines en culture.
-
Les parasites en parodontie agissent comme des pathogènes dégradant l’immunité et les praticiens ont avantage à s’en débarrasser pour résoudre l’inflammation.
Vrai / Faux
♦ Les bactéries acquises au cours de la vie proviennent essentiellement d’un mauvais brossage. VRAI OU FAUX
♦ La microscopie a contraste de phase donne un aperçu de l’activité du biofilm parodontal. VRAI OU FAUX
♦ L’amibe Entamoeba gingivalis est une cellule contenant des vacuoles digestives et un noyau rond. VRAI OU FAUX
♦ Trichomonas tenax est un flagellé qui se nourrit principalement des spirochètes et des vibrions. VRAI OU FAUX
BIBLIOGRAPHIE
1. Micheau C., Ouhayoun J.P. Influence des parodontites sur les pathologies systémiques. J Paro Impl Orale 2001; 20(4) :293-303
2. Lif Holgerson, et al. Maturation of Oral Microbiota in Children with or without Dental Caries. PLoS One 2015; 10:e0128534.
3. Reners M, Brecx M. Stress and periodontal disease. Int J Dent Hyg. 2007 Nov;5 (4):199-204
4. J. WILLIS ET AL., Citizen science charts two major « stomatotypes » in the oral microbiome of adolescents and reveals links with habits and drinking water composition, Microbiome, vol. 6 (1), p. 218, 2018.
5. J. Espinoza et al., Supragingival plaque microbiome ecology and functional potential in the context of health and disease, mBio., vol.9 (6), 2018.
6. V MEURIC ET AL., Signature of microbial dysbiosis in periodontitis, Appl. Environ. Microbiol., vol.83 (14), 2017
7. Dubar M, Zaffino ML, Remen T, Thilly N, Cunat L, Machouart MC, Bisson C. Protozoans in subgingival biofilm: clinical and bacterial associated factors and impact of scaling and root planing treatment. J Oral Microbiol. 2019
Nov 25;12(1):1693222. doi: 10.1080/20002297.2019.1693222. PMID: 31893017; PMCID: PMC6882485.
8. Deng, ZL., Szafra ski, S.P., Jarek, M. et al. Dysbiosis in chronic periodontitis: Key microbial players and interactions with the human host. Sci Rep 7, 3703 (2017). https://doi.org/10.1038/s41598-017-03804-8
9. Bao X, Wiehe R, Dommisch H, Schaefer AS. Entamoeba gingivalis Causes Oral Inflammation and Tissue Destruction. Journal of Dental Research. 2020;99(5):561-567. doi:10.1177/0022034520901738
10. Bonner, M, Fresno, M, Girones, N, Guillen, N, Santi-Rocca, J. 2018. Reassessing the role of Entamoeba gingivalis in periodontitis. Front Cell Infect Microbiol. 8:379.
11. Trim RD, Skinner MA, Farone MB, Dubois JD, Newsome AL. Use of PCR to detect Entamoeba gingivalis in diseased gingival pockets and demonstrate its absence in healthy gingival sites. Parasitol Res. 2011 Sep;109(3):857- 64. doi: 10.1007/s00436-011-2312-9.
12. Julien Santi-Rocca, The Protozoome of the Periodontal Sulcus: From Health to Disease. Eukaryome Impact on Human Intestine Homeostasis et Mucosal Immunology, N. Guillen (éd.) Springer Nature Zwitzerland AG 2020.
13. Ribeiro LC, Santos C, Benchimol M. Is Trichomonas tenax a Parasite or a Commensal? Protist. 2015 May;166(2):196-210. doi: 10.1016/j.protis.2015.02.002. Epub 2015 Feb 20. PMID: 25835639.
14. Mark Bonner. Microscopy Analyses Reveal the Parasitism of Entamoeba gingivalis in Periodontitis: An Observational Study. J Dentistry and Oral Maxillofacial Surgery, Nov.2022, 5(3); DOI:10.31579/2643-6612/042
15. A Aalam, M Bonner, A Krivitsky, Gregori M Kurtzman, Madison K Zusman. (2022). Gingival Parasitic Infections as a Contributor to Periodontitis: Identification and Treatment. Dentistry and Oral Maxillofacial Surgery. 5(1); DOI: 10.31579/2643-6612/026