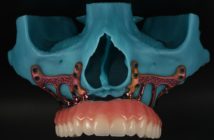
UTILISATION DE L’INGÉNIERIE TISSULAIRE ET DU BIOVERRE 45S5
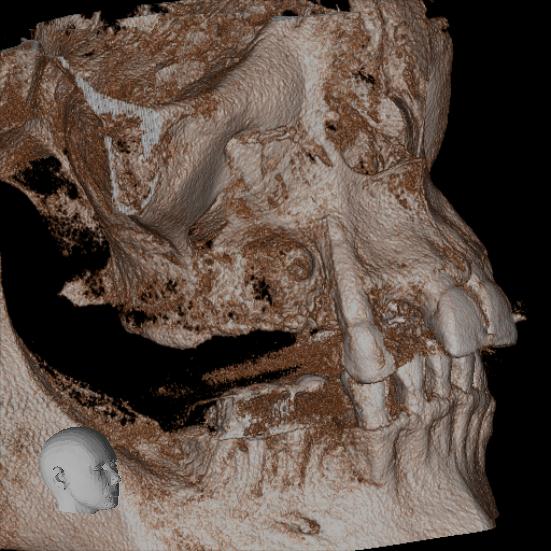
Fig 1 : reconstruction osseuse particulaire : apport du bioverre
45S5. Une alternative aux greffes autogènes.
INTRODUCTION
Nos patients sont aujourd’hui de plus en plus exigeants dans les plans de traitements de reconstruction des pertes osseuses et dentaires.
Nous sommes confrontés à de nombreux challenges en termes, de confort opératoire, de qualité des suites
opératoires et de prévisibilités de nos interventions.
Nous vivons aujourd’hui d’importantes évolutions dans nos connaissances de la biologie et du matériel opératoire.
Ainsi, nous pouvons adapter nos protocoles opératoires pour qu’ils soient à la fois moins invasifs et reproductibles, afin accéder aux défis que nous demandent nos patients.
Pour illustrer cette situation, un rapport de cas qui a maintenant 7 ans de recul, va vous être présenté dans cet article.
Il s’agit d’une reconstruction de crête pré-implantaire qui a été menée par un protocole mini-invasif pour répondre aux attentes d’une patiente qui souhaitait une réhabilitation implantaire sans greffe osseuse et sans site de prélèvement oral ou extra-oral.
Nous avons utilisé avec succès un matériau de comblement de synthèse et d’origine minérale, le bioverre 45S5 (Hench 2006)1 qui a de nombreuses applications dans le domaine médical depuis plus de 20 ans et qui mériterait d’être plus utilisé dans le domaine dentaire pour la régénération des tissus durs et des tissus mous.
ASPECTS FONDAMENTAUX DE LA MICROCHIRURGIE APPLIQUEE A LA RECONSTRUCTION OSSEUSE
Quelle que soit la procédure de régénération tissulaire, ou de greffe tissulaire, la clé du succès est la préservation, voire la stimulation de vascularisation. Pour atteindre cet objectif, le chirurgien doit suivre une stratégie mini-invasive. Son geste doit générer une plaie chirurgicale précise, saine, qui va cicatriser par première intention sans générer de phénomènes inflammatoires longs douloureux et imprévisibles. La main du chirurgien est fondamentale et ne doit pas générer de plaie traumatique (Hurzeler et ZurH 2012)2.
Les techniques de microchirurgie permettent d’opérer dans le respect de la vascularisation et de l’intégrité des tissus.
3 points fondamentaux régissent la microchirurgie :
- Préservation des structures tissulaires et vasculaires
- Suppression des tensions tissulaires
- Stabilisation du caillot sanguin et des matériaux de reconstruction tissulaire.
Ces points cruciaux permettent d’initier un processus de cicatrisation de qualité qui va être déterminant
pour la régénération et la maturation tissulaire.
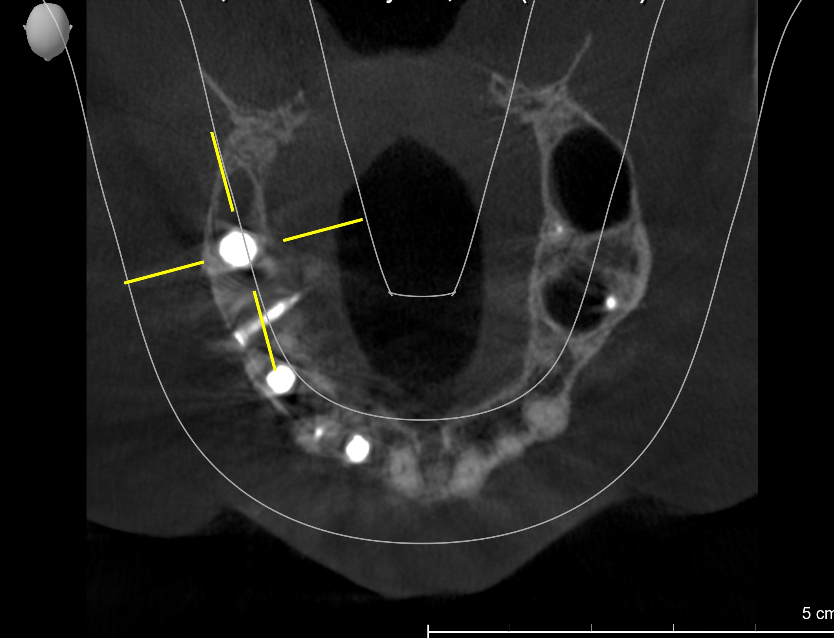
Fig. 2 et 3 : augmentation horizontale pré-implantaire d’une crête
osseuse extrêmement résorbée avec 7 ans de recul par greffe mixte
particulaire : bioverre 45S5 + allogreffe.
DESCRIPTION DU CAS CLINIQUE
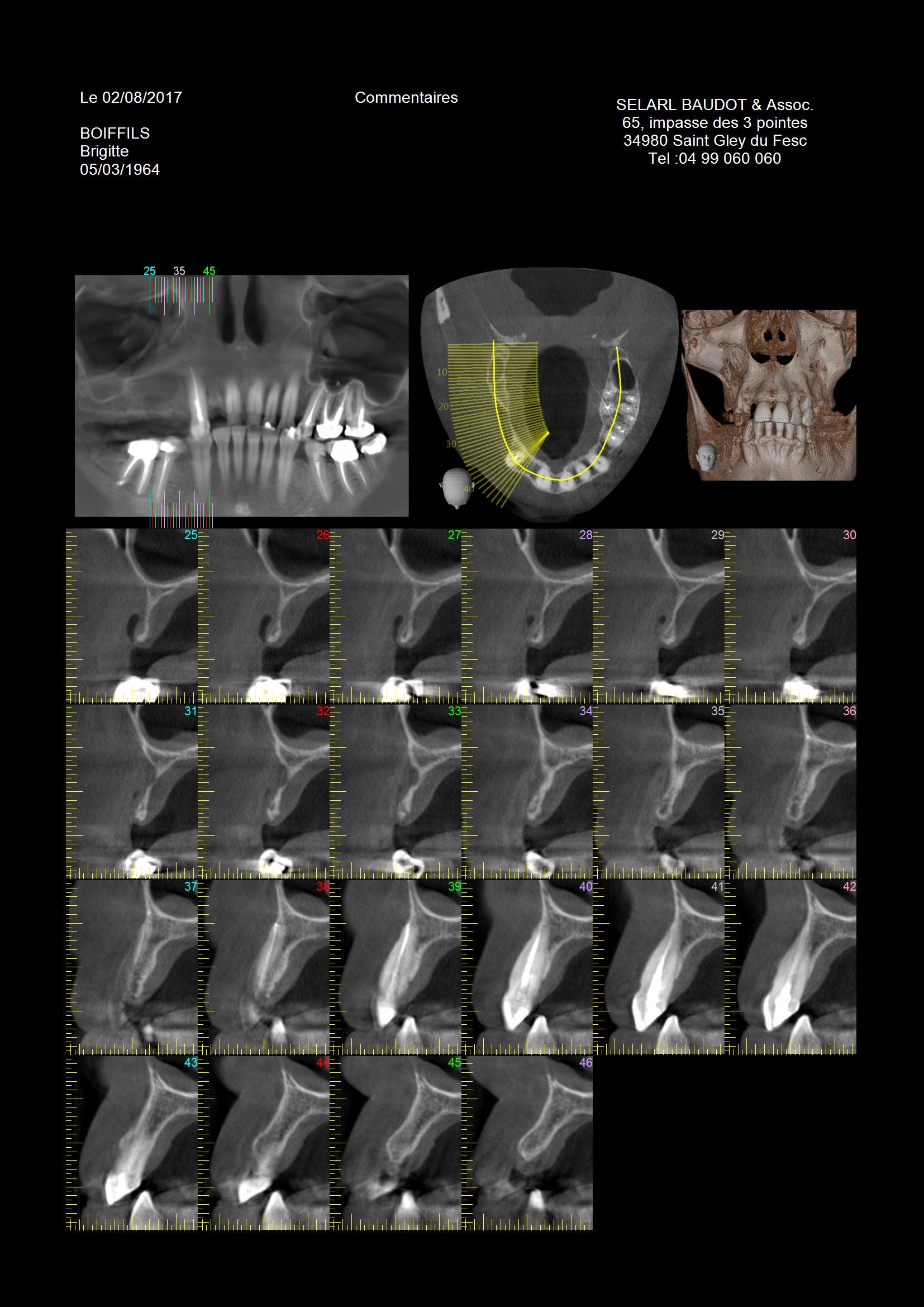
La patiente est âgée de 53 ans opérée le 2/08/2017 présente une extrême perte osseuse horizontale de la crête osseuse maxillaire dans le secteur 1. La hauteur de crête dans ce cas est disponible pour supporter un comblement particulaire et fournir un apport vasculaire fondamental au succès de la reconstruction.
Le plan de traitement consiste à réaliser une augmentation horizontale pour obtenir un volume osseux total de 8 mm (os natif + reconstruction) afin placer des implants TBR Z1 connect de 3,5 en position de 14 et de 5 mm en position de 16 pour un bridge 3 éléments.
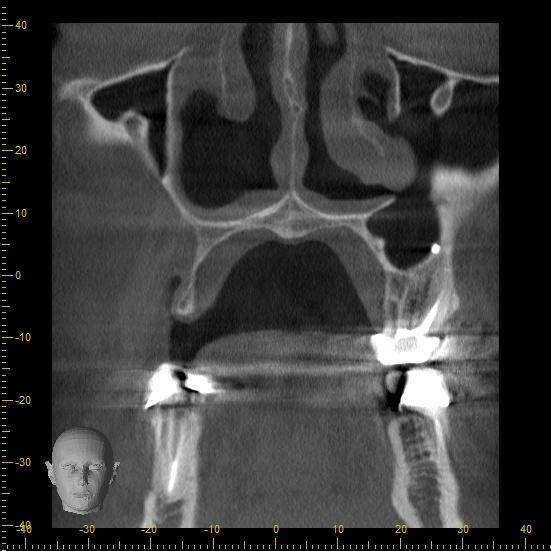
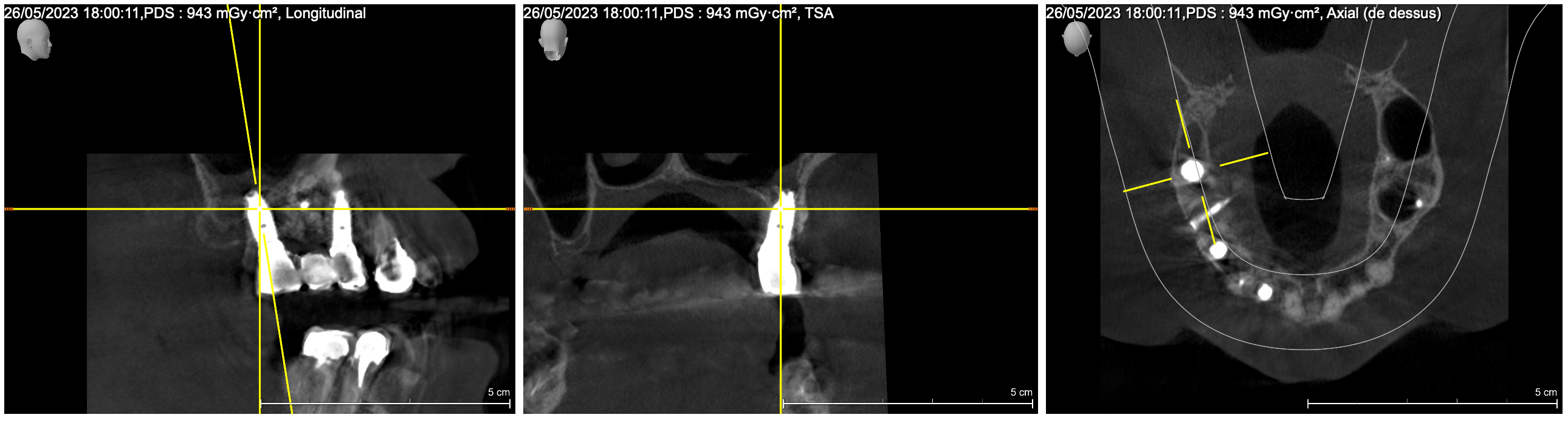
Une analyse 3D par CBCT a été réalisée et a permis de mettre en évidence l’anatomie du site à opérer :
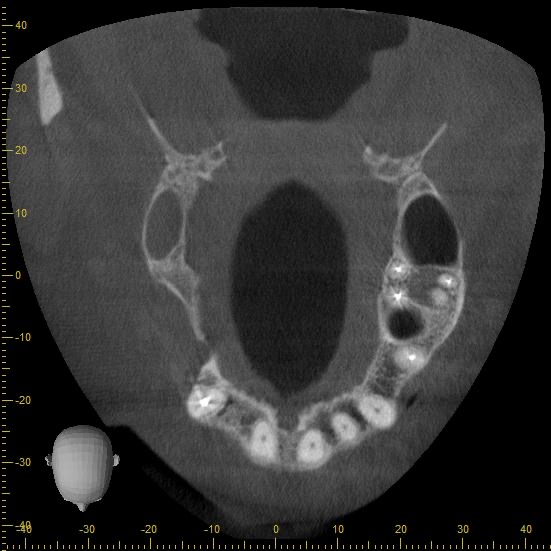
Fig. 4 et 5 : anatomie du défaut à reconstruire. Il manque au moins 7 mm pour mettre un implant de 5 mm en position de 16 et un implant de 3,5 en position de 14. La hauteur d’os est bonne ce qui est favorable pour soutenir une greffe particulaire. L’apport vasculaire est également préservé.
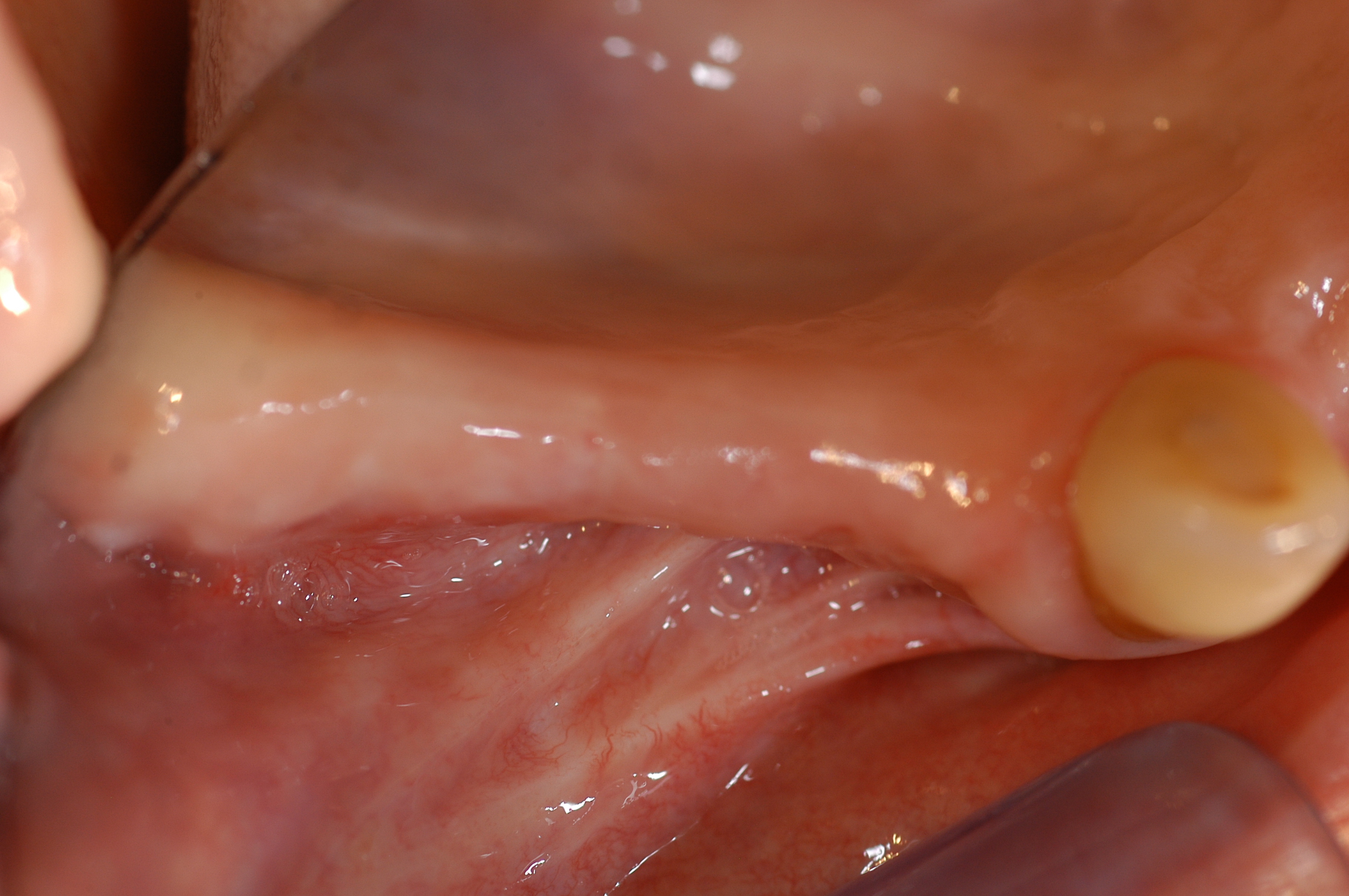
Fig. 6 : environnement muqueux du défaut à reconstruire. Les brides
et tensions tissulaires devront être gérées dans la manipulation
chirurgicale des tissus mous.
L’environnement ostéo-muqueux du secteur 1 est incompatible avec le projet de reconstruction et nécessite une préparation préalable à l’implantation.
L’intervention va consister en une augmentation du volume osseux par de substituts osseux particulaires
intégrant une procédure d’ingénierie tissulaire :
- bioverre
- os allogénique
- PRF
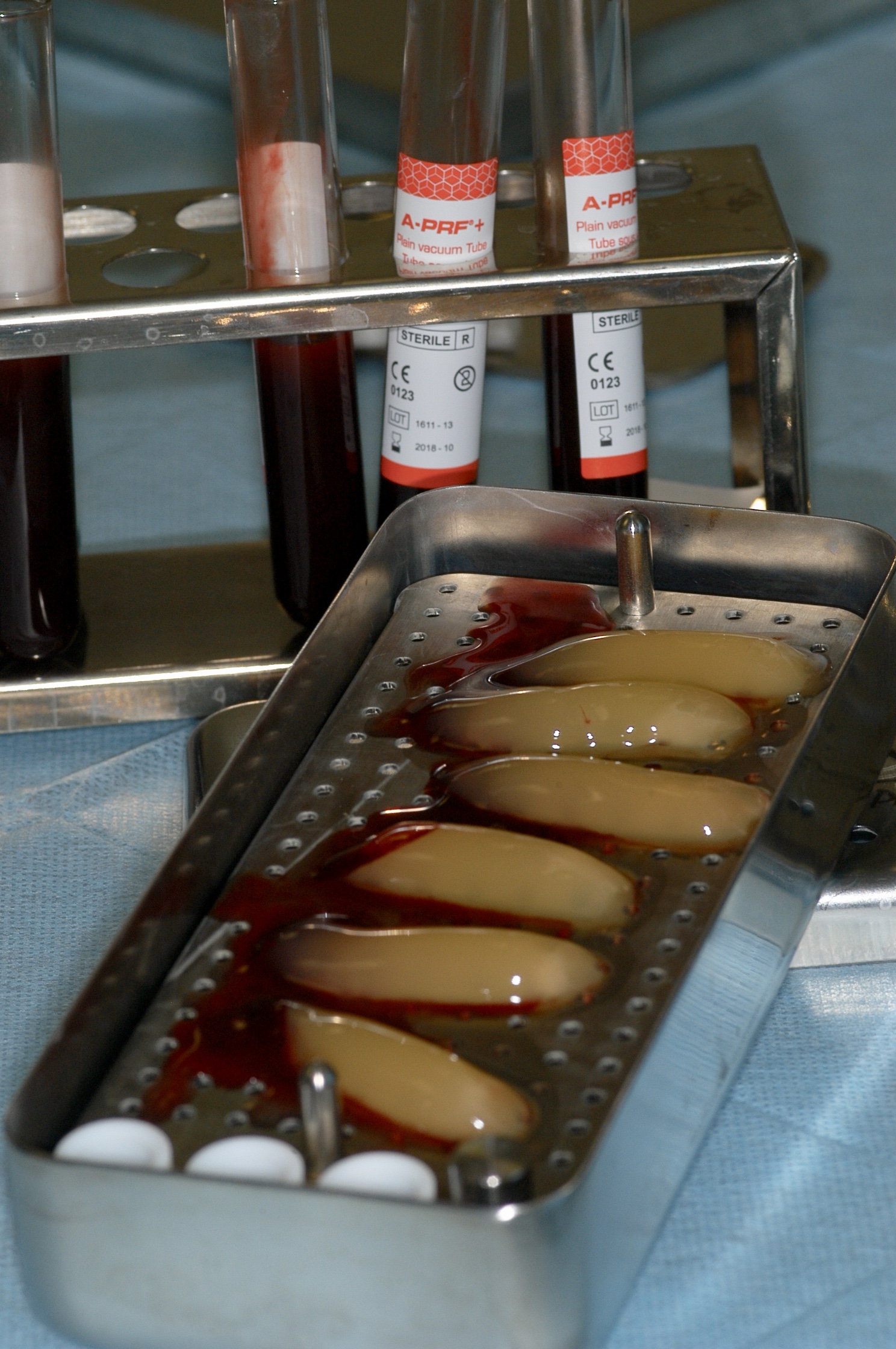
Fig. 7 : le PRF est l’apport autogène indispensable aux greffes particulaires non autogènes. Il permet de stimuler la vascularisation
et par voie de conséquence la cicatrisation.
Un lambeau d’épaisseur totale est récliné à l’aide de 3 incisions :
- 2 incisions de décharge en « Z » permettant de respecter l’intégrité de apports vasculaires du lambeau : l’incision est pratiquée sous microscope opératoire et couche par couche en évitant de couper « les gros vaisseaux » et en progressant jusqu’au périoste.
- 1 incision crestale légèrement décalée en palatin dans ce cas où l’on ne cherche pas d’augmentation verticale mais une augmentation horizontale afin d’aménager un environnement muqueux kératinisé de bonne quantité en vestibulaire pour les futurs implants.
- Le lambeau mucco-périosté est délicatement récliné afin de respecter l’intégrité de l’apport vasculaire déterminant du périoste.
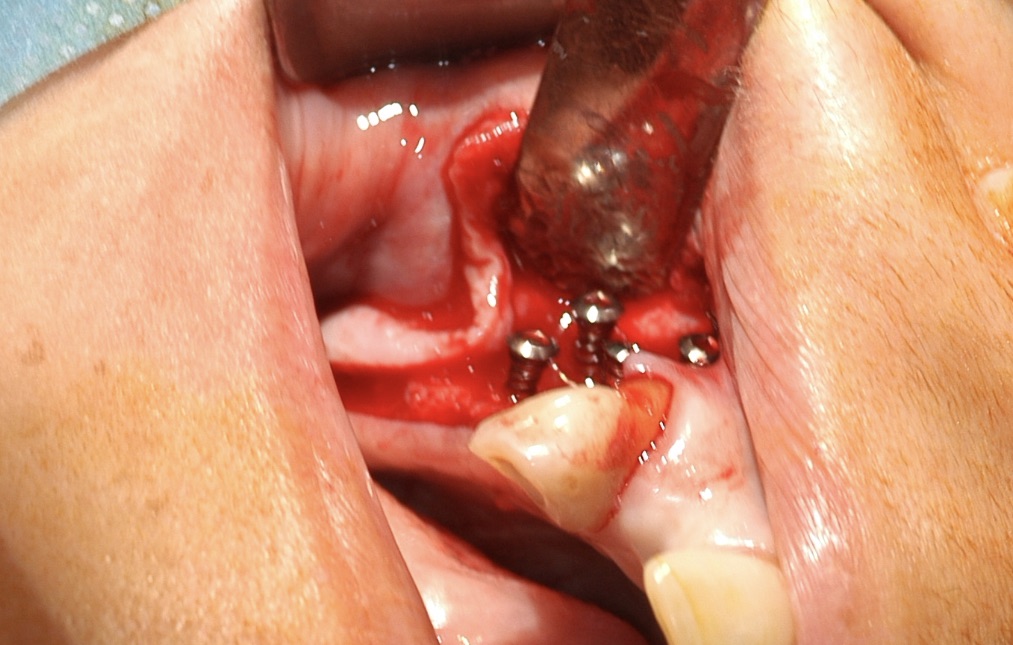
- Mise en place de vis d’espacement ostéo-ancrées sur la corticale. Ces vis sont sélectionnées en planification et calibrées pour avoir un ancrage de 3 mm et maintenir un espace à aménager de 6 mm : nous sélectionnons donc 4 vis de 9 mm pour une augmentation de 6 mm. Ce qui fait au total 8 mm d’épaisseur osseuse disponible après augmentation : 6 mm de reconstruction + 2 mm de corticale native.
- Le site osseux receveur est ensuite méticuleusement nettoyé à l’aide du LASER Er-Yag qui a une trophicité particulière afin d’éliminer les débris de fraisage générés lors la mise en place des vis (Aoki el al. 2015)3. L’os parfaitement propre cicatrise rapidement et sans réaction inflammatoire chronique pouvant compromettre le résultat de l’intervention.
- Nous procédons ensuite à la mise en place du matériau de comblement. Il s’agit d’un mélange 50/50 d’os allogénique (Biobank) + Bioverre 45S5 (Noraker). Ce mélange est préparé en « sticky bone » avec un mélange de plasma autogène S-PRF et APRF.
La préparation obtenue ostéo-conductrice et ostéo-inductrice présente une ergonomie opératoire très appréciable dans ce genre d’intervention, car elle est collante et les particules du comblement restent bien en place. Le comblement est placé sur le site receveur et aggloméré autour des vis d’espacement. La dimension du comblement est calibrée par les vis qui stabilisent l’ensemble : un véritable modelage du site est réalisé. - L’ensemble est protégé par des membranes de PRF qui assurent une protection mécanique et favorisent l’angiogenèse et l’apport vasculaire.
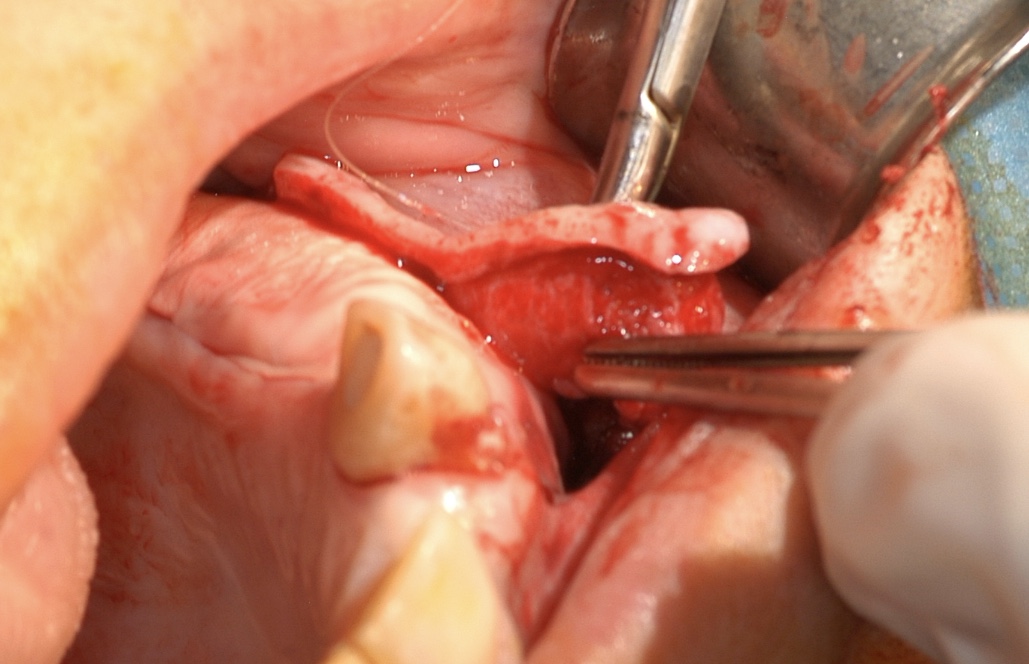
- Par-dessus ce comblement, une membrane collagène (Evolution OSTEOBIOL) est appliquée et fermement stabilisée au périoste et au lambeau palatin sous lequel elle est glissée est fixée par des points résorbables de matelassiers horizontaux. Côté vestibulaire, la membrane est fixée également par des points de matelassier horizontaux sur la portion fixe apicale du périoste qui ne sera pas relaxé.
- Relaxation du lambeau vestibulaire : une incision horizontale très fine du périoste est opérée coronairement aux points de fixation de la membrane et une dissection des plans muqueux et musculaires est réalisée aux ciseaux de Metzembaum pour relâcher les tensions tissulaires et obtenir un positionnement parfait du lambeau vestibulaire, sur les berges du lambeau palatin.
- Fermeture du site :
– Fermeture des plan profonds : fixation de la nouvelle ligne mucco-gingivale par des points (5/0 résorbables) de matelassiers horizontaux juste sous la gencive kératinisée vestibulaire et ancrés sur le lambeau palatin. Ces premiers points sont déterminants car ils stabilisent les différents plans et protègent les berges de la plaie chirurgicale des tensions et des mobilités tissulaires. Ils définissent la position de la nouvelle ligne muco-gingivale.
– Fermeture des plans superficiels à l’aide de points simples réalisés sans aucune tension avec des fils de 6/0 résorbables.

Fig. 8 : aspect du comblement en « sticky bone » du mélange
bioverre + allogreffe. L’ensemble cristallise au contact des fluides
biologiques ce qui améliore l’ergonomie opératoire.
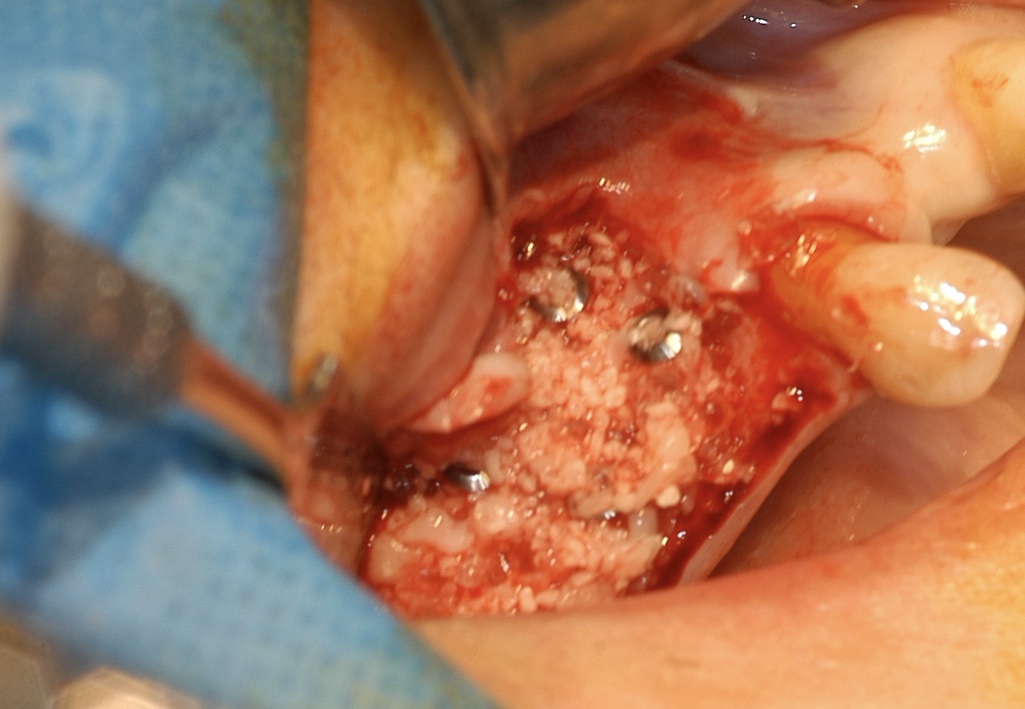
Fig. 9-9 bis : mise en place des vis de calibrage tuteurs d’épaisseur
de la greffe particulaire. Et modelage de la reconstruction par
apport du comblement stabilisé autour des vis.
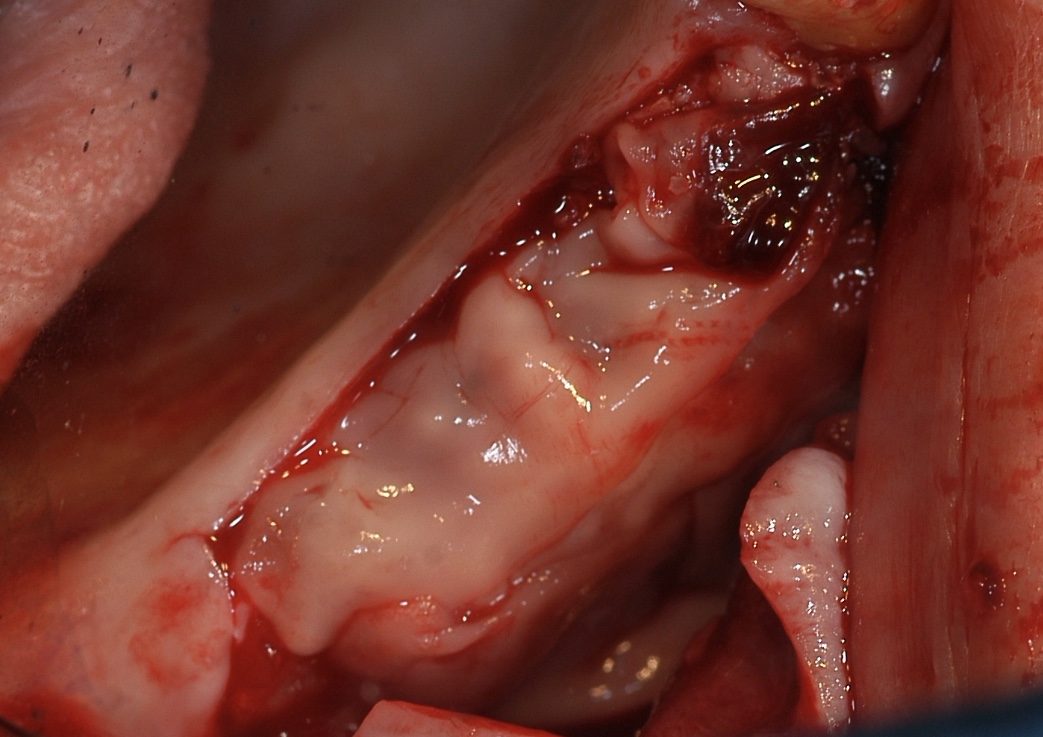
Fig. 10 : protection de la zone comblée avec des membranes de
PRF pour stabiliser les particules et stimuler la cicatrisation.
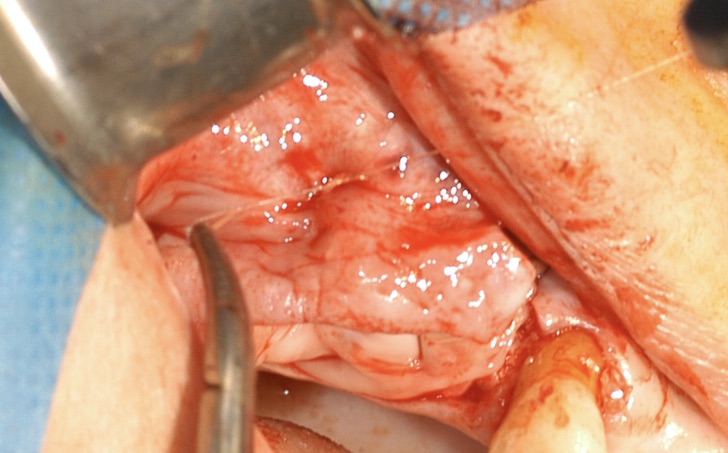
Fig. 11 et 12 : mise en place d’une membrane de collagène qui
est fixée du côté vestibulaire au périoste du lambeau d’épaisseur
totale dans sa portion la plus apicale et au lambeau palatin par
des points de matelassiers horizontaux.
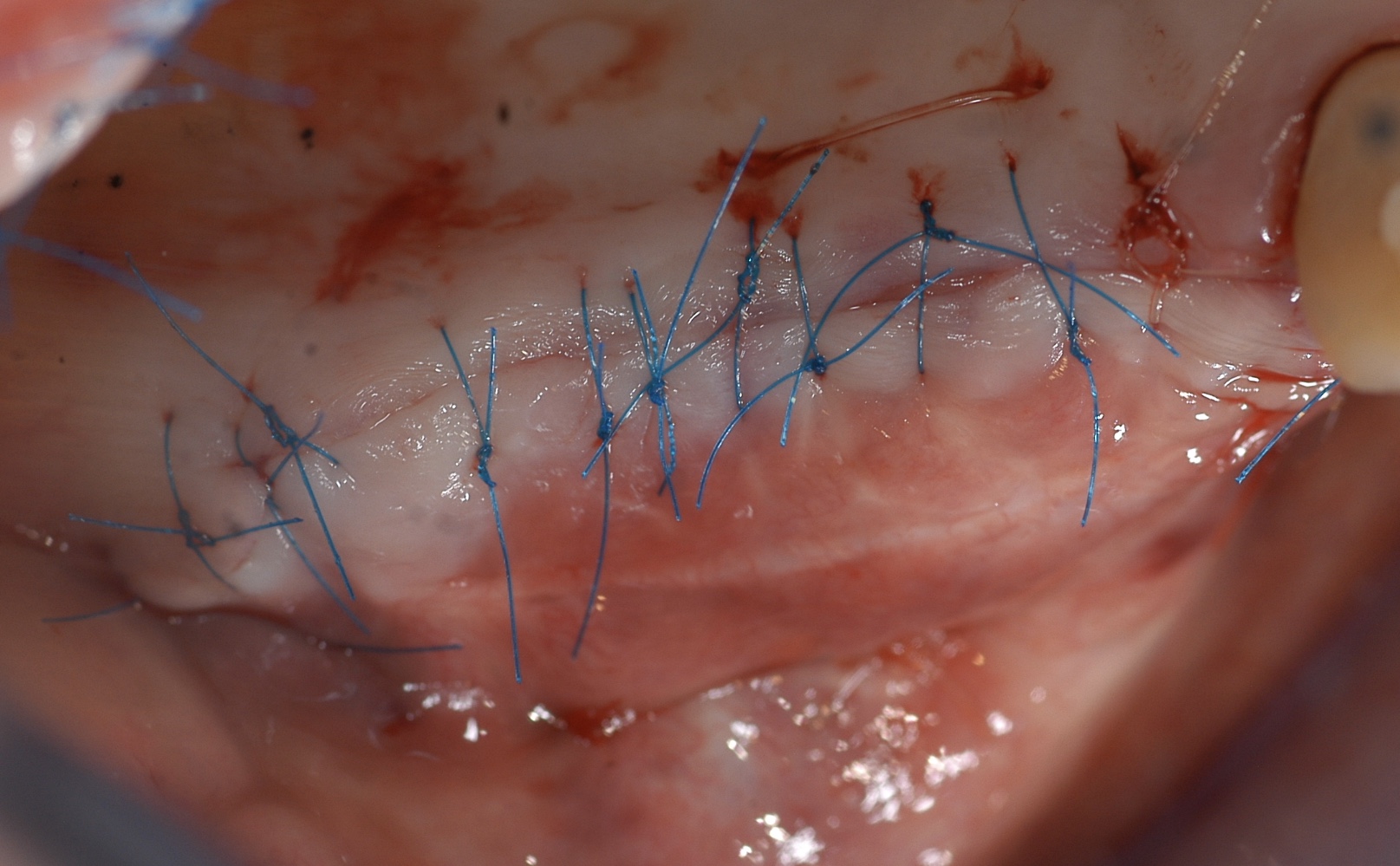
Fig. 13 : fermeture « hermétique » du site reconstruit après
relaxation du lambeau vestibulaire pour réduire les tensions.
La ligne mucco-gingivale est fixée par des points de matelassiers
horizontaux. Les plans superficiels sont suturés sans tension
avec un fil 6/0.
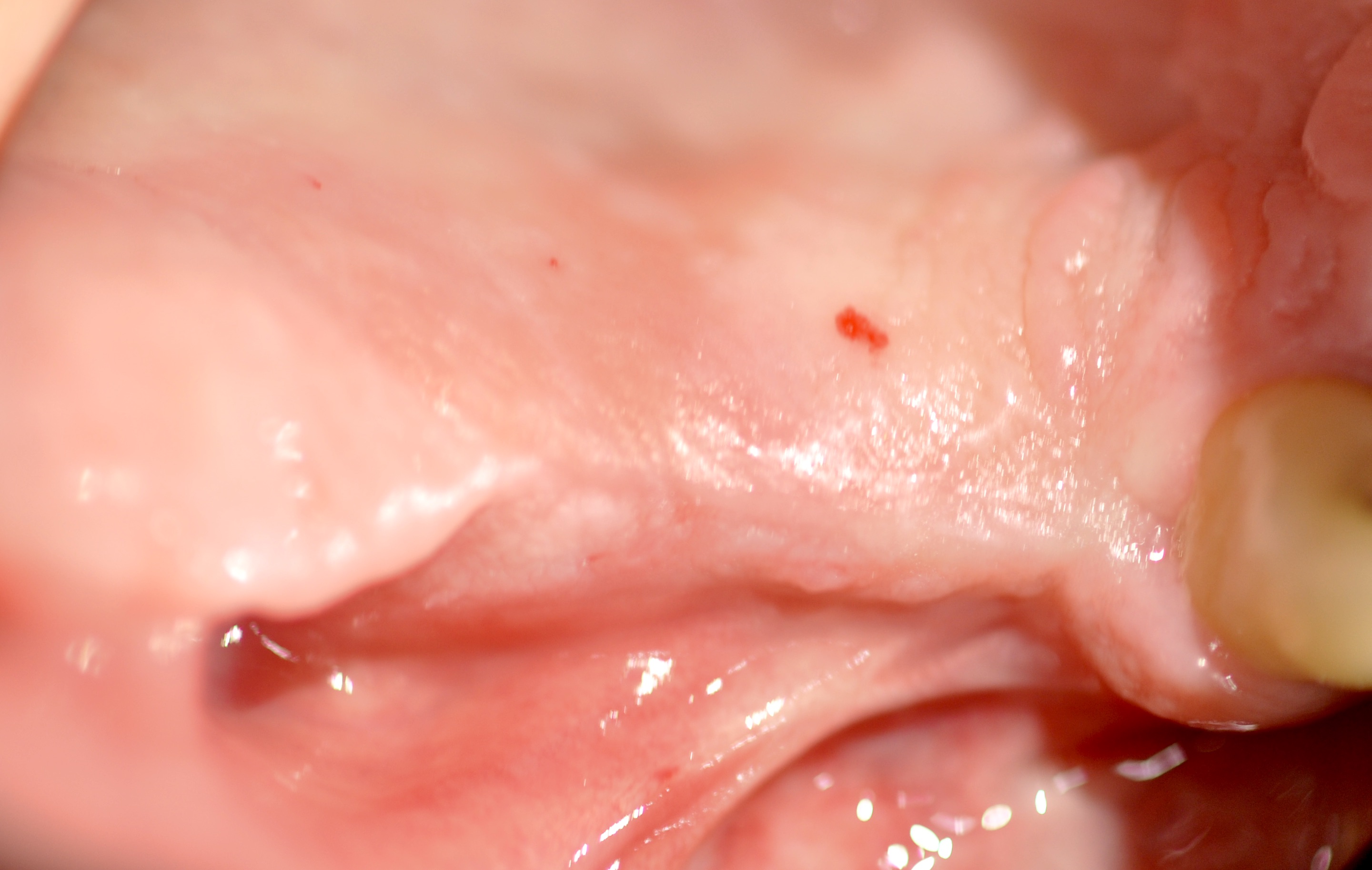
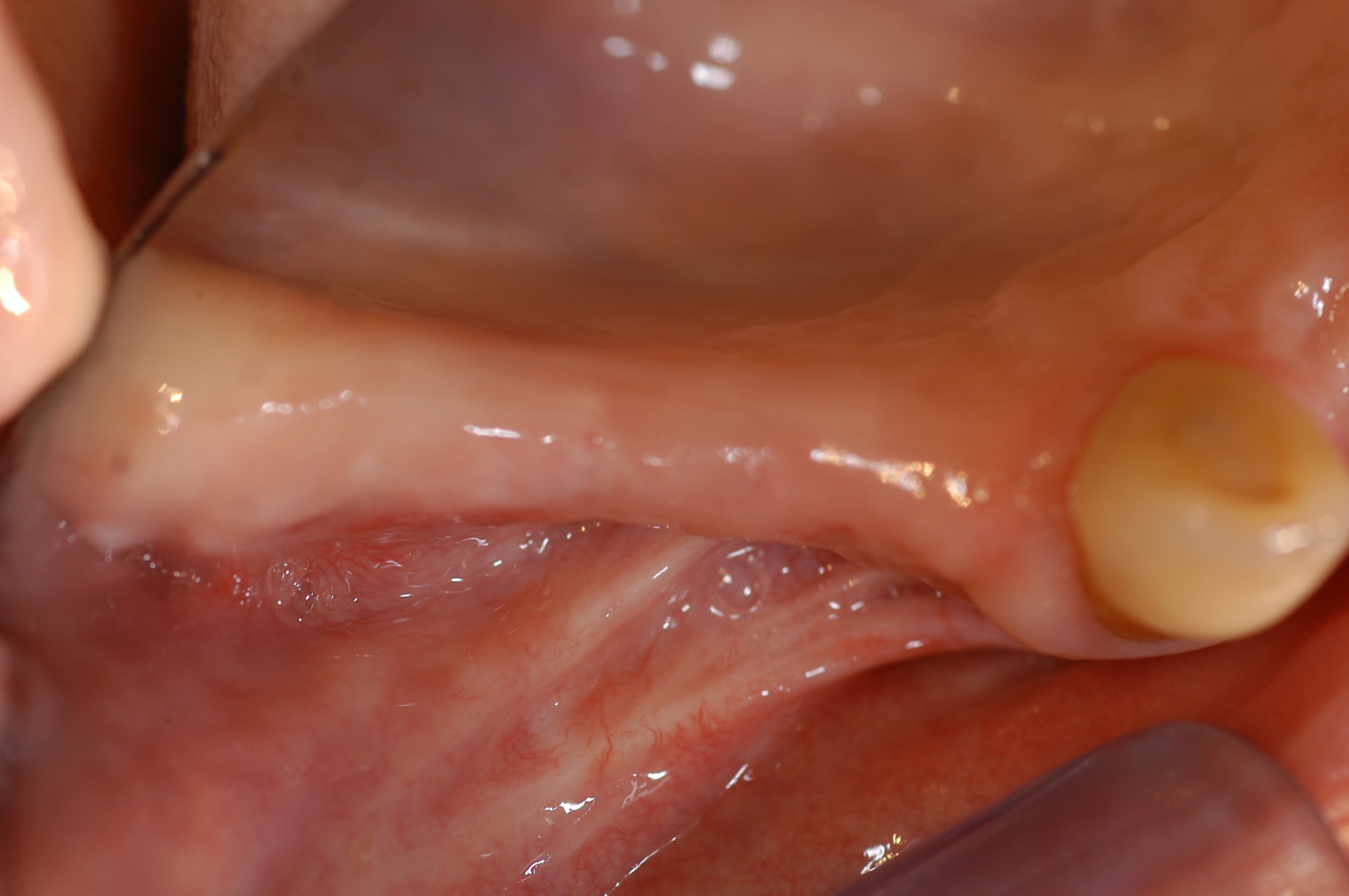
Fig. 14 et 15 : environnement ostéo-muqueux reconstruit à 6 mois
post-opératoire juste avant la mise en place des implants.
Après ce type d’intervention, il est demandé à la patiente de rester allongée pendant au moins 30 min avec une compression froide pour stabiliser le caillot sanguin et initier les premières phases de la cicatrisation dans de bonnes conditions.
Un repos d’au moins 48H est recommandé pour limiter l’oedème post-opératoire.
Ces recommandations sont simples mais déterminantes pour la suite du processus de cicatrisation qui est une succession d’événements en cascade dépendant les uns des autres. Les premiers stades, dès les premières minutes sont les plus importants. Car si un oedème ou un hématome s’installe, la cohésion des différents plans tissulaires va être altérée, et l’apport vasculaire indispensable pour la qualité de la cicatrisation, ne sera pas bon.
Une inflammation chronique et des retards de cicatrisation apparaîtront (Hannu Larjava 2012)4.
INTERET DE LA COMBINAISON PRF/BIOVERRE
Le succès de ce type de reconstruction, comme d’ailleurs toutes les reconstructions tissulaires, est conditionné par notre capacité à stabiliser les tissus et à respecter l’apport vasculaire. L’utilisation de PRF est biostimulant et ostéo-inducteur dans ce contexte de reconstruction non autogène. Il permet en outre de stimuler l’angiogenèse qui assure la nutrition intime de matériel greffé (Blatt S 2021)4bis.
L’os allogénique amène une structure du comblement comparable à l’os naturel. Il est dense en collagène et représente un excellent support ostéo-conducteur.
L’originalité du ce type d’intervention résidé dans l’utilisation du bioverre 45S5 qui renforce la structure du comblement, il est très dense et maintient un volume stable. Au-delà ses propriétés ostéo-conductrices, il a également des propriétés antiseptiques générées par sa dissolution ionique.
C’est un substitut osseux d’origine minérale à base de silicium, calcium, sodium et phosphate. Il a des capacités ostéo-conductrices mais également ostéoinductrices (Westhauser 2024)5. Il est utilisé en chirurgie orale depuis les années 1990 (Hench)1.
Au contact des fluides biologiques, ce bioverre cristallise, ce qui permet d’obtenir un matériau de comblement collant très ergonomique pour sa manipulation chirurgicale.
A l’intérieur des tissus, le 45S5 subit une dissolution et une transformation graduelle in situ en apathite biologique équivalente en composition et en structure au minéral osseux qui est ensuite colonisé et métabolisé pour produire une néoformation osseuse.
L’apathite biologique, en se formant incorpore des fibres de collagènes et constitue une interface naturelle qui lui permet de se lier avec les tissus environnants en quelques jours (6-12 jours). Ces événements associés à la présence de PRF contribuent à stabiliser intimement le volume comblé et sécurisent la greffe, lui procurant ainsi des conditions favorables à la régénération osseuse.
Simultanément à ce processus d’intégration, des échanges ioniques (Hope 2011)6 entre le verre bioactif et les fluides biologiques provoquent une augmentation locale du pH et de la pression osmotique, ce qui limite la prolifération bactérienne.
De plus, cette dissolution ionique du 45S5 stimule l’angiogénèse (Haraud Durand 2015)7.
Le 45S5 permet de réduire la réaction inflammatoire en réduisant la production de neutrophile et en stimulant la production du phénotype M2 macrophagique. Cette modulation de la réaction inflammatoire par la dissolution ionique du 45S5 contribue à améliorer le processus de cicatrisation en particulier dans ces phases initiales (Dong 2017)8.
Des études in vitro ont également prouvé que les ions de verre bio-actif sont capables de stimuler des marqueurs liés à l’angiogenèse (Day 20059, Chen 2020)10 et la production de médiateurs antiinflammatoires et curatifs (Li 2022)11.
D’autres études in vitro prometteuses démontrent que la dissolution ionique du 45S5 stimule la différenciation des cellules ostéo-génétrices (Varanasi 201612,Qazi 2018)13.
Ce matériau de comblement qui a fait ses preuves dans de nombreuses applications médicales, a des vertus prometteuses qui méritent un intérêt particulier en chirurgie orale. Il constitue un excellent complément aux matériaux de comblement classiquement utilisés.
Il peut, comme nous le voyons dans ce cas avantageusement être une alternative aux comblements autogènes.
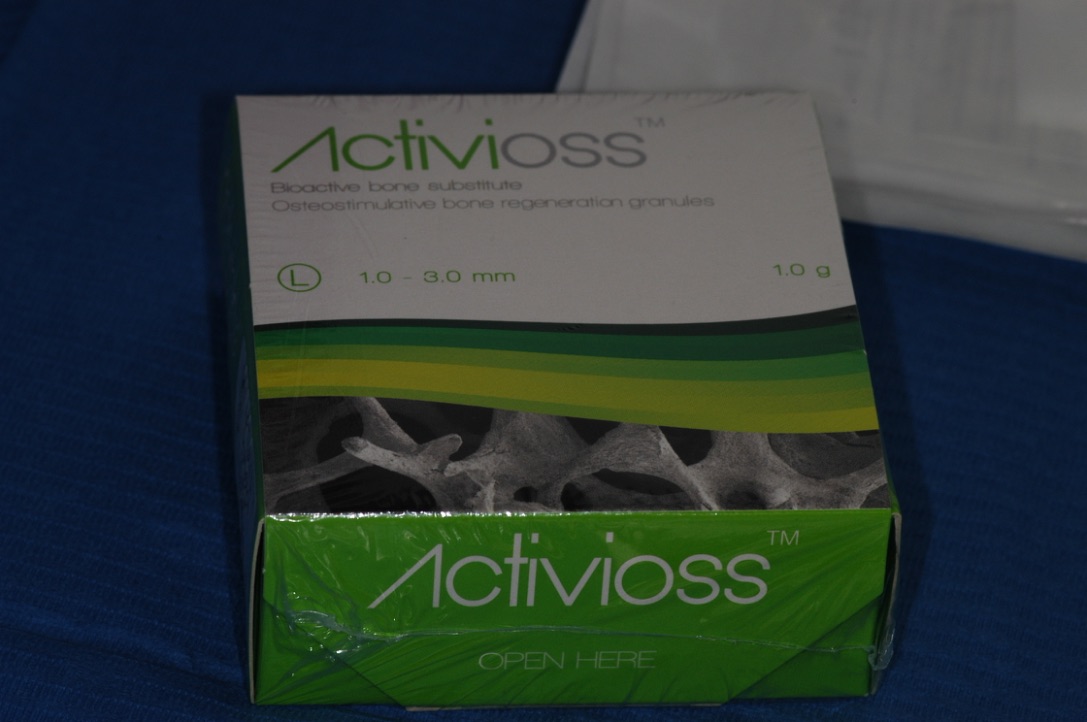
Fig. 16 et 17 : le bioverre 45S5 commercialisé sous le nom d’Activioss en France est un matériau très intéressant à utiliser seul ou en association dans les greffes osseuses particulaires. Ses propriétés biologiques apportent de nouvelles perspectives d’ingénierie tissulaire aux procédures de reconstructions osseuses.
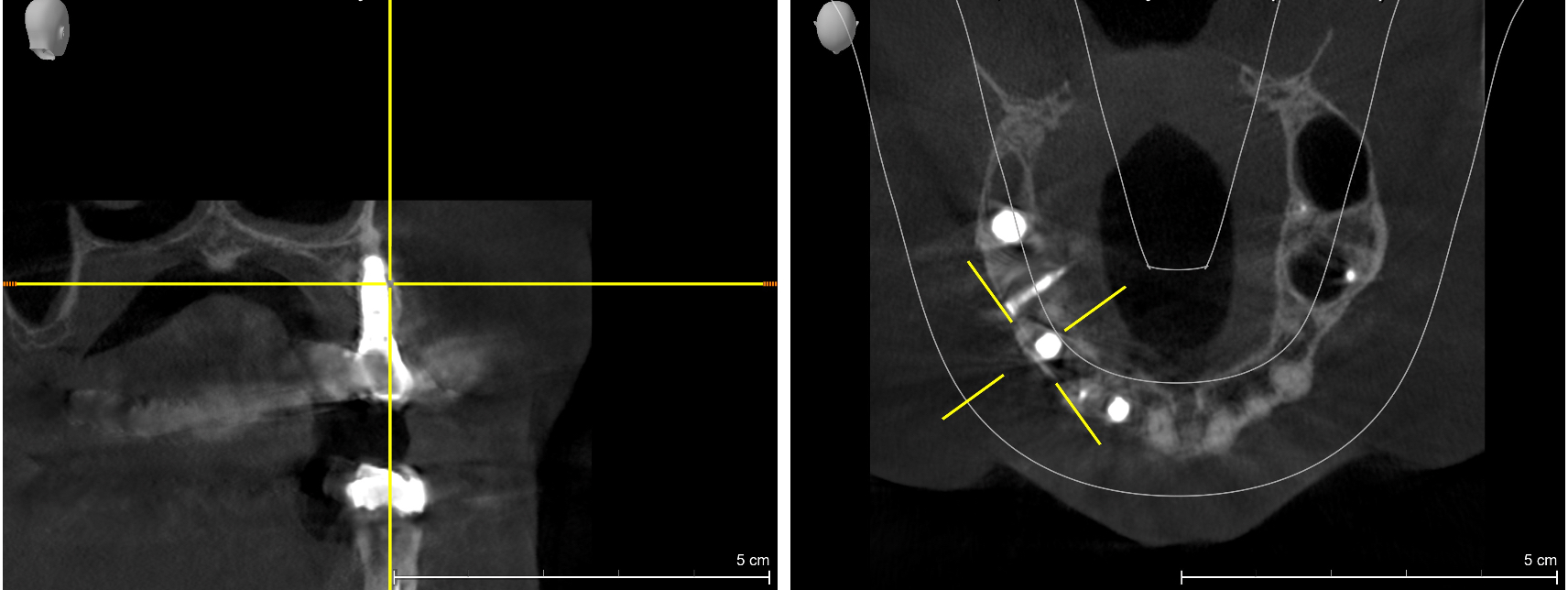
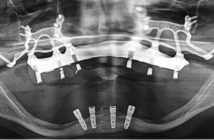
Fig. 18 et 19 : reconstruction du volume osseux par une technique de greffe particulaire intégrant l’ingénierie tissulaire. Mise en place d’implants TBR à col zircone en position de 14 et 16 pour supporter un bridge de 3 éléments : résultats à 7 ans post-opératoire
CONCLUSION
Les outils et les protocoles de microchirurgie des tissus durs et des tissus mous, nous permettent aujourd’hui de proposer des reconstructions fiables et moins invasives dans les traitements avancés pré-implantaires des défauts osseux.
Nous disposons aujourd’hui, avec l’avènement de l’ingénierie tissulaire étayée par une littérature de qualité, d’une alternative valable aux greffes autogènes.
Nous voyons dans ce rapport de cas l’intérêt de la dualité microchirurgie et ingénierie tissulaire pour traiter une situation complexe et répondre aux attentes miniinvasives que nos patients formulent aujourd’hui.
L’ergonomie opératoire et les propriétés chimiques et biologiques et en particulier l’aspect biostimulant de l’angiogenèse du bioverre 45S5 apportent de nouvelles perspectives dans le domaine des reconstructions tissulaires (Gorustovich AA 201014, Westhauser F)5.
BIBLIOGRAPHIE
1. Hench LL. The story of Bioglass. J Mater Sci Mater Med. 2006 Nov;17(11):967-78. doi: 10.1007/s10856-006-0432-z. Epub 2006 Nov 22. PMID: 17122907.
2. Zuhr O, Hurzeler M. Plastic esthetic periodontal and implant surgery: a microsurgical approach. Quintessence Publishing 2012.ISBN 978-1-85097-226-6.
3. Aoki A, Mizutani K, Schwarz F, Sculean A, Yukna RA, Takasaki AA, Romanos GE, Taniguchi Y, Sasaki KM, Zeredo JL, Koshy G, Coluzzi DJ, White JM, Abiko Y, Ishikawa I, Izumi Y. Periodontal and periimplant wound healing following laser therapy. Periodontol 2000.2015 Jun;68(1):217-69. doi: 10.1111/prd.12080. PMID:25867988.
4. Larjava H. Oral wound healing: cell biology and clinical management. Willey Blackwell Publishing 2012.
4bis. Blatt S, Thiem DGE, Pabst A, Al-Nawas B, Kämmerer PW. Does Platelet-Rich Fibrin Enhance the Early Angiogenetic Potential of Different Bone Substitute Materials? An In Vitro and In Vivo Analysis. Biomedicines. 2021 Jan 10;9(1):61. doi: 10.3390/biomedicines9010061. PMID: 33435244; PMCID: PMC7827266.
5. Westhauser F, Arango-Ospina M, Hupa L, Renkawitz T, Boccaccini AR, Kunisch E. A comparative analysis of the cytocompatibility, protein adsorption, osteogenic and angiogenic properties of the 45S5- and S53P4-bioactive glass compositions. Biomed Mater. 2024 Feb 7;19(2). doi: 10.1088/1748-605X/ad2210. PMID: 38266275.
6. Hoppe A, Güldal NS, Boccaccini AR. A review of the biological response to ionic dissolution products from bioactive glasses and glass-ceramics. Biomaterials. 2011 Apr;32(11):2757-74. doi:10.1016/j.biomaterials.2011.01.004. Epub 2011 Feb 2. PMID: 21292319.
7.Haro Durand LA , Vargas GE , Romero NM , Vera-Mesones R , Porto-López JM , Boccaccini
AR , Zago MP , Baldi A , Gorustovich A . Angiogenic effects of ionic dissolution products
released from a boron-doped 45S5 bioactive glass. J Mater Chem B. 2015 Feb 14;3(6):1142-
1148. doi: 10.1039/c4tb01840k. Epub 2014 Dec 19. PMID: 32261993.
8.Dong X , Chang J , Li H . Bioglass promotes wound healing through modulating the
paracrine effects between macrophages and repairing cells. J Mater Chem B. 2017 Jul
14;5(26):5240-5250. doi: 10.1039/c7tb01211j. Epub 2017 Jun 19. PMID: 32264109.
9.Day RM. Bioactive glass stimulates the secretion of angiogenic growth factors and
angiogenesis in vitro. Tissue Eng. 2005 May-Jun;11(5-6):768-77. doi:
10.1089/ten.2005.11.768. PMID: 15998217.
10.Chen S, Michálek M, Galusková D, Michálková M, Švančárek P, Talimian A, Kaňková H,
Kraxner J, Zheng K, Liverani L, Galusek D, Boccaccini AR. Multi-targeted B and Co co-doped
45S5 bioactive glasses with angiogenic potential for bone regeneration. Mater Sci Eng C
Mater Biol Appl. 2020 Jul;112:110909. doi: 10.1016/j.msec.2020.110909. Epub 2020 Mar 31.
PMID: 32409063.
11.Li Y, Zhang X, He D, Ma Z, Xue K, Li H. 45S5 Bioglass® works synergistically with siRNA to
downregulate the expression of matrix metalloproteinase-9 in diabetic wounds. Acta
Biomater. 2022 Jun;145:372-389. doi: 10.1016/j.actbio.2022.04.010. Epub 2022 Apr 12.
PMID: 35421617.
12.Varanasi VG, Odatsu T, Bishop T, Chang J, Owyoung J, Loomer PM. Enhanced
osteoprogenitor elongated collagen fiber matrix formation by bioactive glass ionic silicon
dependent on Sp7 (osterix) transcription. J Biomed Mater Res A. 2016 Oct;104(10):2604-15.
doi: 10.1002/jbm.a.35795. Epub 2016 Aug 15. PMID: 27279631; PMCID: PMC6673658.
13.Qazi TH, Berkmann JC, Schoon J, Geißler S, Duda GN, Boccaccini AR, Lippens E. Dosage
and composition of bioactive glasses differentially regulate angiogenic and osteogenic
response of human MSCs. J Biomed Mater Res A. 2018 Nov;106(11):2827-2837. doi:
10.1002/jbm.a.36470. Epub 2018 Oct 3. PMID: 30281904.
14.Gorustovich AA, Roether JA, Boccaccini AR. Effect of bioactive glasses on angiogenesis: a
review of in vitro and in vivo evidences. Tissue Eng Part B Rev. 2010 Apr;16(2):199-207. doi:
10.1089/ten.TEB.2009.0416. PMID: 19831556.