La péri-implantite est caractérisée par une perte osseuse et son traitement représente un défi pour le praticien dans la pratique quotidienne avec un pronostic douteux. pour sa prise en charge, une approche chirurgicale est fréquemment nécessaire afin de permettre une décontamination de la surface de l’implant et, dans quelques cas, la reconstruction des tissus. Cet article présente les recommandations actuelles pour l’utilisation des techniques chirurgicales ainsi que leurs résultats lors de la prise en charge des péri-implantites.
INTRODUCTION
La péri-implantite est une maladie inflammatoire des tissus de soutien des implants dentaires d’origine bactérienne, caractérisée par la perte osseuse autour des implants (Berglundh et al., 2018). Cette maladie affecte en moyenne 9,25 % des implants et 19,83 % des patients porteurs d’implants (Lee et al., 2017). En l’absence de traitement, la perte osseuse est progressive et accélérative (Derks et al., 2016) et elle peut aboutir à la perte de l’implant (Monje & Nart, 2022). Ainsi, le traitement des péri-implantites est nécessaire pour arrêter la perte osseuse et ses conséquences au niveau esthétique ou fonctionnel (Khoury et al., 2019).
Le traitement des péri-implantites doit tenir compte du diagnostic initial, basé sur la profondeur de sondage, le saignement et/ou la suppuration et la perte osseuse (Berglundh et al., 2018), mais également d’autres facteurs de risque comme l’état parodontal, l’absence de suivi ou le mauvais contrôle de plaque (Schwarz et al., 2018). Ainsi, la prise en charge débute par l’éducation en hygiène bucco-dentaire, le contrôle des facteurs de risque, l’adaptation des prothèses sur implant et le traitement non-chirurgical consistant en un débridement supra- et sous-gingival.
Une réévaluation aura lieu après 6 à 12 semaines afin d’évaluer le résultat du traitement initial (Herrera et al., 2023).
Bien que quelques études aient montré que le traitement initial peut stabiliser jusqu’à 50 % des cas de péri-implantitites (Blanco et al., 2022; Nart et al., 2020), son efficacité dans les cas avancés est limitée (Renvert & Polyzois, 2018). Si lors de la réévaluation après le traitement non-chirurgical, il y a des poches profondes résiduelles (sondage > 5 mm) avec saignement malgré un contrôle de plaque optimal, une chirurgie péri-implantaire sera indiquée à condition que le patient arrive à garder un niveau d’hygiène bucco-dentaire optimal (Herrera et al., 2023). Dans ces cas, le traitement chirurgical permettra un accès aisé à la surface de l’implant afin de faciliter sa décontamination (Renvert & Polyzois, 2018). Cet article parcourt les indications, les techniques et les résultats du traitement chirurgical des péri-implantites.
INDICATIONS
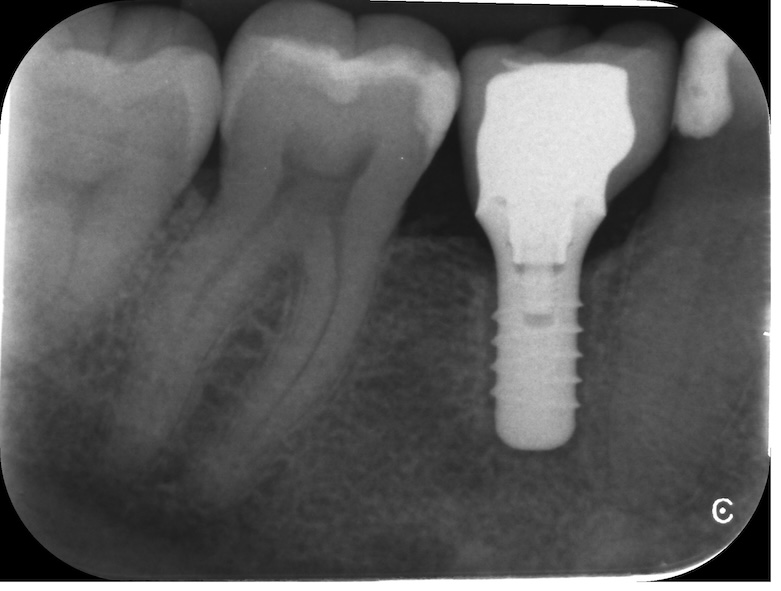
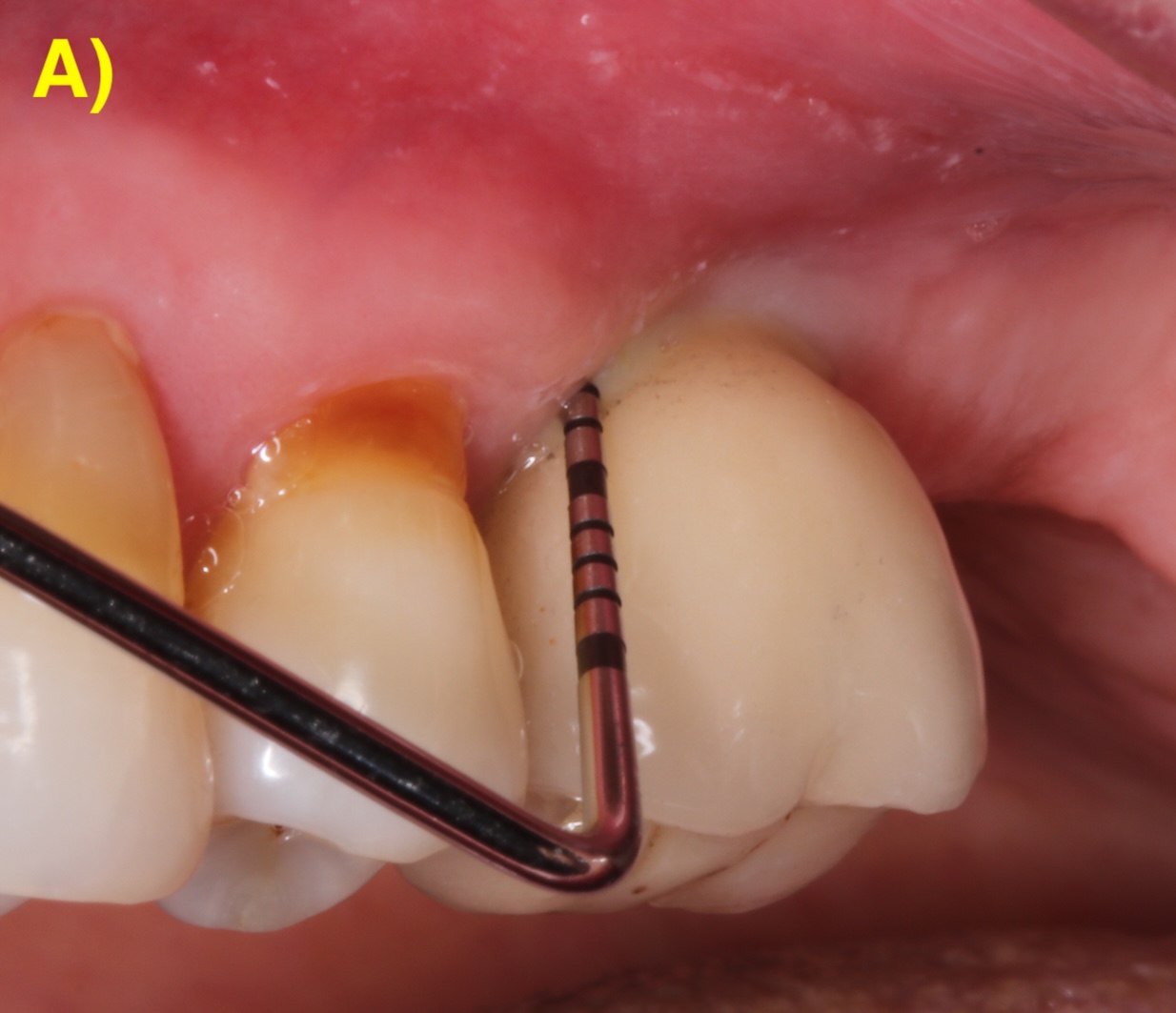
Avant de commencer un traitement chirurgical, il faut évaluer si la stabilisation de la péri-implantite est possible. En effet, lors d’un implant mobile, une ligne radio-claire peut être visible autour de l’implant à l’examen radiologique et c’est un signe pathognomonique d’absence de contact os-implant ou perte de l’ostéointégration (Figure 1). Dans ces cas, l’explantation est indiquée (Polyzois, 2019; Sinjab et al., 2018).
Dans le cas où l’implant conserve encore leur stabilité, il faudra évaluer le niveau de la perte osseuse. En effet, le niveau osseux initial est un facteur pronostic pour le traitement chirurgical et il est proportionnellement corrélé à la réussite de l’intervention (de Waal et al., 2016). Ainsi, quand la perte osseuse affecte uniquement le tiers coronaire de l’implant, les chances de stabilisation sont plus élévées (Lagervall & Jansson, 2013). Cependant, à partir de 50 – 60% de perte osseuse, la stabilisation devient imprévisible et l’explantation est conseillée (Martin- abezas & Giannopoulou, 2024).
TYPES DE DÉFAUT OSSEUX PÉRI-IMPLANTAIRE
Après le débridement du tissu de granulation, le type de défaut osseux est évalué en fonction du nombre de parois résiduelles pour déterminer les possibilités de régénération (Polyzois, 2019). Les défauts peuvent se classer selon la morphologie, le nombre de parois résiduelles (circonférentiel, 3 ou 2 parois, ou déhiscence) et leur sévérité (Monje et al., 2019).
Selon leur morphologie, les défauts peuvent être horizontaux, c’est à dire supra-osseux, ou verticaux, infra-osseux. Dans quelques cas, on retrouvera un défaut combiné avec une composante supra-osseuse et une autre infra-osseuse. Bien que le défaut horizontal ne permette pas la régénération, les défauts infra-osseux peuvent être régénérés selon le nombre de parois résiduelles (Polyzois, 2019).
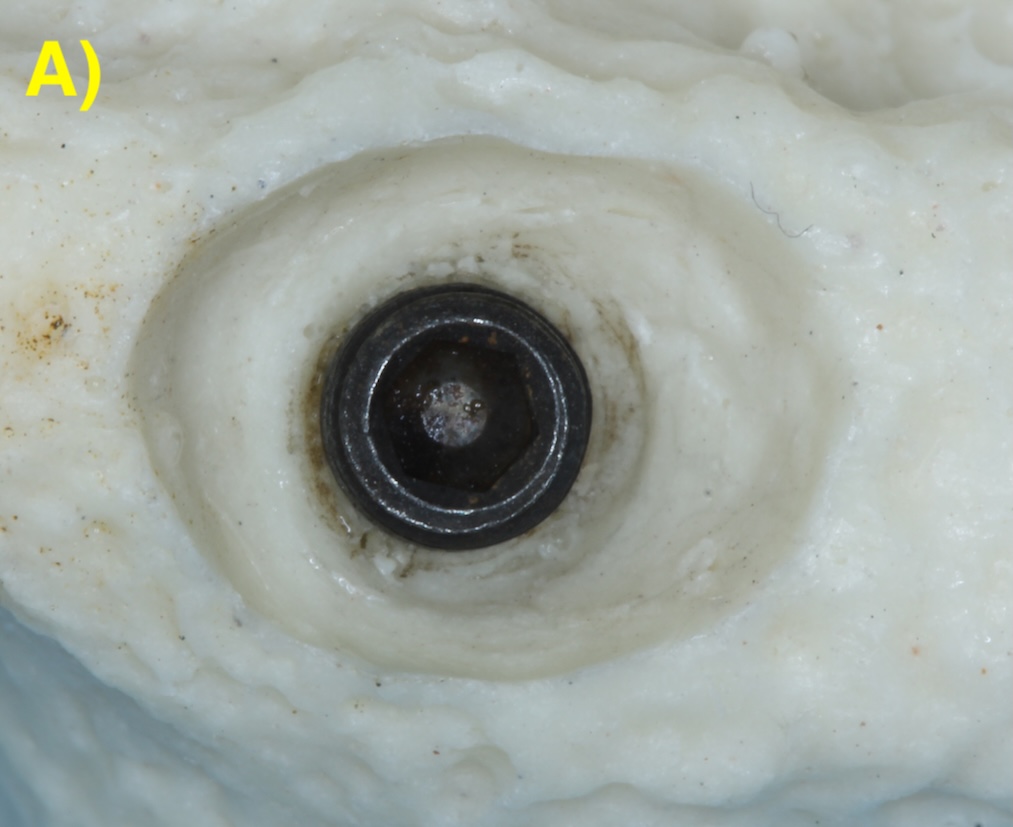
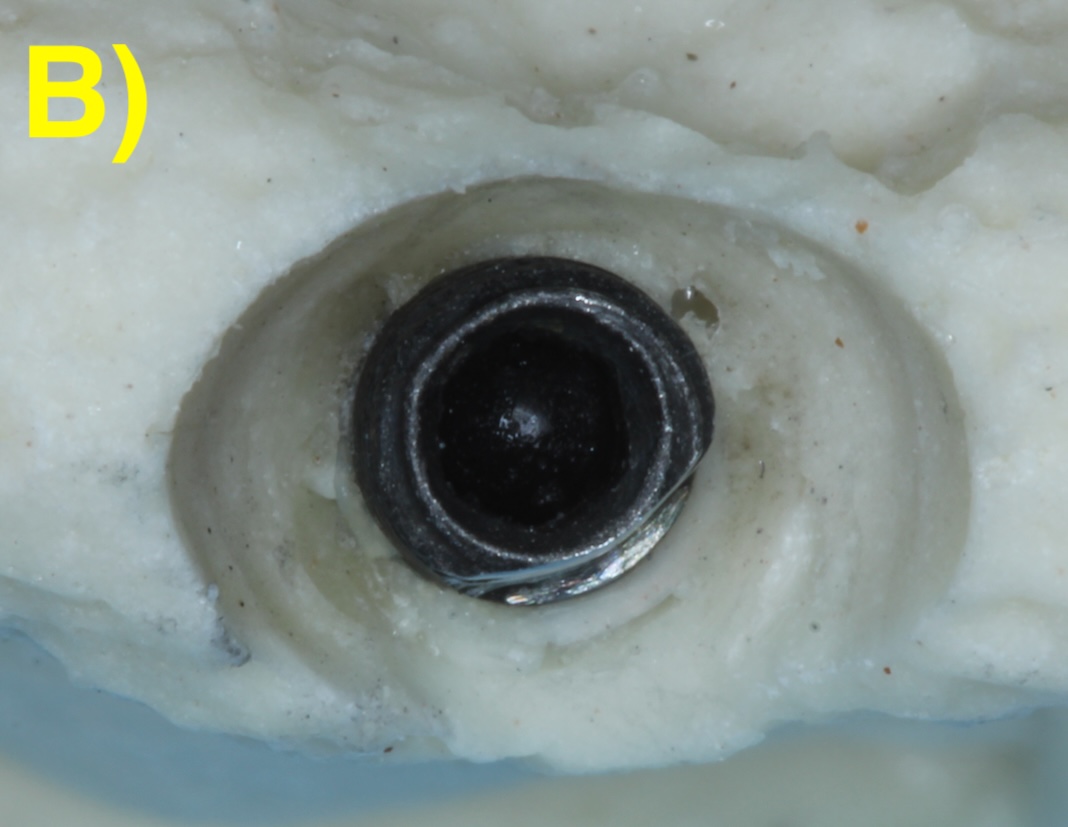
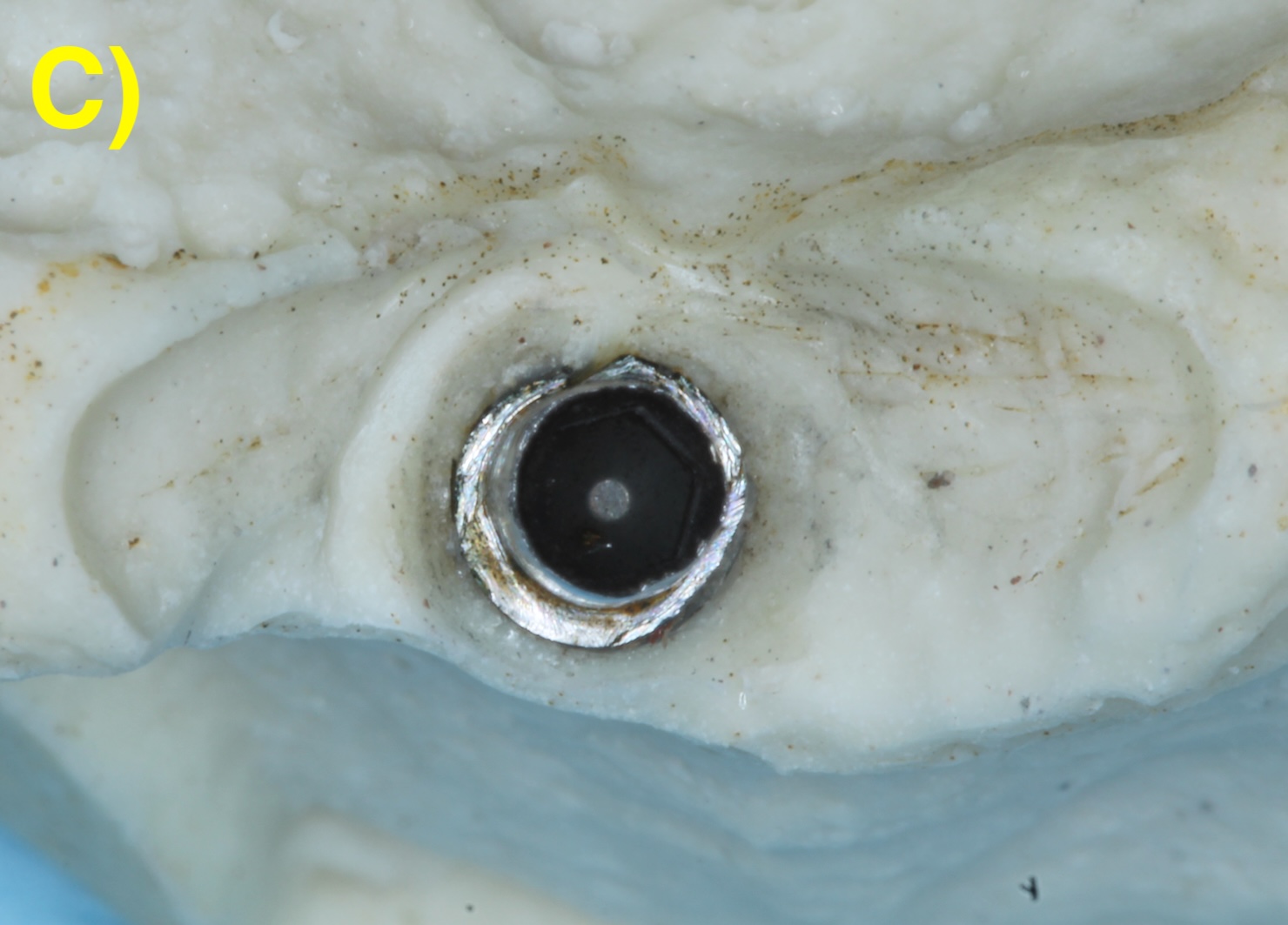
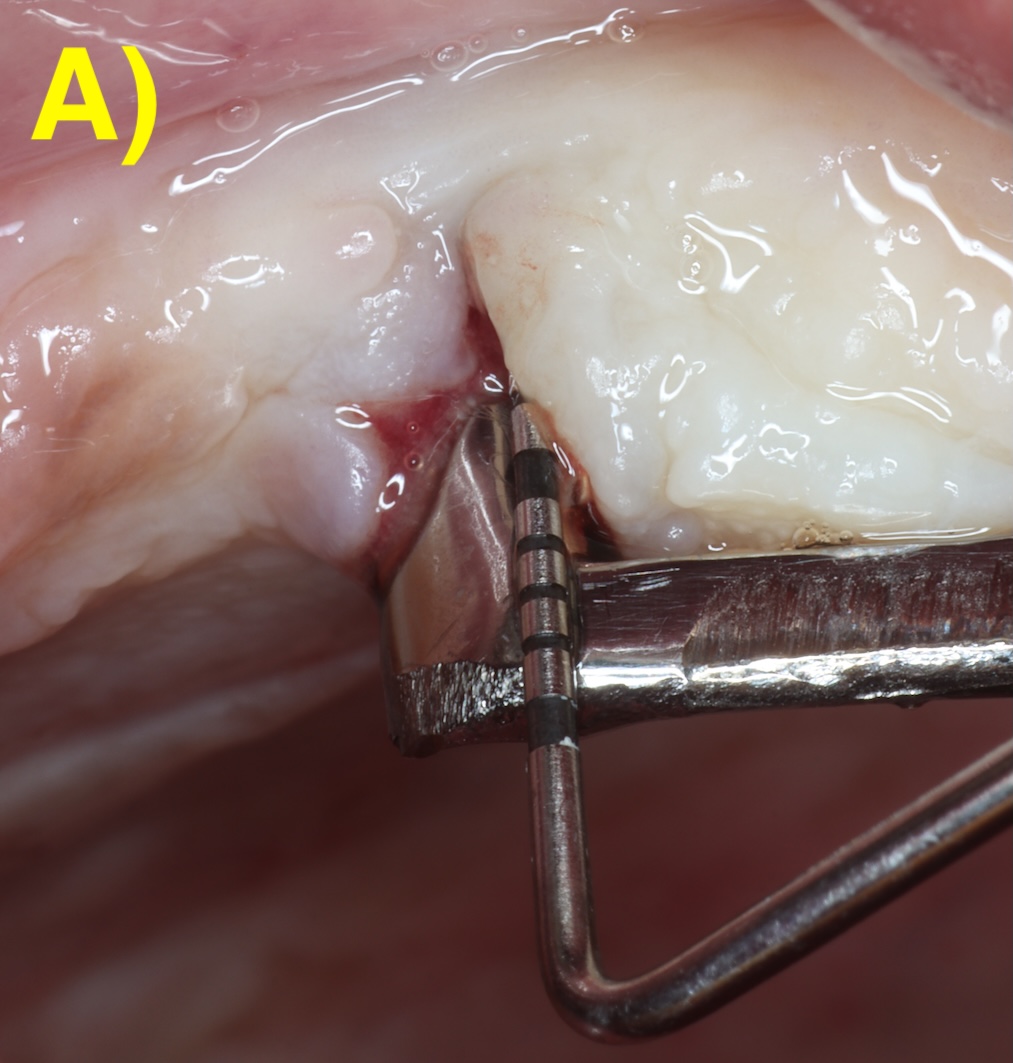
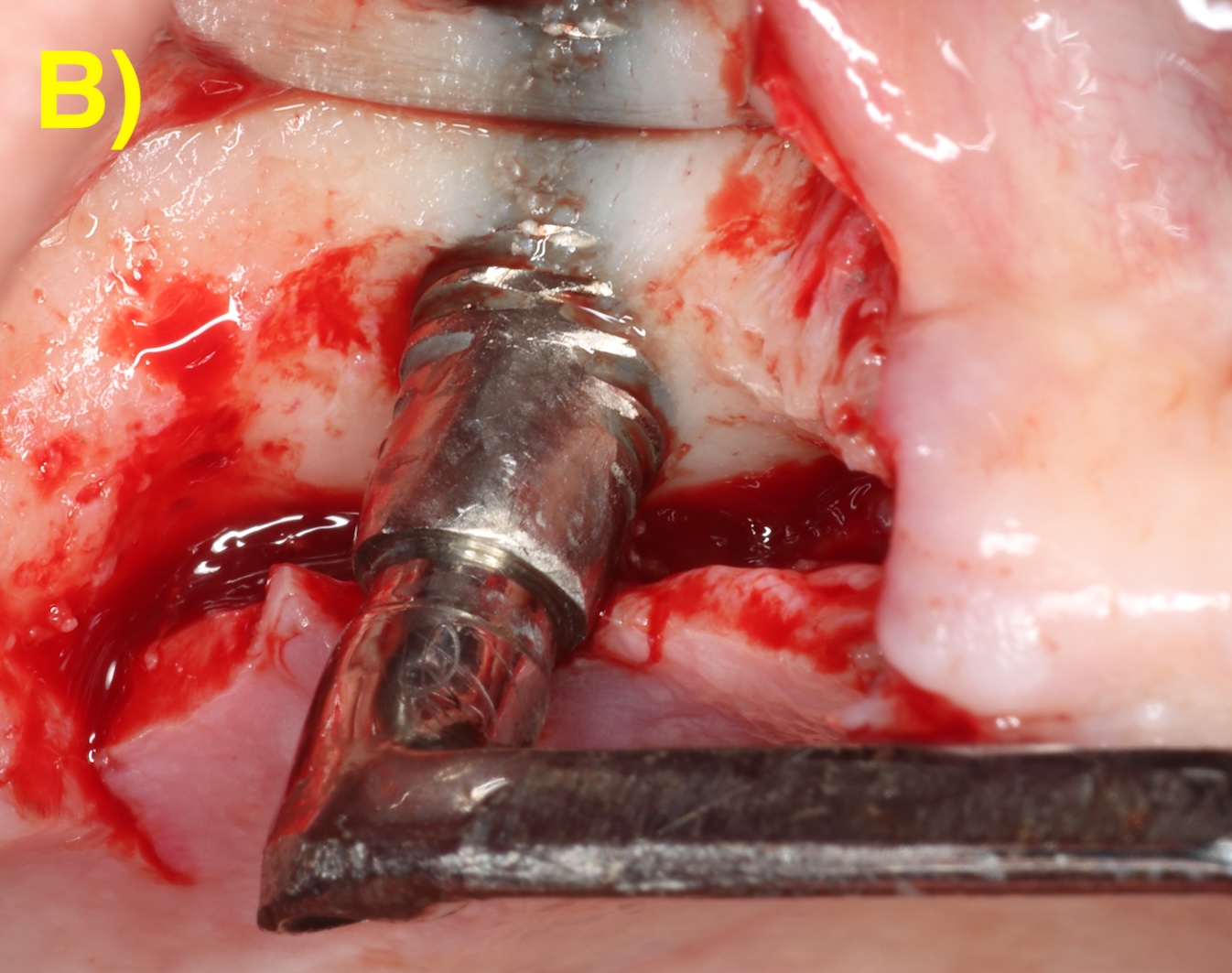
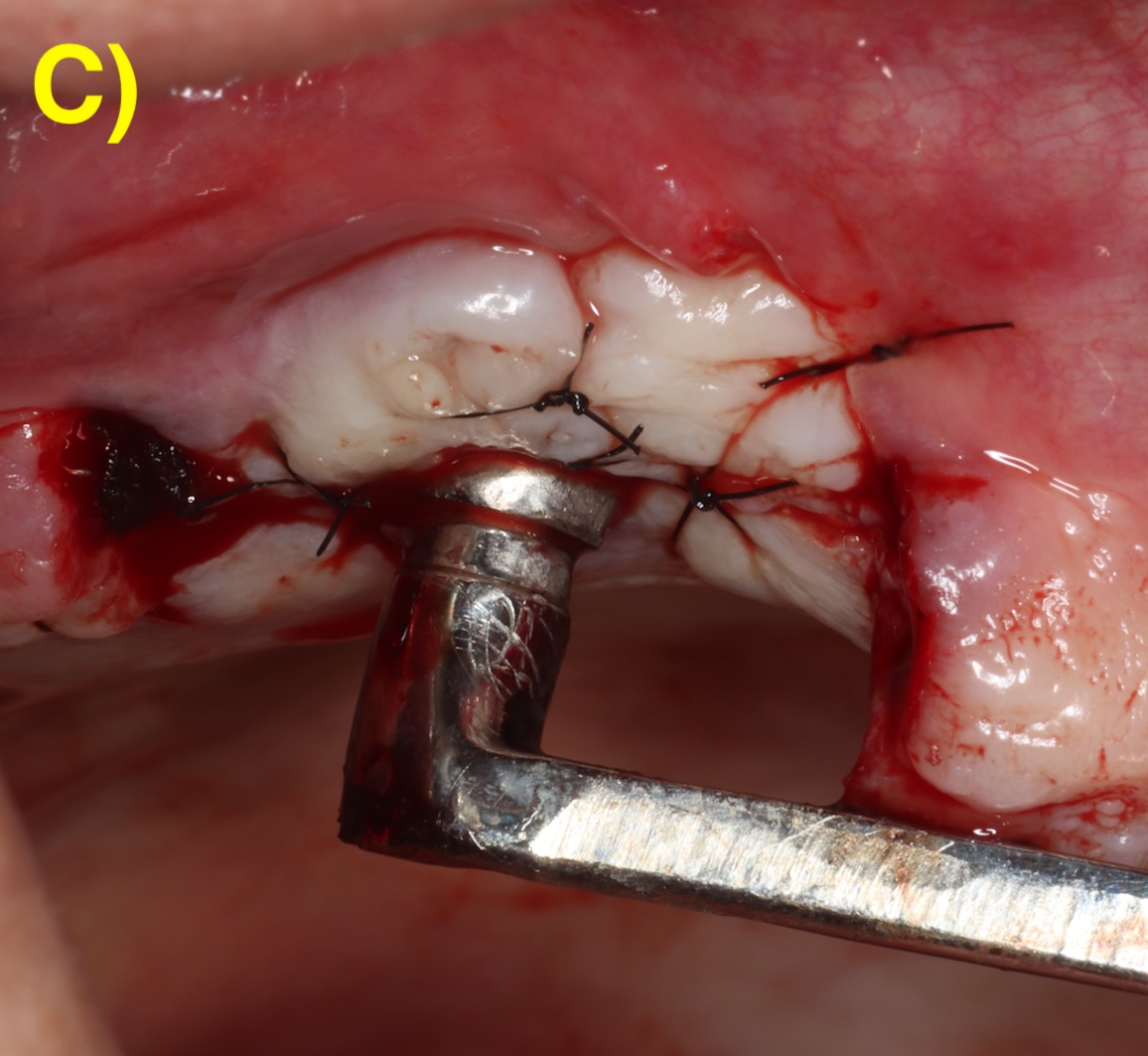
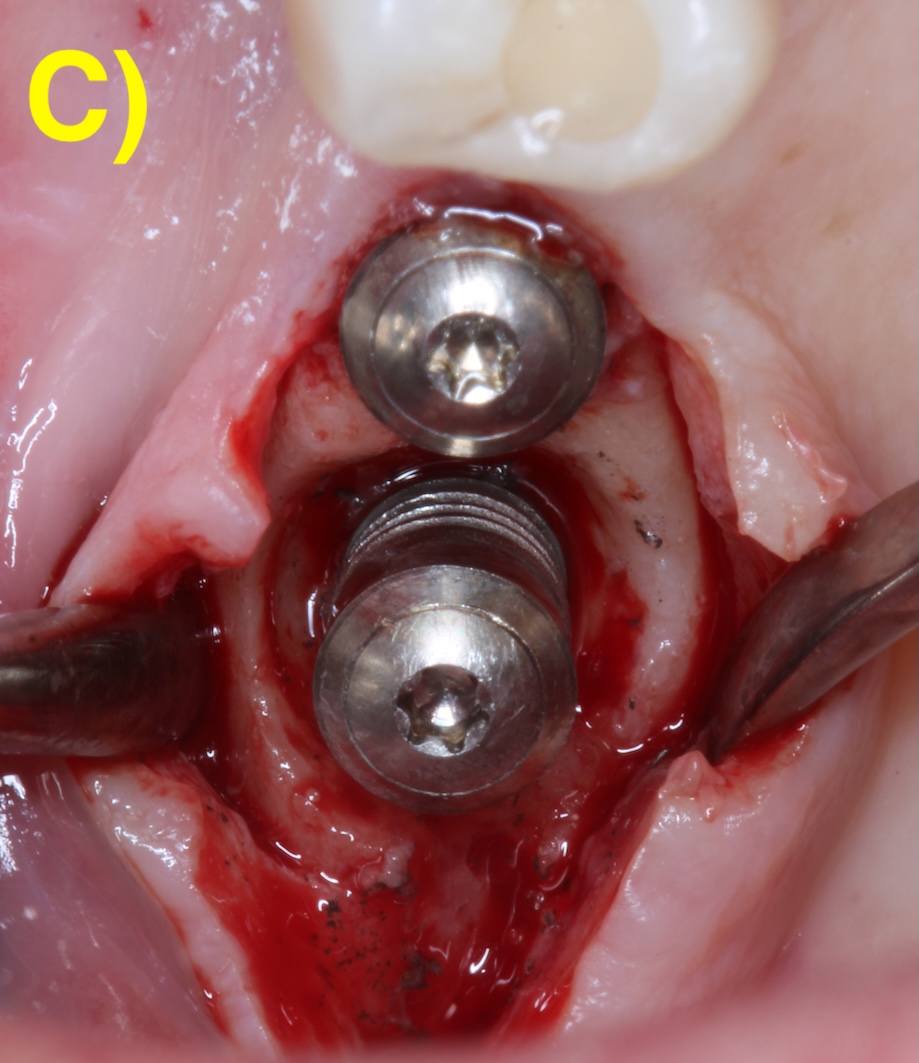
Quand l’os alvéolaire est large, la perte osseuse circonférentielle autour de l’implant peut conserver toutes les parois osseuses en forme de cratère (défaut à quatre parois). Plus la base osseuse est étroite, plus il sera fréquent de retrouver une absence des corticales vestibulaires (3 parois) ou vestibulaires et palatines/linguales (2 parois). Figure 2 (Aghazadeh et al., 2020).
Figure 2 : différentes morphologies de défauts périimplantaires.
A) Circonférentiel
B) 3 parois
C) 2 parois
Enfin, la sévérité est évaluée selon le pourcentage de perte osseuse autour de l’implant. Ainsi, on parlera des défauts légers, moderés ou sévères selon une atteinte de moins de 25 %, entre 25 et 50 % ou supérieure à 50 %, respectivement (Monje et al., 2019).
TYPES DE CHIRURGIE PÉRI-IMPLANTAIRE
À l’égard de la chirurgie parodontale, il y a différentes approches de chirurgie péri-implantaire :
résective, lambeau d’assainissement et régénérative.
Le choix de la technique dépend de plusieurs facteurs : localisation de l’implant (secteur esthétique ou nonesthétique), type de défaut osseux (supra-osseux; infra-osseux ou combiné) et nombre de parois résiduelles (Renvert & Polyzois, 2018).
CHIRURGIE RÉSECTIVE
L’objectif de la chirurgie résective est de repositionner apicalement le lambeau afin de réduire la profondeur des poches et d’améliorer l’accès à l’hygiène. Cette technique implique des incisions en biseau interne, adaptées à la quantité de muqueuse kératinisée et à l’épaisseur de la muqueuse, ainsi que des incisions de décharge verticales si nécessaire. Toutefois, elle entraîne des récessions gingivales marquées et est donc contre-indiquée en secteur esthétique (Figuero et al., 2014) (Figure 3).
Figure 3 : chirurgie résective autour d’un implant pilier d’une overdenture avec désépaississement de la muqueuse et implantoplastie. Notez le repositionnement apical du lambeau afin de permettre l’accès à l’hygiène.
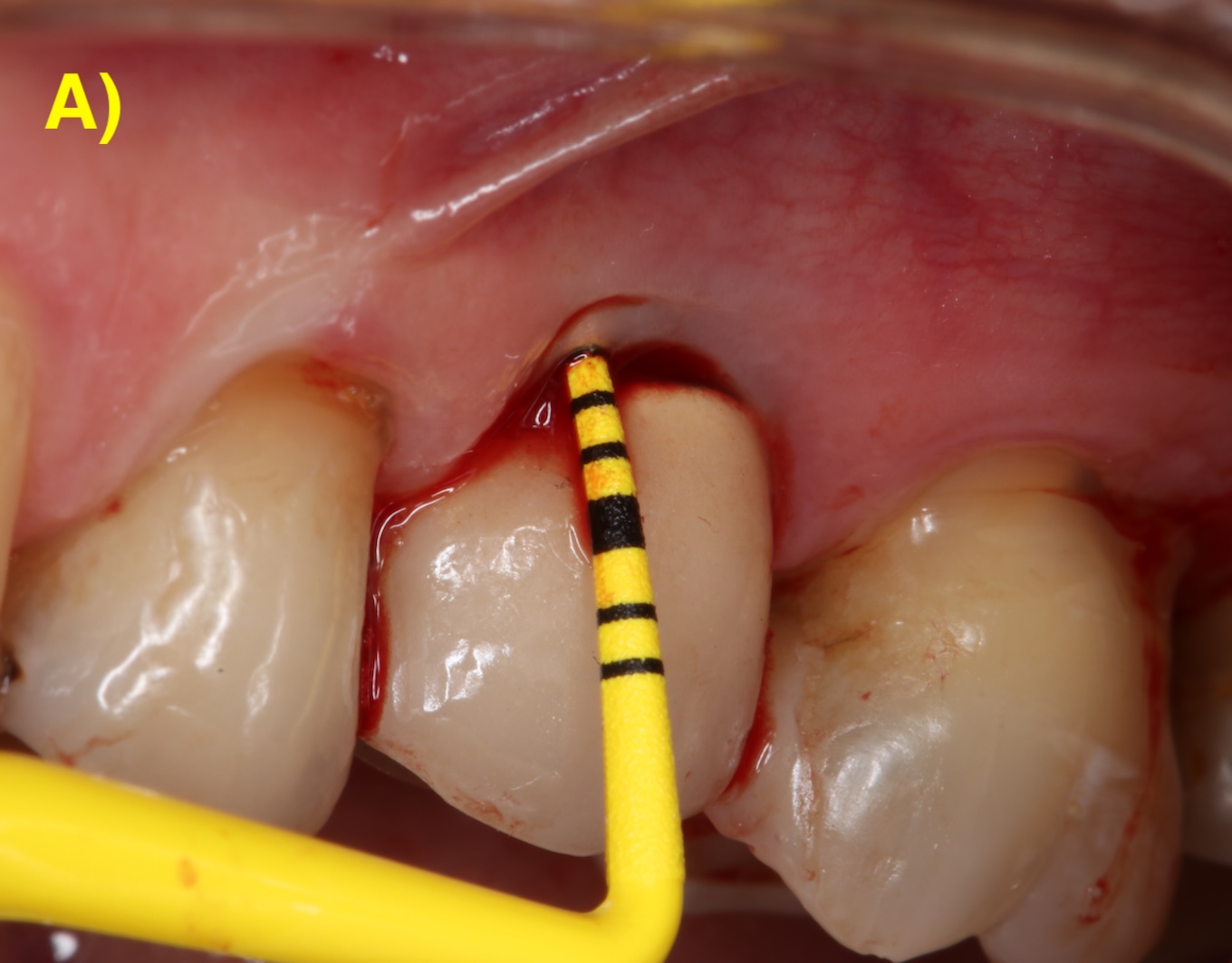
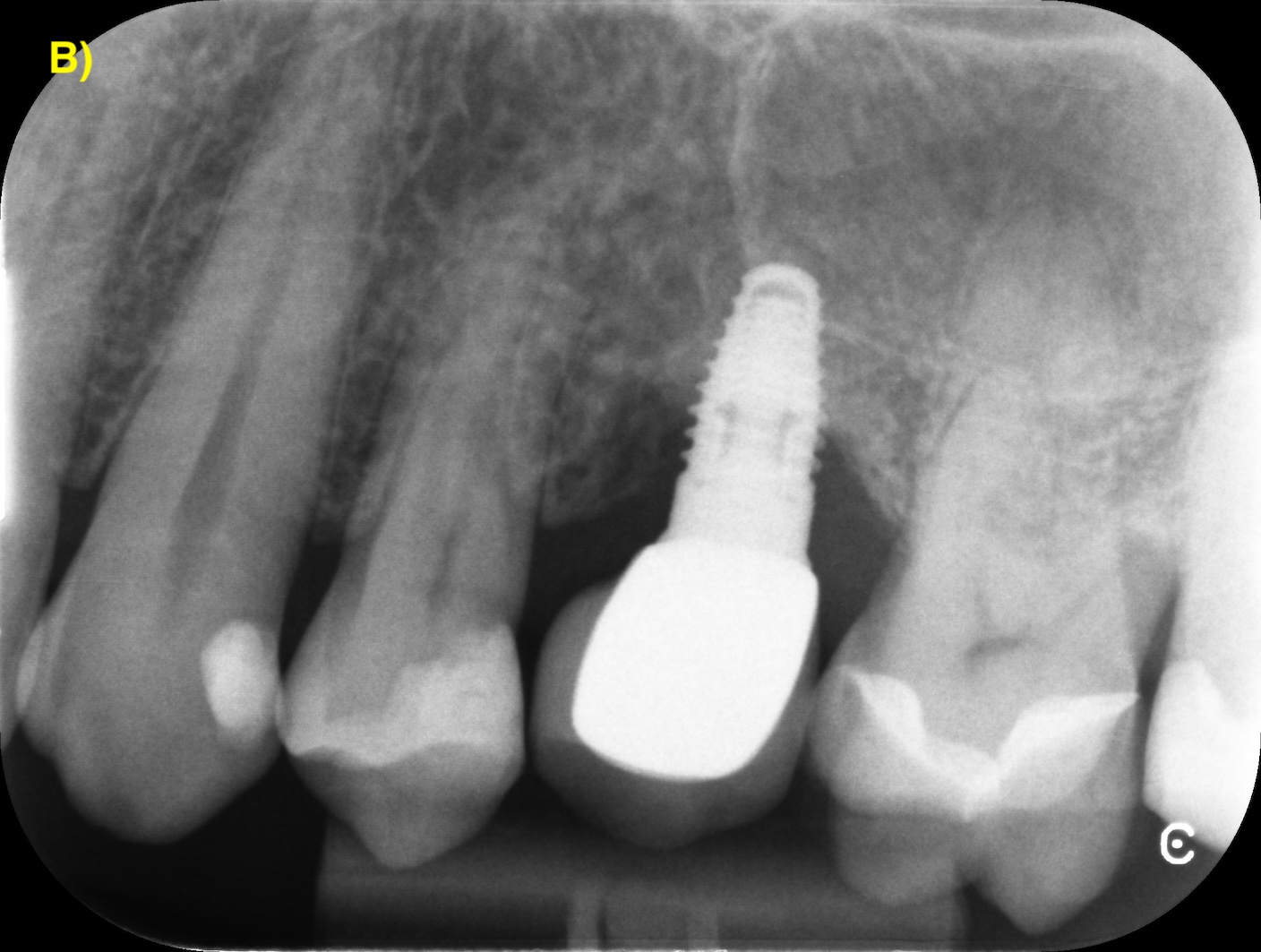
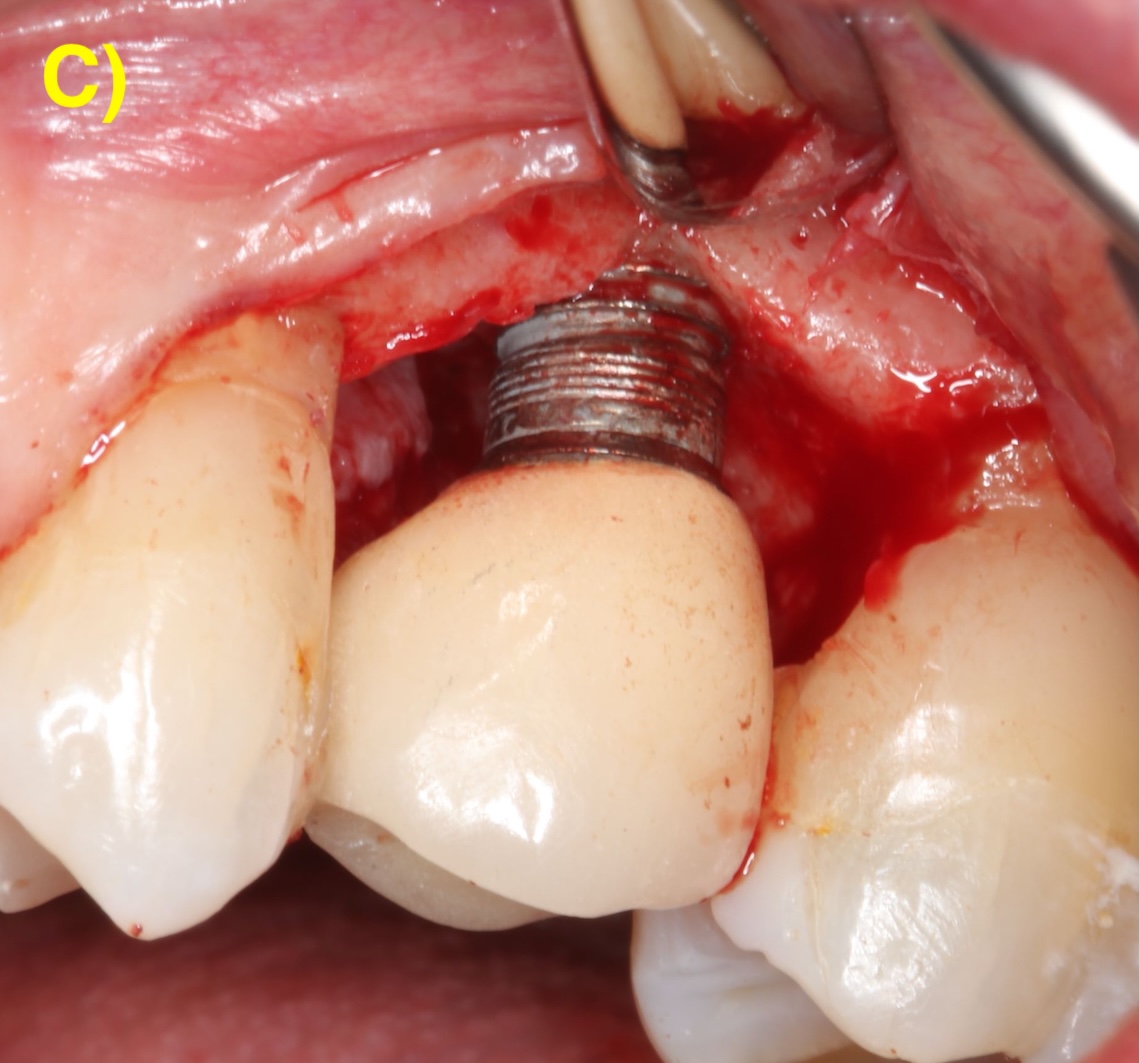
LAMBEAU D’ASSAINISSEMENT
Le lambeau d’assainissement permet un accès direct à la surface implantaire pour sa décontamination.
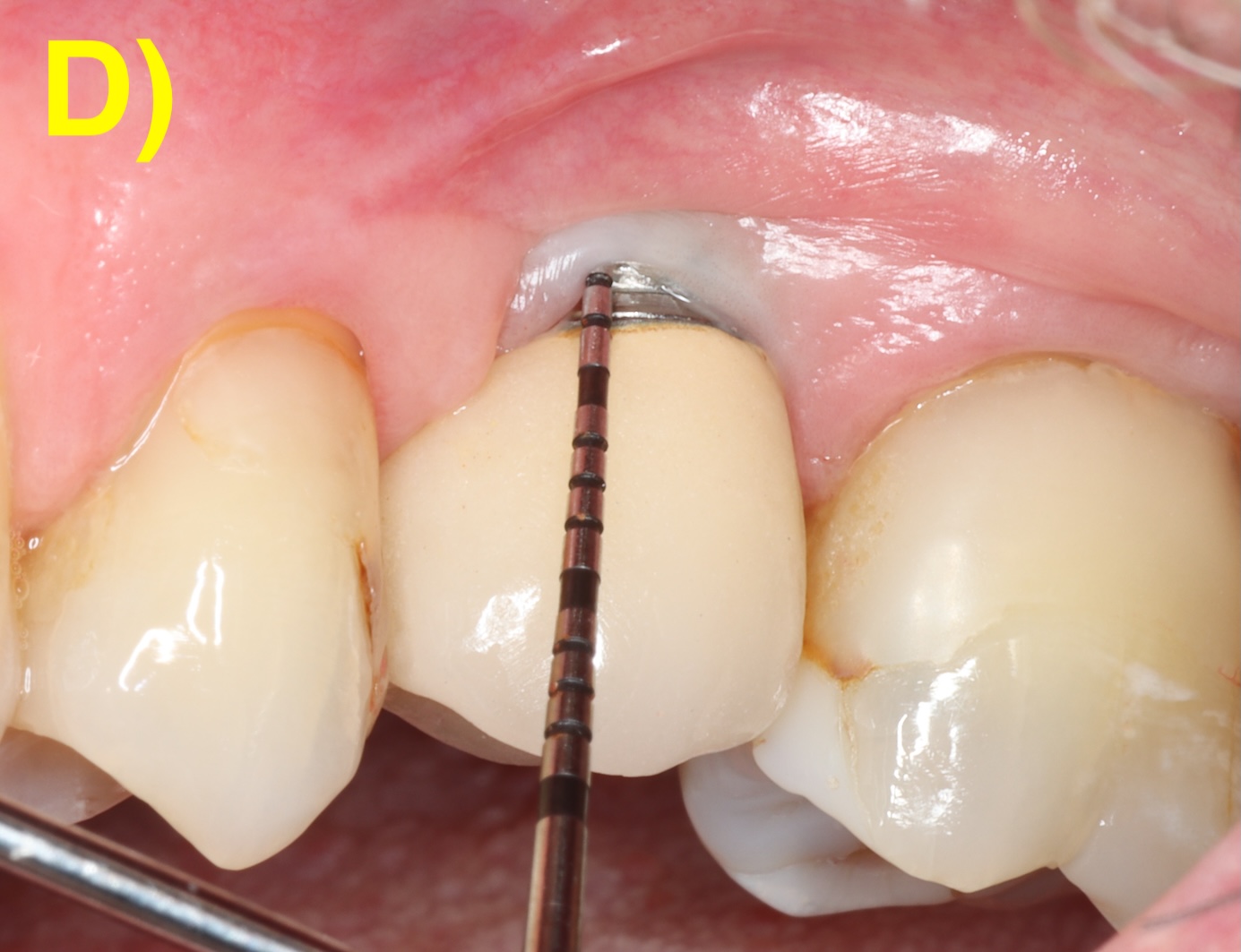
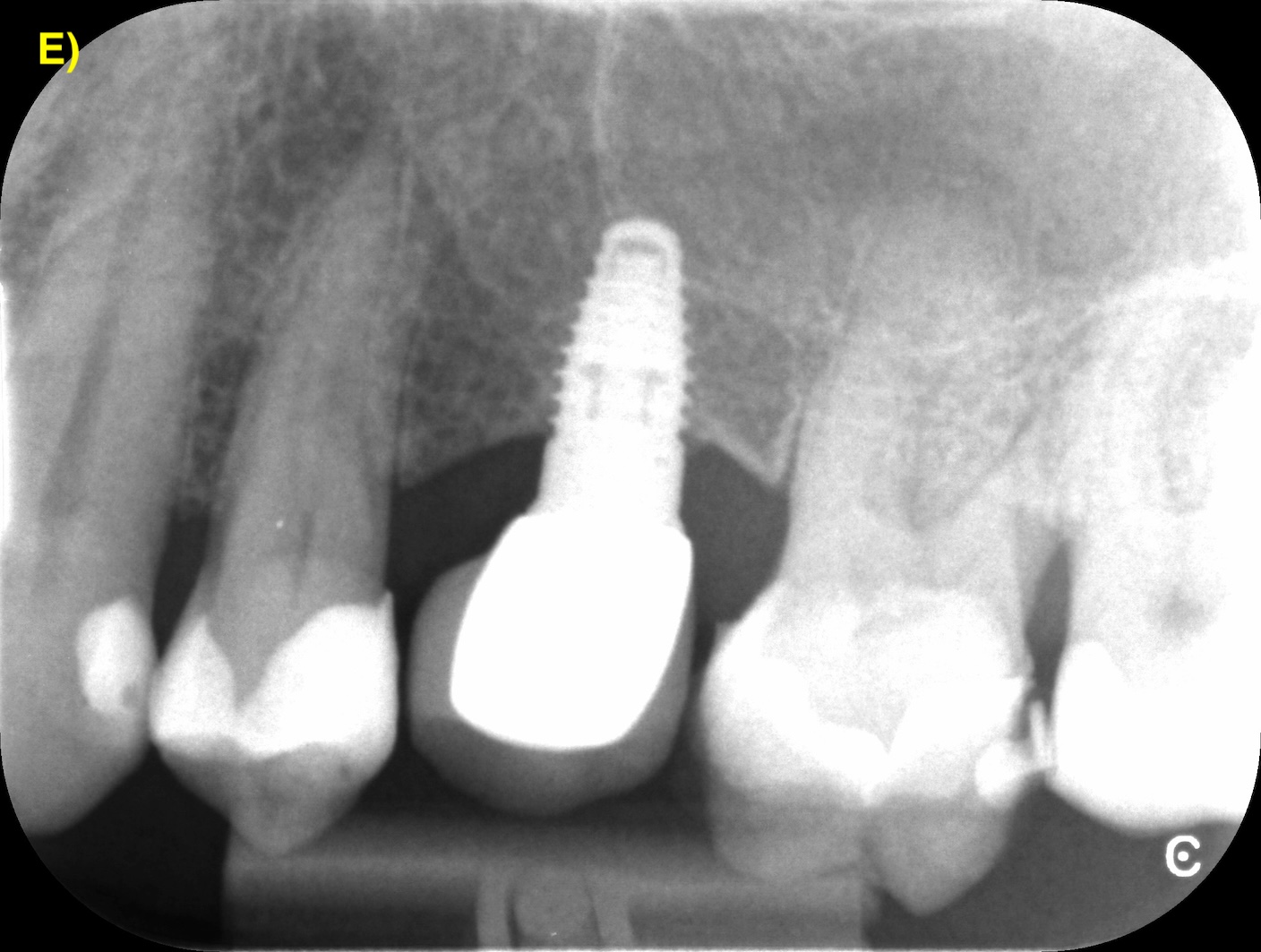
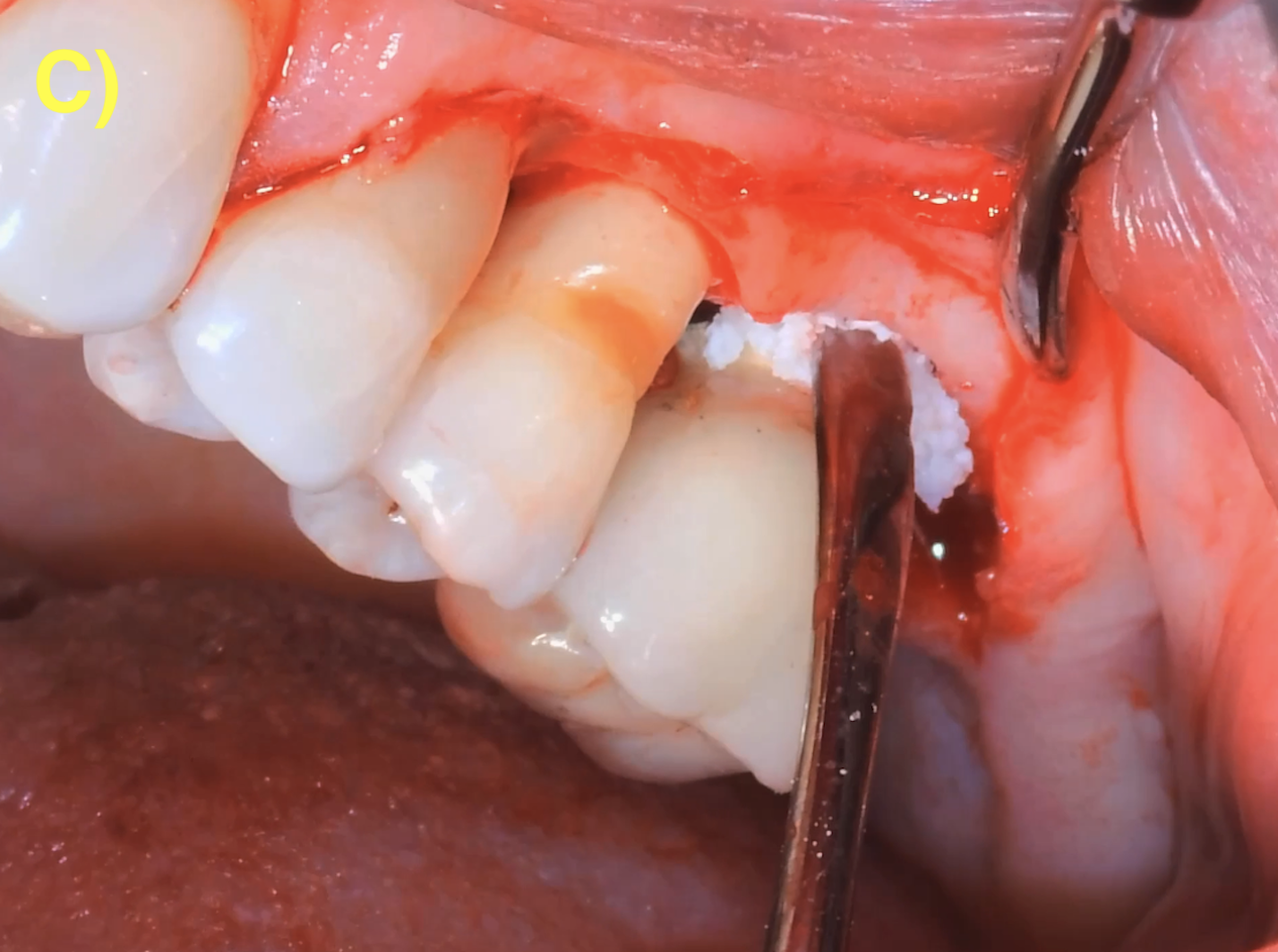
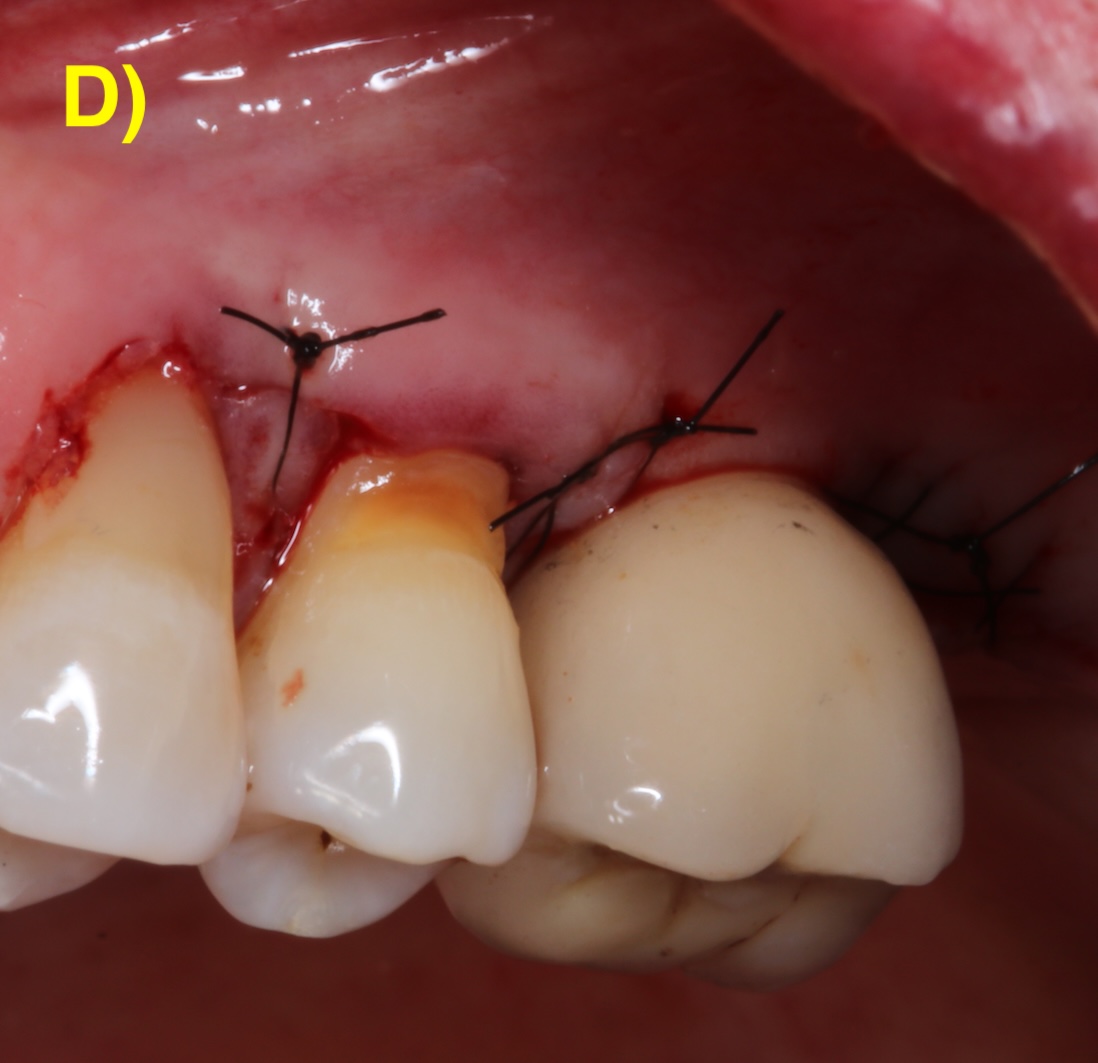
Des incisions intrasulculaires sont réalisées afin de soulever un lambeau d’épaisseur totale. Une fois le tissu de granulation débridé et la surface de l’implant décontaminée, le lambeau sera suturé dans sa position initiale. (Figure 4) (Figuero et al., 2014).
Figure 4 : lambeau d’assainissement autour d’un implant avec une prothèse scellée. A) et B) Situations clinique et radiographique initiales. C) Situation intra-opératoire. D – E) Situations clinique et radiographique après 6 ans de suivi. Notez la récession d’environ 1 mm et la corticalisation osseuse radiographique après le traitement.
CHIRURGIE RÉGÉNÉRATIVE
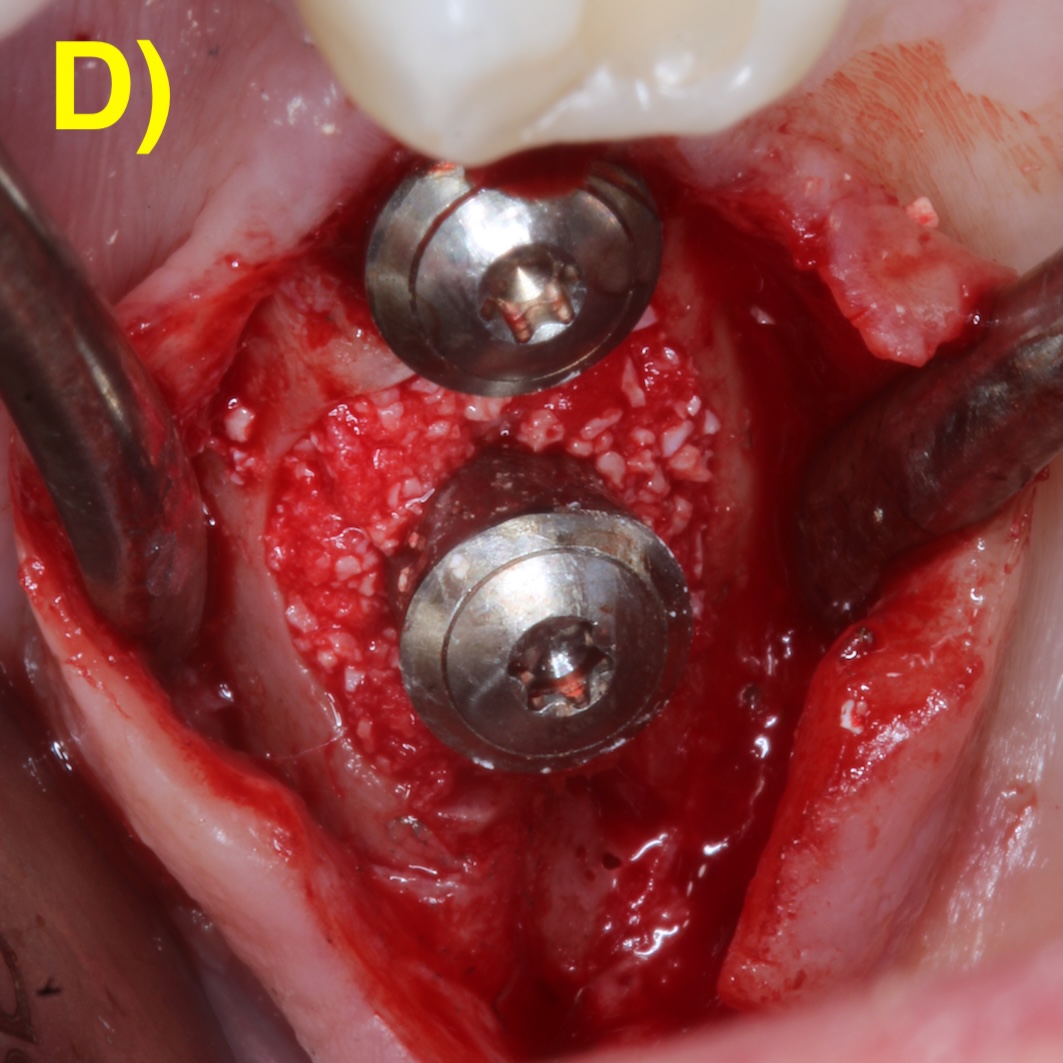
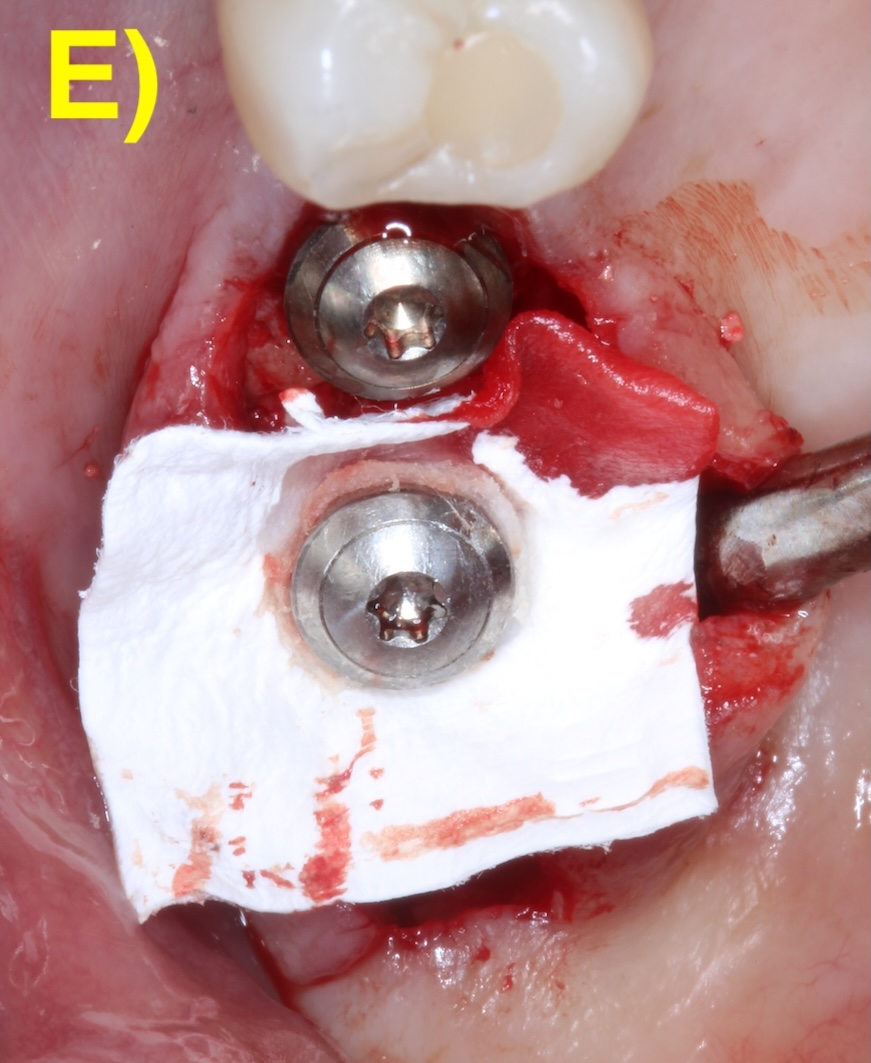
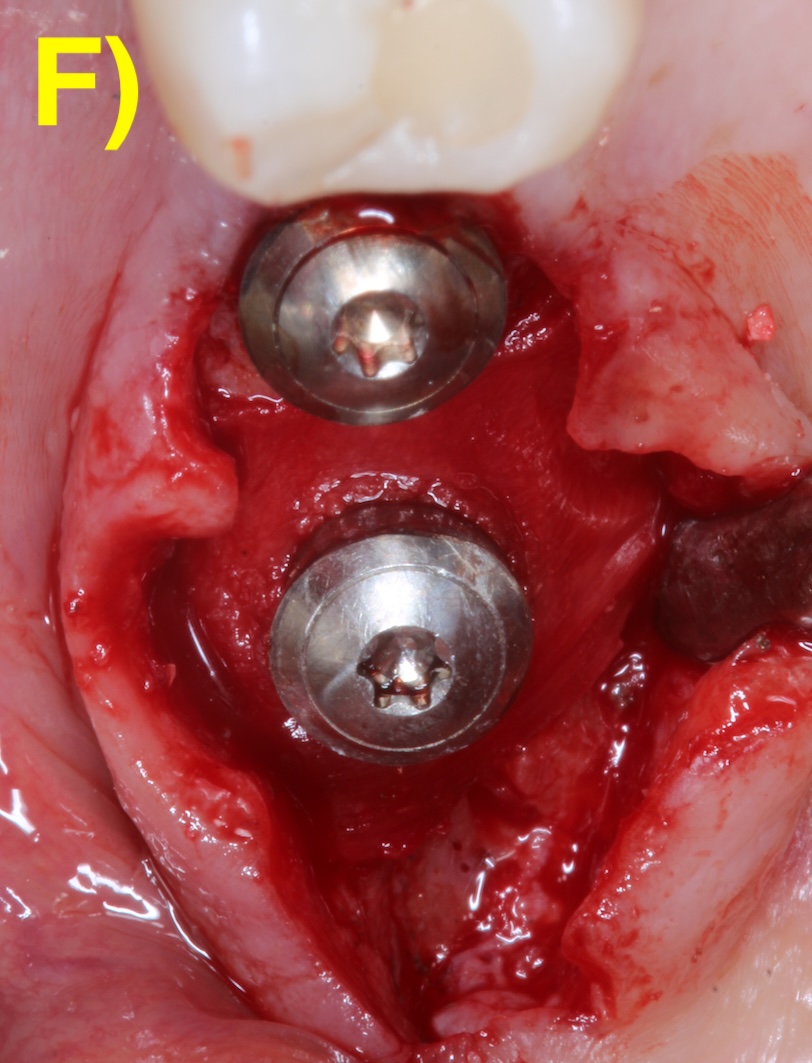
L’objectif des approches régénératives est de combler la partie infra-osseuse du défaut péri-implantaire par l’utilisation de biomatériaux tels que les substituts osseux (Figure 5).
Figure 5 : chirurgie de régénération péri-implantaire d’un défaut infra-osseux.
Elles est indiquée en présence d’un défaut infraosseux d’au moins 3 mm (Herrera et al., 2023). Des incisions intrasulculaires sont réalisées afin de préserver la plus grande quantité de tissu keratinisé et un lambeau de épaisseur total est réalisé. Après le débridement du tissu de granulation et la décontamination de l’implant, le défaut sera comblé (Figuero et al., 2014).
Les membranes résorbables peuvent être utilisées lorsque la stabilité du matériel de comblement ne peut pas être garantie (Renvert & Polyzois, 2018).
Toutefois, dans les cas où le défaut est contenant, les membranes n’ont pas montré de bénéfice clinique à long terme (Regidor et al., 2023; Roos-Jansaker et al., 2014) et aujourd’hui, les greffes osseuses avec ou sans membrane peuvent être considérées (Herrera et al., 2023; Khoury et al., 2019).
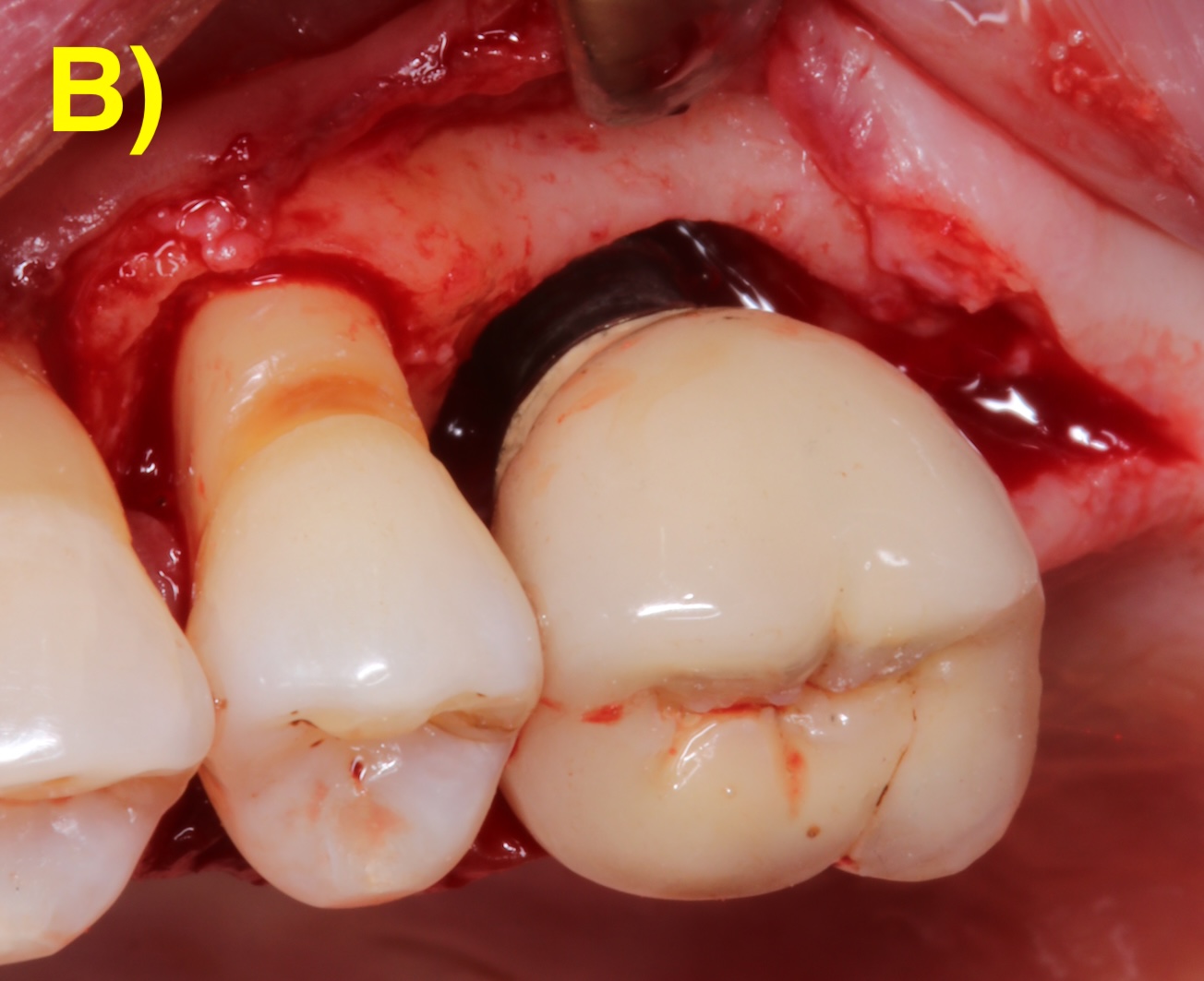
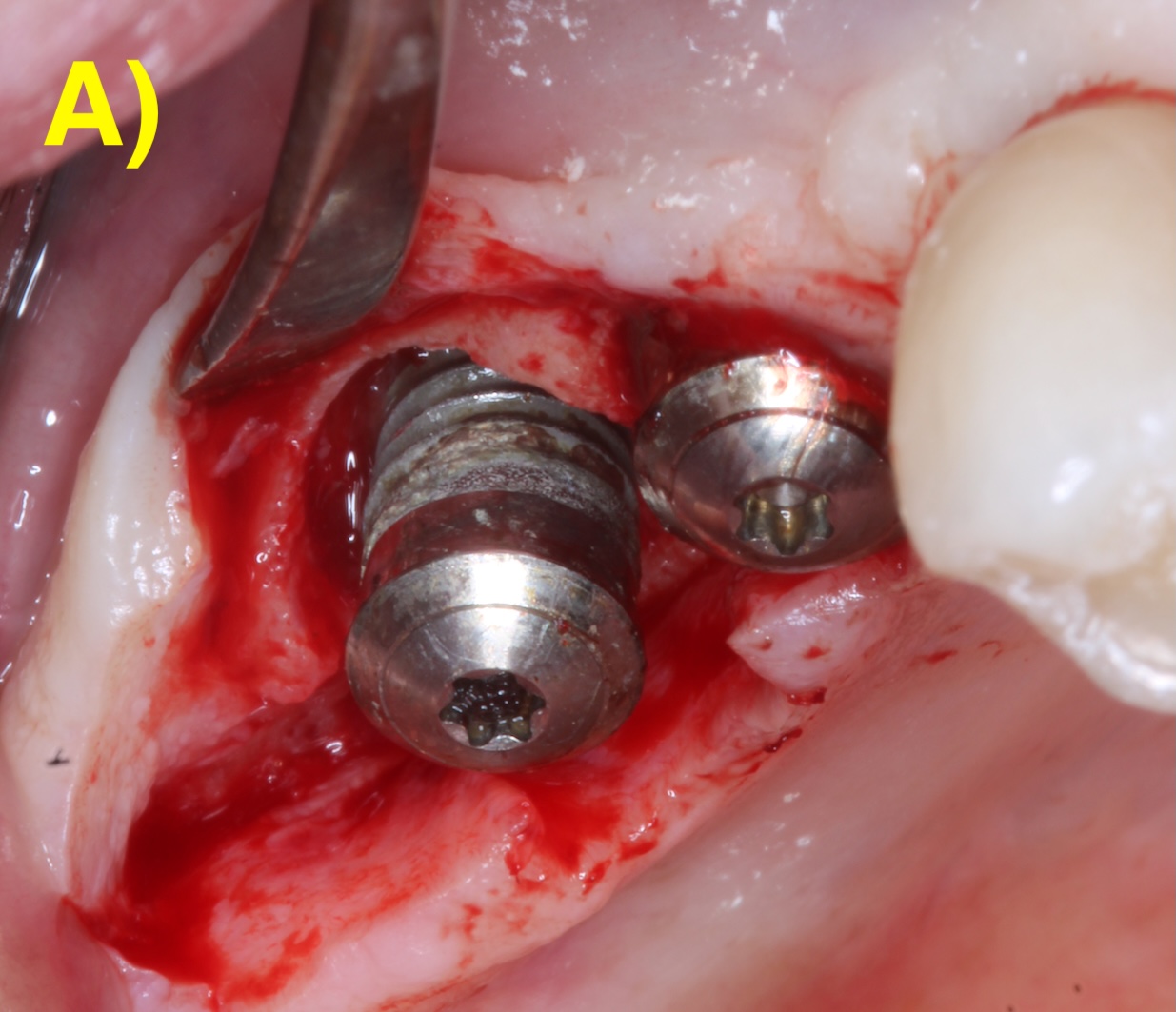
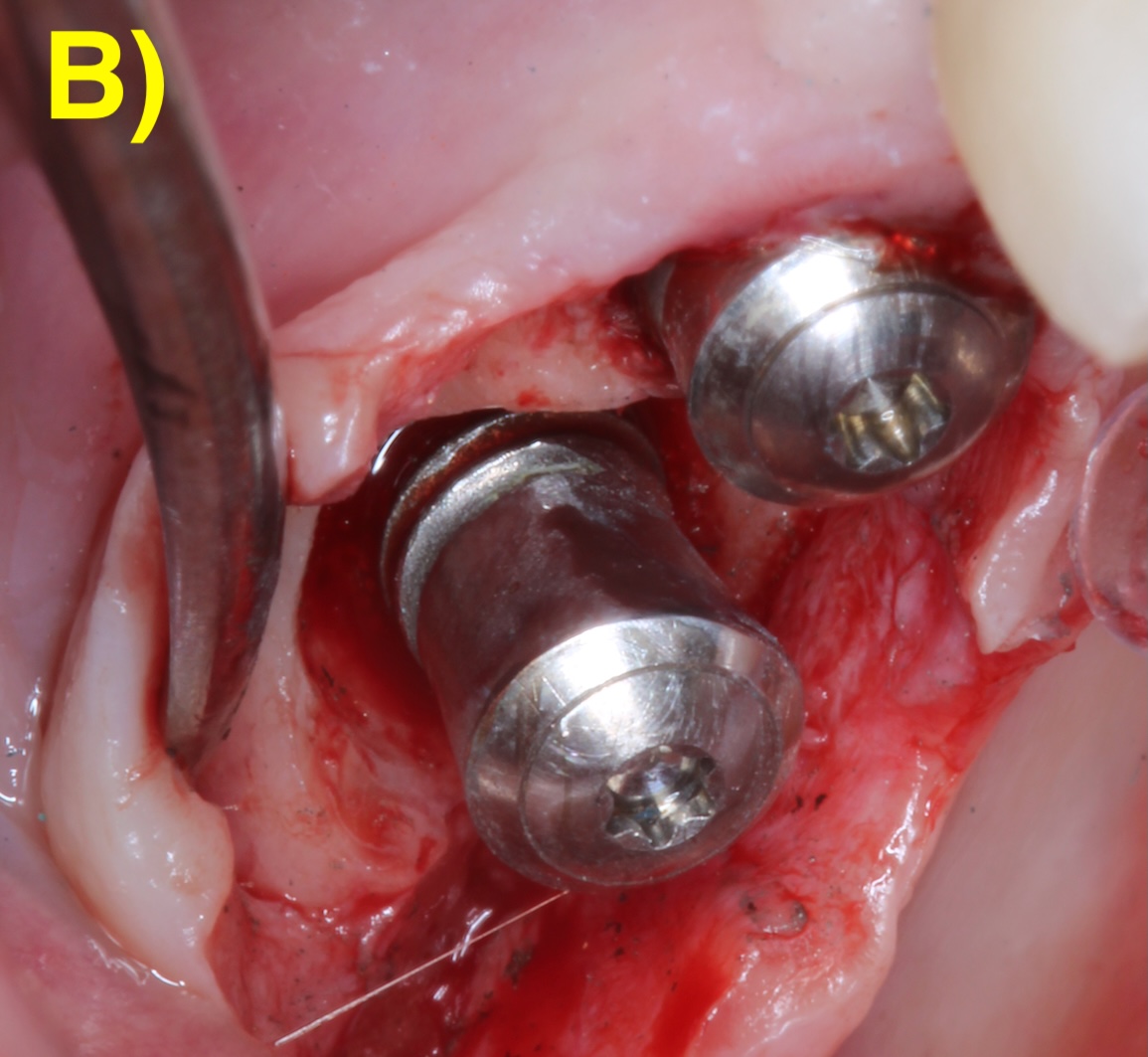
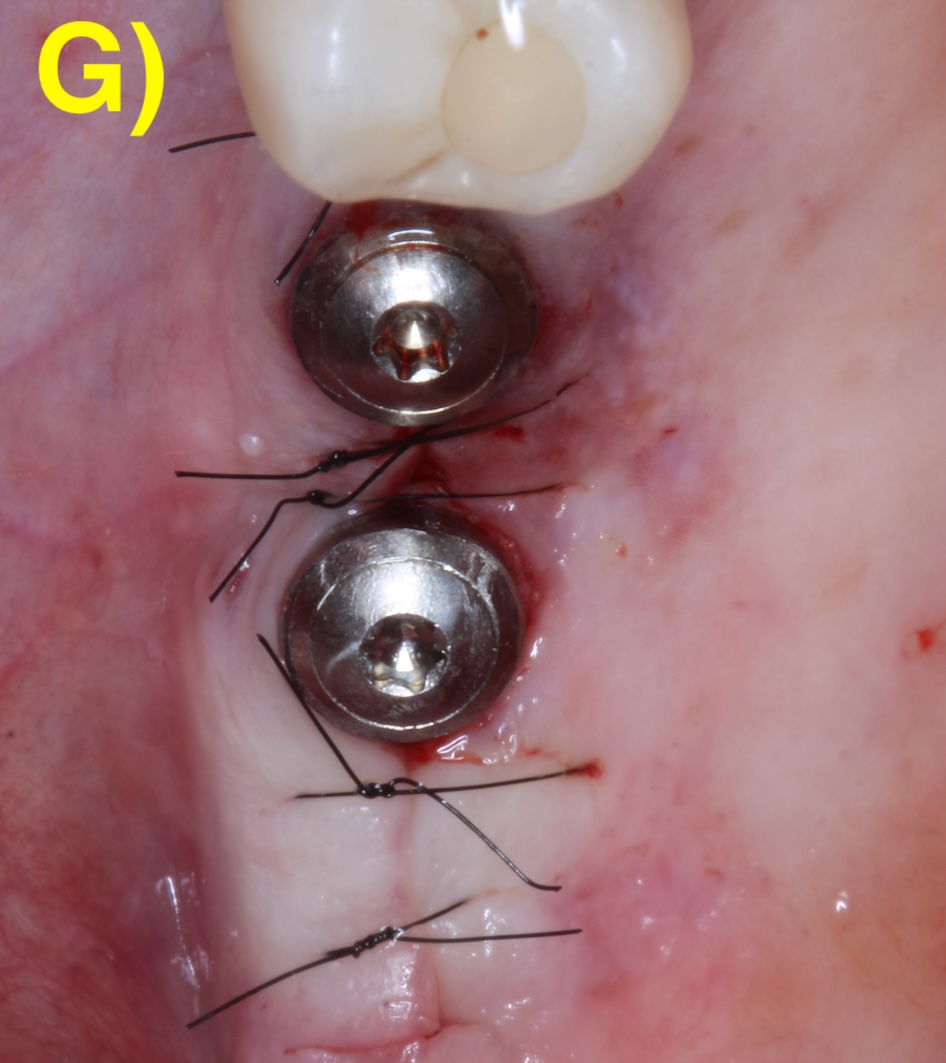
Dans certains cas, seulement une partie du défaut est régénérable. Une thérapie chirurgicale combinée qui intègre alors les principes de la régénération sur la portion infra-osseuse et une implantoplastie (lissage de la surface rugueuse de l’implant) sur la partie supra-osseuse non-régénérable (Monje & Schwarz, 2022) (Figure 6).
Figure 6 : thérapeutique chirurgicale combinée. A) Situation après le débridement du tissu de granulation. Notez les dépôts sur la surface de l’implant. B) Situation après l’implantoplastie. C – G) Régénération du défaut infra-osseux.
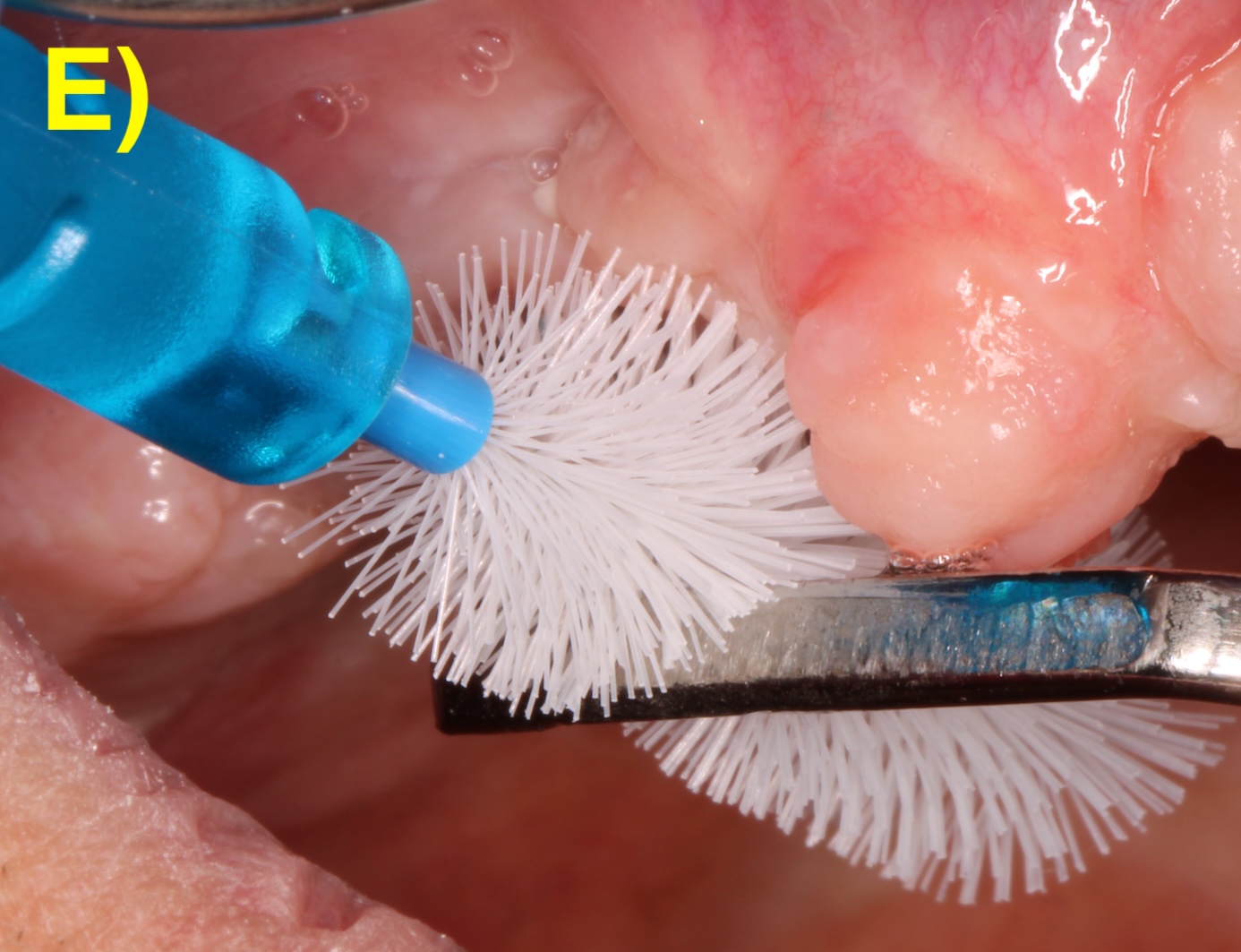
DÉCONTAMINATION DE LA SURFACE IMPLANTAIRE
Indépendamment de l’approche chirurgicale employée, la décontamination de la surface implantaire est une étape cruciale. Les implants peuvent présenter des surfaces lisses ou rugueuses, avec des morphologies variables influençant la difficulté de décontamination et par extension, la résolution des péri-implantites (Albouy et al., 2011). Ainsi, les implants avec une surface rugueuse présentent un risque accru de récidive 5 ans après le traitement chirurgical (Carcuac et al., 2020).
Plusieurs techniques de décontamination sont disponibles employant des méthodes mécaniques (comme les curettes, les ultrasons, les brosses en titane), photo (comme le laser) ou chimiques (comme la chlorhexidine ou le peroxyde d’hydrogène).
Toutefois, aucune méthode n’a montré de supériorité clinique sur le long terme à ce jour (Khoury et al., 2019). Les recommandations de la Fédération Européenne de Parodontologie suggèrent de ne pas utiliser le laser, l’aéropolisseur, la chlorhexidine ou la thérapie photodynamique dans la décontamination chirurgicale (Herrera et al., 2023).
En pratique clinique, une combinaison de méthodes physiques et chimiques est souvent utilisée pour maximiser l’efficacité.
RÉSULTATS CLINIQUES
L’évaluation du succès du traitement repose sur des indices composites. Une réévaluation clinique est recommandée à 6 mois et un bilan clinique et radiographique à 12 mois. Les critères de succès incluent (Herrera et al., 2023) :
• profondeur de sondage réduite (≤ 5 mm)
• absence de suppuration
• un seul site ponctuel de saignement maximal
• absence de perte osseuse progressive.
Toutes les techniques chirurgicales permettent de stabiliser la maladie et de réduire les poches parodontales et le saignement (Herrera et al., 2023).
Toutefois, les techniques régénératives offrent un meilleur remplissage osseux radiographique (Donos et al., 2023) et générent moins de récessions muqueuses post-opératoires (Derks et al., 2022), ce qui les rend préférables dans le secteur esthétique pour avoir une meilleure préservation des tissus. À l’inverse, les approches résectives ont entraîné des récessions plus importantes (Sanz-Martin et al., 2021).
Les taux de réussite (entendus comme l’absence de saignement, de suppuration, de poches profondes et de perte osseuse progressive) du traitement chirurgical des péri-implantites restent modestes (14 – 35 %) (Donos et al., 2023) et la récidive touche jusqu’à 44 % des implants traités (Carcuac et al., 2020). Néanmoins, la majorité des patients conservent leurs implants sur le long terme (76 – 100 % d’implants à 5 ans) à condition d’un suivi rigoureux (Roccuzzo et al., 2018).
Cette thérapie de maintien, avec un détartrage au minimum deux fois par an et une réévaluation clinique annuelle, est essentielle pour prévenir les récidives (Herrera et al., 2023), qui affectent environ 14 % des cas après 5 ans malgré le suivi (Heitz- Mayfield et al., 2018; Serino et al., 2015). Par conséquent, on doit s’attendre à ce que quelques patients aient besoin de traitements additionnels lors du suivi, tels qu’une réintervention ou un aménagement des tissus mous péri-implantaires, et que dans certains cas, une perte implantaire survienne (Donos et al., 2023; Roccuzzo et al., 2018).
CONCLUSION
Le traitement chirurgical constitue une approche efficace dans la prise en charge des péri-implantites. Toutefois, il doit toujours être précédé d’un diagnostic approfondi et d’un débridement non-chirurgical. Lorsqu’il est associé à un suivi de maintenance rigoureux, il permet de préserver la majorité des implants sur le long terme tout en limitant le risque de récidive.
BIBLIOGRAPHIE
Aghazadeh, A., Persson, R. G., & Renvert, S. (2020). Impact of bone defect morphology on the outcome of reconstructive treatment of peri-implantitis. Int J Implant Dent, 6(1), 33. https://doi.org/10.1186/s40729-020-00219-5
Albouy, J. P., Abrahamsson, I., Persson, L. G., & Berglundh, T. (2011). Implant surface characteristics influence the outcome of treatment of peri-implantitis: an experimental study in dogs. J Clin Periodontol, 38(1), 58-64. https://doi.org/10.1111/j.1600-051X.2010.01631.x
Berglundh, T., Armitage, G., Araujo, M. G., Avila-Ortiz, G., Blanco, J., Camargo, P. M., Chen, S., Cochran, D., Derks, J., Figuero, E., Hammerle, C. H. F., Heitz-Mayfield, L. J. A., Huynh-Ba, G., Iacono, V., Koo, K. T., Lambert, F., McCauley, L., Quirynen, M., Renvert, S.,…Zitzmann, N. (2018). Peri-implant diseases and conditions: Consensus report of workgroup 4 of the 2017 World Workshop on the Classification of Periodontal and Peri-Implant Diseases and Conditions. J Periodontol, 89 Suppl 1, S313-S318. https://doi.org/10.1002/JPER.17-0739
Blanco, C., Pico, A., Dopico, J., Gandara, P., Blanco, J., & Linares, A. (2022). Adjunctive benefits of systemic metronidazole on non-surgical treatment of peri-implantitis. A randomized placebo-controlled clinical trial. J Clin Periodontol, 49(1), 15-27. https://doi.org/10.1111/jcpe.13564
Carcuac, O., Derks, J., Abrahamsson, I., Wennstrom, J. L., & Berglundh, T. (2020). Risk for recurrence of disease following surgical therapy of peri-implantitis-A prospective longitudinal study. Clin Oral Implants Res, 31(11), 1072-1077. https://doi.org/10.1111/clr.13653
de Waal, Y. C., Raghoebar, G. M., Meijer, H. J., Winkel, E. G., & van Winkelhoff, A. J. (2016). Prognostic indicators for surgical peri-implantitis treatment. Clin Oral Implants Res, 27(12), 1485-1491. https://doi.org/10.1111/clr.12584
Derks, J., Ortiz-Vigon, A., Guerrero, A., Donati, M., Bressan, E., Ghensi, P., Schaller, D., Tomasi, C., Karlsson, K., Abrahamsson, I., Ichioka, Y., Dionigi, C., Regidor, E., & Berglundh, T. (2022). Reconstructive surgical therapy of peri-implantitis: A multicenter randomized controlled clinical trial. Clin Oral Implants Res, 33(9), 921-944. https://doi.org/10.1111/clr.13972
Derks, J., Schaller, D., Hakansson, J., Wennstrom, J. L., Tomasi, C., & Berglundh, T. (2016). Peri-implantitis – onset and pattern of progression. J Clin Periodontol, 43(4), 383-388. https://doi.org/10.1111/jcpe.12535
Donos, N., Calciolari, E., Ghuman, M., Baccini, M., Sousa, V., & Nibali, L. (2023). The efficacy of bone reconstructive therapies in the management of peri-implantitis. A systematic review and meta-analysis. J Clin Periodontol, 50 Suppl 26, 285-316. https://doi.org/10.1111/jcpe.13775
Figuero, E., Graziani, F., Sanz, I., Herrera, D., & Sanz, M. (2014). Management of peri-implant mucositis and peri-implantitis. Periodontol 2000, 66(1), 255-273. https://doi.org/10.1111/prd.12049
Heitz-Mayfield, L. J. A., Salvi, G. E., Mombelli, A., Loup, P. J., Heitz, F., Kruger, E., & Lang, N. P. (2018). Supportive peri-implant therapy following anti-infective surgical peri-implantitis treatment: 5-year survival and success. Clin Oral Implants Res, 29(1), 1-6. https://doi.org/10.1111/clr.12910
Herrera, D., Berglundh, T., Schwarz, F., Chapple, I., Jepsen, S., Sculean, A., Kebschull, M., Papapanou, P. N., Tonetti, M. S., Sanz, M., participants, E. F. P. w., & methodological, c. (2023). Prevention and treatment of peri-implant diseases-The EFP S3 level clinical practice guideline. J Clin Periodontol, 50 Suppl 26, 4-76. https://doi.org/10.1111/jcpe.13823
Khoury, F., Keeve, P. L., Ramanauskaite, A., Schwarz, F., Koo, K. T., Sculean, A., & Romanos, G. (2019). Surgical treatment of peri-implantitis – Consensus report of working group 4. Int Dent J, 69 Suppl 2(Suppl 2), 18-22. https://doi.org/10.1111/idj.12505
Lagervall, M., & Jansson, L. E. (2013). Treatment outcome in patients with peri-implantitis in a periodontal clinic: a retrospective study. J Periodontol, 84(10), 1365-1373. https://doi.org/10.1902/jop.2012.120555
Lee, C. T., Huang, Y. W., Zhu, L., & Weltman, R. (2017). Prevalences of peri-implantitis and peri-implant mucositis: systematic review and meta-analysis. J Dent, 62, 1-12. https://doi.org/10.1016/j.jdent.2017.04.011
Martin-Cabezas, R., & Giannopoulou, C. (2024). Residual bone level as a prognostic factor in the surgical treatment of peri-implantitis. Front Dent Med, 5(1532094). https://doi.org/doi: 10.3389/fdmed.2024.1532094
Monje, A., & Nart, J. (2022). Management and sequelae of dental implant removal. Periodontol 2000, 88(1), 182-200. https://doi.org/10.1111/prd.12418
Monje, A., Pons, R., Insua, A., Nart, J., Wang, H. L., & Schwarz, F. (2019). Morphology and severity of peri-implantitis bone defects. Clin Implant Dent Relat Res, 21(4), 635-643. https://doi.org/10.1111/cid.12791
Monje, A., & Schwarz, F. (2022). Principles of Combined Surgical Therapy for the Management of Peri-Implantitis. Clin Adv Periodontics, 12(1), 57-63. https://doi.org/10.1002/cap.10186
Nart, J., Pons, R., Valles, C., Esmatges, A., Sanz-Martin, I., & Monje, A. (2020). Non-surgical therapeutic outcomes of peri-implantitis: 12-month results. Clin Oral Investig, 24(2), 675-682. https://doi.org/10.1007/s00784-019-02943-8
Polyzois, I. (2019). Treatment Planning for Periimplant Mucositis and Periimplantitis. Implant Dent, 28(2), 150-154. https://doi.org/10.1097/ID.0000000000000869
Regidor, E., Ortiz-Vigon, A., Romandini, M., Dionigi, C., Derks, J., & Sanz, M. (2023). The adjunctive effect of a resorbable membrane to a xenogeneic bone replacement graft in the reconstructive surgical therapy of peri-implantitis: A randomized clinical trial. J Clin Periodontol, 50(6), 765-783. https://doi.org/10.1111/jcpe.13796
Renvert, S., & Polyzois, I. (2018). Treatment of pathologic peri-implant pockets. Periodontol 2000, 76(1), 180-190. https://doi.org/10.1111/prd.12149
Roccuzzo, M., Layton, D. M., Roccuzzo, A., & Heitz-Mayfield, L. J. (2018). Clinical outcomes of peri-implantitis treatment and supportive care: A systematic review. Clin Oral Implants Res, 29 Suppl 16, 331-350. https://doi.org/10.1111/clr.13287
Roos-Jansaker, A. M., Persson, G. R., Lindahl, C., & Renvert, S. (2014). Surgical treatment of peri-implantitis using a bone substitute with or without a resorbable membrane: a 5-year follow-up. J Clin Periodontol, 41(11), 1108-1114. https://doi.org/10.1111/jcpe.12308
Sanz-Martin, I., Cha, J. K., Sanz-Sanchez, I., Figuero, E., Herrera, D., & Sanz, M. (2021). Changes in peri-implant soft tissue levels following surgical treatment of peri-implantitis: A systematic review and meta-analysis. Clin Oral Implants Res, 32 Suppl 21, 230-244. https://doi.org/10.1111/clr.13840
Schwarz, F., Derks, J., Monje, A., & Wang, H. L. (2018). Peri-implantitis. J Periodontol, 89 Suppl 1, S267-S290. https://doi.org/10.1002/JPER.16-0350
Serino, G., Turri, A., & Lang, N. P. (2015). Maintenance therapy in patients following the surgical treatment of peri-implantitis: a 5-year follow-up study. Clin Oral Implants Res, 26(8), 950-956. https://doi.org/10.1111/clr.12418
Sinjab, K., Garaicoa-Pazmino, C., & Wang, H. L. (2018). Decision Making for Management of Periimplant Diseases. Implant Dent, 27(3), 276-281. https://doi.org/10.1097/ID.0000000000000775