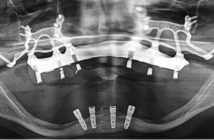
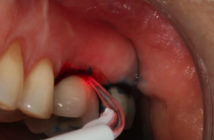
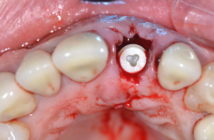
De nombreuses techniques d’augmentation osseuse, à la fois verticale et horizontale, existent. Les greffes osseuses, autogènes ou avec utilisation de biomatériaux et la régénération osseuse guidée avec mise en place de membranes sont fréquemment utilisées. Les techniques d’expansion, de distraction ou d’ostéotomies osseuses sont des alternatives intéressantes aux greffes et aux ROG. Dans certains cas, une combinaison de différents types de traitements sur un même site permet de trouver une réponse crédible et prévisible aux déficits osseux à gérer (Bravi et al. 2007).
L’expansion osseuse a été initialement développée par Tatum H. en 1979 et a été reprise par de nombreux auteurs. Elle peut être obtenue par différents moyens : certaines expansions sont réalisées à l’aide d’ostéotomes afin d’obtenir une condensation osseuse. (Summers 1994, Siddiqui et al. 2006, Demarosi et al. 2009, Nishioka et al. 2009), d’autres auteurs proposent des systèmes d’expansion avec activation progressive sur plusieurs jours ce qui les rend assimilables à une distraction osseuse, décrite parallèlement dans ce numéro (Chiapasco et al. 2006, Zahrani 2007, Yamauchi et al. 2008 et 2009).
L’expansion alvéolaire par clivage est une technique chirurgicale pré-implantaire qui consiste en un élargissement des crêtes alvéolaires dans le sens transversal. Elle peut être pratiquée aussi bien au maxillaire qu’à la mandibule lorsque la crête est étroite mais la hauteur suffisante (Basa et al. 2004).
Idéalement une largeur de crête de 3 mm est nécessaire (présence d’os spongieux) pour permettre un clivage aisé des deux tables osseuses. Néanmoins des clivages beaucoup plus fins sont rendus possibles par l’usage des piezotomes et l’apport complémentaire de ROG. L’expansion par clivage peut être assimilée à une fracture en bois vert. Il est donc intéressant d’étudier la cicatrisation des fractures en traumatologie afin de mieux comprendre les mécanismes biologiques qui vont se mettre en place lors de la cicatrisation d’une crête alvéolaire expansée et l’osteo-intégration des implants posés dans le cadre de cette intervention. L’intérêt d’une telle technique est sa relative simplicité.
Elle permet, dans certains cas, d’éviter des greffes osseuses aux résultats variables (Basa et al. 2004). Elle évite le prélèvement d’os autogène qui nécessite un second site chirurgical, augmente la durée de l’intervention ainsi que celle de la cicatrisation.
Elle peut être réalisée simultanément à la pose d’implants, en 1 temps opératoire, et permet de diminuer parallèlement le temps de cicatrisation nécéssaire avant la pose de la prothèse implanto-portée.
Une seconde intervention chirurgicale est alors inutile dans ces cas ce qui permet de réduire le coût du traitement global.
A noter que cette expansion peut être réalisée avec ou sans lambeau de pleine épaisseur. Ce dernier cas impose l’usage de biomatériaux complémentaires et éventuellement de membrane, selon la nature du matériau utilisé.
En 1992, Simion et al. font état d’expansions maxillaires et mandibulaires, avec utilisation de membranes non résorbables et pose d’implants immédiats. La technique d’expansion est ainsi combinée aux principes de la régénération tissulaire guidée. Toujours en 1992, Pikos propose un protocole d’expansion alvéolaire avec pose d’implants différée et s’intéresse à la capacité des biomatériaux à maintenir l’espace au sein de la crête clivée.
En 1994, puis en 1999, Scipioni et al. publient leurs travaux. Ils s’intéressent aux taux de survie d’implants placés simultanément à l’expansion, principalement dans la région des incisives maxillaires, sans utiliser de matériaux de comblement. Le lambeau de demi-épaisseur est réalisé selon les recommandations de Tatum. Il favorise la vascularisation périostée et potentialise le processus de cicatrisation. L’espace inter-cortical s’assimile alors à un site d’extraction devant cicatriser sans comblement osseux et les taux de succès implantaires sont alors équivalents à ceux rencontrés dans les sites non augmentés.
L’expansion osseuse peut être combinée à un comblement sous-sinusien avec la pose d’implants simultanée (Duncan 1997 ; Bruschi et al. 1998).
Les inserts piézoélectriques sont utilisés dans certaines techniques de séparation crestale. Vercellotti décrit, en 2000, une expansion alvéolaire par ostéotomie fine à l’aide de piezotome, combinée à la mise en place d’un biomatériau ostéoconducteur, d’un gel de PRP (Platelet-Rich Plasma) autogène ainsi que d’une membrane de PRP.
Chiapasco et al. (2006) comparent les taux de succès et les taux de survie d’implants posés selon différentes techniques de régénération osseuse. L’expansion osseuse alvéolaire présente les taux de succès et de stabilité implantaire parmi les plus élevés des techniques d’augmentation.
En 2007, Bravi et al. publient une étude clinique rétrospective concernant 1 715 implants placés suivant un même protocole d’expansion alvéolaire sur une période de 10 ans. Pour ces auteurs, les résultats sont comparables, que les implants soient posés immédiatement ou lors d’un second temps opératoire. Cette technique est associée à un taux de survie implantaire élevé (Thomas 2008).
L’expansion comme décrite précédemment, répond aux règles de cicatrisation des fractures au niveau des berges osseuses latérales. Au niveau de la partie médiane, c’est un mécanisme de cicatrisation alvéolaire post-extractionnelle simple ou de ROG qui a lieu, selon que le caillot est le seul élément présent dans l’interstice médullaire ou que des biomatériaux y sont adjoints.
Afin de comprendre le mécanisme de cicatrisation des fractures, passons rapidement en revue certains points essentiels.
Formation embryologique
La formation des os, in utero, résulte de deux mécanismes : l’ossification enchondrale et l’ossification de membrane. L’ossification enchondrale concerne les os longs, les os de la base du crâne ainsi que l’extrémité articulaire de la mandibule. Lors de ce processus, un modèle cartilagineux croissant de façon continue est progressivement remplacé par de l’os immature puis lamellaire. L’ossification de membrane concerne les os de la voûte du crâne et de la face mais également la partie périostée des os longs et le corps de la clavicule. Il s’agit d’un phénomène par lequel le mésenchyme est directement remplacé par de l’os grâce à la fusion des divers centres d’ossification (Langman 2007). Le maxillaire est un os d’origine purement membraneuse. La mandibule se développe suivant une ossification mixte : membraneuse puis enchondrale.
La cicatrisation des fractures
La cicatrisation ou consolidation des fractures osseuses est un phénomène physiologique complexe particulier. Contrairement aux autres tissus, un processus de régénération a lieu, durant lequel un tissu osseux est néoformé, identique au tissu d’origine, sans engendrer une cicatrice fibreuse. L’os fracturé retrouve ainsi dans une large mesure sa structure et ses propriétés d’origine, même si la restauration complète de l’anatomie osseuse ne survient que chez l’enfant.
La cicatrisation osseuse dépend de 3 facteurs :
- la présence de cellules appropriées. Ces cellules peuvent être déjà présentes sur le site ou vont devoir être recrutées
- la nutrition de ces cellules (vascularisation)
- la présence de stimuli pour l’activation de ces cellules.
Les différents modes de cicatrisation osseuse
Histologiquement, le processus de cicatrisation d’une fracture peut survenir de deux façons différentes. La cicatrisation osseuse « primaire » ou « directe » consiste en une formation directe d’os à partir de l’os cortical afin de rétablir une continuité mécanique. Ce type de cicatrisation n’a lieu que si une fixation rigide interne est mise en place. Il n’y a pas de formation de cal osseux (Tsiridis et al. 2007).
La cicatrisation osseuse « secondaire » ou « indirecte » concerne la majorité des fractures. Il s’agit d’une combinaison de formation osseuse membraneuse et enchondrale. Il y a formation d’un cal osseux à partir du périoste et des tissus mous adjacents à la fracture. Ce type de cicatrisation est favorisé par les micromouvements présents entre les extrémités de la fracture qui favorisent l’afflux sanguin et inhibé par une fixation rigide.
Comme toute réparation tissulaire, la cicatrisation d’une fracture osseuse débute immédiatement après la fracture par une phase d’inflammation. Il se forme un hématome fracturaire avec un caillot, du fait de la rupture des vaisseaux endomédullaires.
L’hématome revêt une grande importance dans la consolidation des fractures (Meyrueis et al. 2004), en servant de source de molécules de signalisation capables d’initier les cascades d’événements cellulaires nécessaires à la réparation de la fracture (Einhorn 1998).
Les séquences principales de la cicatrisation se résument ainsi :
- fracture
- inflammation : formation du tissu de granulation 0-48 heures
- 2e au 8e jour : formation d’un cal mou (fibro cartilagineux)
- jusqu’à la 4e semaine : transformation du cal mou.
Les cellules mésenchymateuses prolifèrent et se différencient en chondroblastes sous l’action des sollicitations mécaniques - 4 à 5 semaines après la fracture. Sous l’action de chondrocytes hypertrophiques, le cal mou se minéralise, des capillaires se développent à partir des tissus voisins et vont apporter des chondroclastes et ostéoclastes. Ces cellules vont peu à peu résorber la matrice cartilagineuse
- les ostéoblastes suivent la croissance des capillaires et vont élaborer la matrice ostéoïde qui va se minéraliser
- de la 4e semaine à 3 mois : ossification du cal fibreux et néoformation osseuse périostée, médullaire et des corticales adjacentes.
Cas clinique
Nous nous intéresserons dans ces cas cliniques à des expansions mandibulaires, qui présentent des caractéristiques particulières comparées au maxillaire : en effet, un lambeau décalé ne peut avoir lieu et la faible élasticité de l’os cortical mandibulaire ne permet pas une prédictibilité de la localisation de la fracture « en aveugle ». Il est par conséquent nécessaire de contrôler la propagation de la fracture.
La technique d’ostéotomie initiale sans pose d’implant en vue d’une réentrée sans lambeau dans un second temps est un non-sens chirurgical. Tout lambeau entraîne une ischémie et un remodelage et le fait de poser les implants en second temps sans lambeau ne change rien au remodelage déjà initié.
Par conséquent la technique la plus prévisible à notre sens à la mandibule est une ostéotomie contrôlée qui permet un clivage graduel. La stabilisation de l’expansion est assurée par une vis latérale transcorticale.
Discussion
L’expansion osseuse alvéolaire est une technique prévisible et répétitive. La méthodologie rigoureuse doit aboutir à un guidage précis des zones de clivage de façon à rendre possible la pose d’implants simultanée avec une forte prédictibilité. La discussion de lever ou non un lambeau est de mise au maxillaire. En effet, la faible densité de cet os maxillaire permet de supposer un remodelage plus important de l’os manipulé. En l’état de la littérature, rien ne permet de prévaloir à ce stade de la supériorité d’une approche plutôt qu’une autre.
A la mandibule, la forte densité de l’os cortical complique le clivage. A notre sens, une maîtrise de l’acte chirurgical est préférable à la technique en aveugle du fait de cette caractéristique. De plus, cet os cortical est réputé peu résorbable et dans un contexte d’atrophie, sa densité est augmentée. Par conséquent, lever ou non un lambeau ne semble pas influer sur la résorption de ce mur vestibulaire, à condition que la fixité et l’étanchéité puissent être assurées.
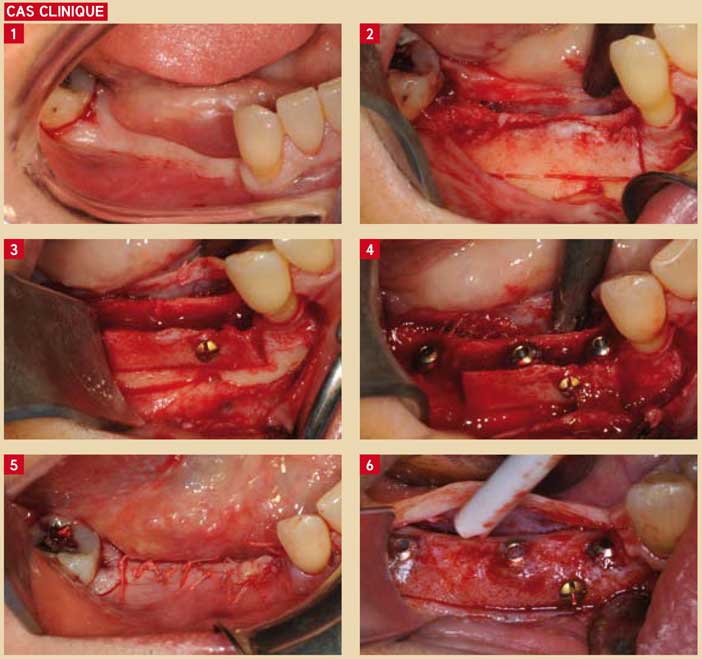
Fig. 1 : aspect caractéristique d’une crête atrophiée, maigre bandeau de gencive kératinisée Fig. 2 : lambeau de pleine épaisseur, faible largeur crestale de l’ordre de 2 à 3 mm Fig. 3 : ostéotomie précise crestale et de décharge permettant de guider précisément le trait de fracture. Clivage terminal maintenu en volume par un vissage bicortical Fig. 4 : pose des implants dans l’espace ménagé et comblement par biomatériaux allogéniques Fig. 5 : sutures passives et étanches du site Fig. 6 : ré-entrée à 4 mois : noter la reconstitution complète et la bonne vascularisation du nouveau volume créé
Bibliographie
1. A Basa S, Varol A, Turker N. Alternative bone expansion technique for immediate placement of implants in the edentulous posterior mandibular ridge: a clinical report. Int J Oral Maxillofac Implants. 2004 Jul-Aug;19(4):554-8.
2. Bravi F, Bruschi GB, Ferrini F. A 10-year multicenter retrospective clinical study of 1715 implants placed with the edentulous ridge expansion technique. Int J Periodontics Restorative Dent. 2007 Dec;27(6):557-65.
3. Bruschi, G.B., Scipioni, A., Calesini, G. & Bruschi,E. Localized management of sinus floor with simultaneous implant placement: a clinical report. International Journal of Oral & Maxillofacial Implants. 1998 ; 13: 219–226.
4. Chiapasco M, Ferrini F, Casentini P, Accardi S, Zaniboni M. Dental implants placed in expanded narrow edentulous ridges with the Extension Crest device. A 1-3-year multicenter follow-up study. Clin Oral Implants Res. 2006 Jun;17(3):265-72.
5. Chiapasco M, Zaniboni M, Boisco M. Augmentation procedures for the rehabilitation of deficient edentulous ridges with oral implants. Clin Oral Implants Res 2006;17(Suppl. 2):136–59.
6. Demarosi F, Leghissa GC, Sardella A, Lodi G, Carrassi A. Localised maxillary ridge expansion with simultaneous implant placement: A case series. Br J Oral Maxillofac Surg. 2009 Jan 14. Volume 47, Issue 7, October 2009, Pages 535-540
7. Duncan JM, Westwood RM. Ridge widening for the thin maxilla: a clinical report. Int J Oral Maxillofac Implants. 1997 Mar-Apr;12(2):224-7.
8. Nishioka RS, Souza FA. Bone spreader technique: a preliminary 3-year study. J Oral Implantol. 2009;35(6):289-94.
9. Nishioka RS, Souza FA. Bone spreading and standardized dilation of horizontally resorbed bone: technical considerations. Implant Dent. 2009 Apr;18(2):119-25.
10. Pikos MA. Buccolingual expansion of the maxillary ridge. Dent Implantol Update. 1992 Nov;3(11):85-7.
11. Scipioni A, Bruschi GB, Calesini G, Bruschi E, De Martino C. Bone regeneration in the edentulous ridge expansion technique: histologic and ultrastructural study of 20 clinical cases. Int J Periodontics Restorative Dent. 1999 Jun;19(3):269-77.
12. Scipioni A, Bruschi GB, Calesini G. The edentulous ridge expansion technique: a 5-year study. Int J Periodontics Restorative Dent. 1994 Oct;14(5):451-9.
13. Siddiqui AA, Sosovicka M. Lateral bone condensing and expansion for placement of endosseous dental implants: a new technique. J Oral Implantol. 2006;32(2):87-94.
14. Simion M, Baldoni M, Zaffe D. Jawbone enlargement using immediate implant placement associated with a split-crest technique and guided tissue regeneration. Int J Periodontics Restorative Dent 1992;12(6):462–73.
15. Summers RB. A new concept in maxillary implant surgery: the osteotome technique. Compendium 1994;15:152, 154-6, 158 passim; quiz 162.
16. Thomas MV. The edentulous ridge expansion technique is associated with high rate of implant survival. J Evid Based Dent Pract. 2008 Dec;8(4):223-4.
17. Vercellotti T. Piezoelectric surgery in implantology: a case report–a new piezoelectric ridge expansion technique. Int J Periodontics Restorative Dent. 2000 Aug;20(4):358-65.
18. Yamauchi K, Takahashi T, Funaki K, Miyamoto I, Yamashita Y. Implant placement for periosteal expansion osteogenesis using beta-tricalcium phosphate block: an experimental study in dogs. Oral Surg Oral Med Oral Pathol Oral Radiol Endod. 2009 Dec;108(6):861-6. Epub 2009 Sep 17.
19. Yamauchi K, Takahashi T, Funaki K, Yamashita Y. Periosteal expansion osteogenesis using highly purified beta-tricalcium phosphate blocks: a pilot study in dogs. J Periodontol. 2008 Jun;79(6):999-1005.
20. Zahrani AA. Augmentation in two stages of atrophic alveolar bone prior to dental rehabilitation: a case report. J Contemp Dent Pract. 2007 Sep 1;8(6):57-63.