Dans les années 1950, Brånemark étudie la circulation sanguine et la cicatrisation osseuse. Pour observer ces phénomènes, il utilise des chambres optiques en titane insérées dans un péroné de lapin. Une fois l’expérimentation terminée, ces dispositifs s’avèrent difficiles à retirer. C’est à partir de ce constat qu’il décide d’utiliser le titane en chirurgie osseuse.
Le concept d’ostéointégration a été défini comme étant une “coaptation directe anatomique et fonctionnelle entre l’os vivant et la surface implantaire”.
Brånemark a ainsi montré qu’un implant en titane peut s’intégrer à l’os de façon permanente, c’est-à-dire que l’os vivant peut fusionner avec la couche d’oxyde de titane de l’implant de sorte que les deux ne puissent être séparés sans fracture de cette interface.
Dans les années 80, les prérequis pour l’obtention de l’ostéointégration et son maintien à long terme sont contraignants et font figure de dogme (mise en nourrice de l’implant, cicatrisation de 3 à 6 mois, conditions d’asepsie similaires à celles d’un bloc opératoire…).
L’évolution de nos connaissances sur la biologie de la cicatrisation, la modification de la forme et des états de surfaces implantaires, les protocoles chirurgicaux et les procédures de stérilisation ont permis de rendre la plupart de ces pré requis obsolètes.
La cicatrisation implique une cascade de processus biologiques à l’interface os-implant régulés par des facteurs de croissance et de différenciation relargués par les cellules sanguines activées. Une fois actif, le processus d’ostéointégration suit un programme biologiquement déterminé.
L’interaction des cellules sanguines avec l’implant influence la formation du caillot (Fig. 1). Le réseau de fibrine formé sert d’échafaudage à la migration des cellules ostéogéniques (ostéoconduction) et éventuellement à la différenciation de ces cellules (ostéoinduction). A compter du premier jour suivant l’implantation, les ostéoblastes et les cellules mésenchymateuses migrent et s’attachent à la surface implantaire formant une matrice ostéoide. Cet os immature va ensuite être remanié pendant plusieurs mois de sorte à former un os compact assez résistant pour supporter les forces occlusales (Fig. 2).
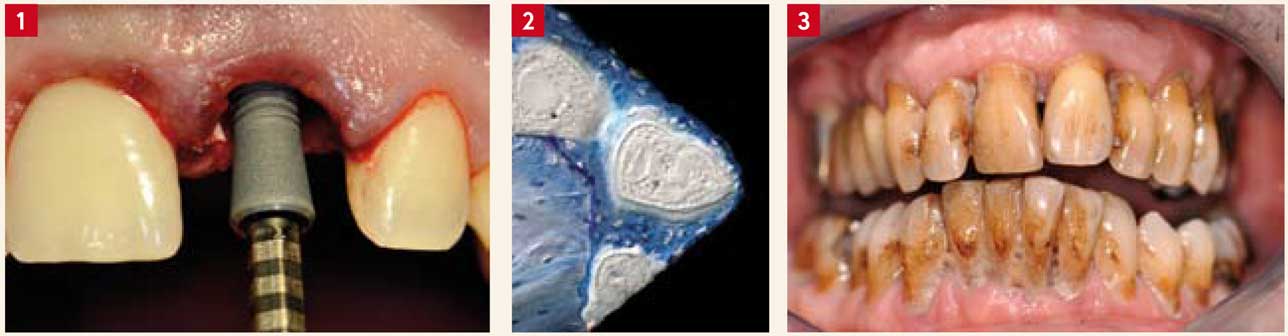
Fig. 1 : mise en place d’un implant Astra Tech. Le sang doit être le premier élément en contact avec l’implant. Fig. 2 : ostéointégration autour d’un implant Astra Tech. Fig. 3 : patient fumeur ayant une mauvaise hygiène dentaire. La mise en place d’implants est contre indiquée dans cette situation.
Les facteurs déterminant l’ostéointégration sont de 3 types
1. Les facteurs liés à l’hôte
L’état de santé du patient (affections cardio-vasculaires, affections endocriniennes…), les habitudes de vie (alcool, tabac…), la qualité et la quantité des tissus mous et des tissus durs doivent être analysés avec rigueur (Fig. 3).
La réponse osseuse autour d’un implant est différente en fonction du type d’os concerné. Il existe différentes classifications de la qualité osseuse, la plus utilisée étant celle proposée par Lekholm et Zarb en 1987.
Les auteurs distinguent quatre types osseux :
Type I : l’os est composé presque entièrement d’os cortical
Type II : l’os cortical assez large entoure un os spongieux assez dense
Type III : l’os cortical fin entoure un os spongieux assez dense
Type IV : l’os cortical fin entoure un os spongieux très poreux.
La stabilité primaire correspond à la stabilité immédiate de l’implant après sa mise en place chirurgicale. C’est un élément essentiel à la réussite du traitement qui dépend de différents facteurs, dont la qualité et la quantité osseuses, la forme et l’état de surface de l’implant, la technique chirurgicale… Différents instruments de mesure existent aujourd’hui pour évaluer cette stabilité en clinique. En fonction de la chronologie de traitement choisie (technique enfouie, mise en charge immédiate…), l’ancrage primaire devra être plus ou moins important. Cette stabilité mécanique initiale diminue progressivement pour être remplacée par une stabilité biologique (ostéointégration).
L’os dense de type I assure généralement une meilleure stabilité primaire que l’os de type III et IV, cependant, l’os plus spongieux présente un temps de réparation plus court. Cette classification repose sur des analyses histologiques peu appropriées à la clinique. D’autres classifications plus cliniques ont donc été proposées, Misch (1990) décrit 4 densités osseuses (D1 à D4) avec leur localisation dans les maxillaires, et Trisi et Rao (1999) proposent une classification reposant sur la sensation clinique lors du forage.
2. Les facteurs liés à l’implant Matériau
Le titane commercialement pur est aujourd’hui le matériau le mieux adapté (du fait de ses propriétés mécaniques, biocompatibilté…) et le plus documenté.
Forme de l’implant
La forme de l’implant est aussi un facteur essentiel à l’ostéointégration car elle permet d’optimiser la stabilité primaire et la répartition des contraintes dans le tissu osseux. C’est ainsi que les formes implantaires ont évolué. Initialement de formes cylindriques, les implants deviennent plus effilés à la pointe (coniques).
O’sullivan and coll. (2003) ont comparé la stabilité d’implants cylindriques standards et d’implants plus coniques. Les résultats montrent que les implants plus coniques de 1° que le standard ont une meilleure stabilité primaire (mesurée par la technique RFA et par la technique de résistance au retrait). En plus de la forme générale de l’implant, le col (droit, évasé…), les spires (nombre, orientation, espacement), l’apex, la longueur et le diamètre de l’implant contribuent à optimiser les résultats cliniques.
Etat de surface
Kasemo et Lausmaa, dans le chapitre « Sélection du métal et caractéristiques de surface » du livre de Brånemark et coll (1985) énoncent : « la rugosité de surface des implants aura des conséquences différentes selon la dimension géométrique impliquée.
Une surface rugueuse ou poreuse peut être avantageuse, car d’un point de vue mécanique, elle permet la bonne répartition des forces. La rugosité peut influencer la biologie de l’interface, car à partir du moment où la valeur de la courbe des rugosités correspond à la taille des cellules et des grosses macromolécules, ces dernières peuvent pénétrer dans la zone concernée. »
Il est aujourd’hui clairement admis que les surfaces rugueuses présentent de nombreux avantages par rapport aux surfaces usinées : la formation de tissu osseux est plus précoce, le remodelage osseux plus rapide et le pourcentage de contact os/implant plus important (Fig. 4).
L’obtention d’état de surface rugueux peut se faire selon différents procédés, par addition (revêtement titane, hydroxyapatite), et par soustraction physique ou chimique (sablage, mordançage, oxydation électrolytique).
Différentes études des années 1990, ont montré une bonne cicatrisation primaire grâce à l’addition d’une couche d’hydroxyapatite sur le titane. Mais les excellents résultats de départ ont été ternis sur le long terme, plusieurs auteurs ayant relevé une perte de l’os péri-implantaire et un important taux d’échec directement lié à une érosion du revêtement d’hydroxyapatite.
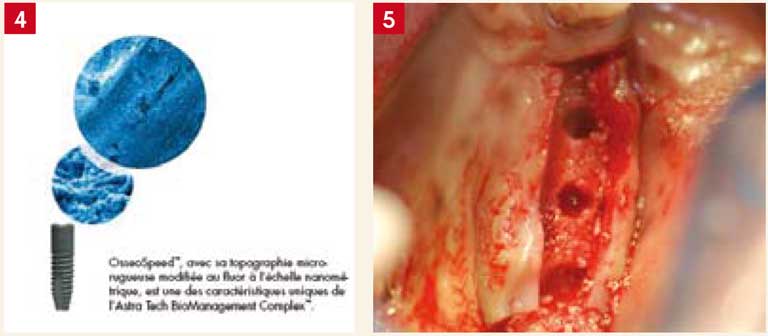
Fig. 4 : état de surface OsseoSpeed d’Astra Tech. Fig. 5 : les sites implantaires sont sous dimensionnés par rapport aux diamètres des implants.
3. La technique chirurgicale Asepsie
Brånemark préconisait une hygiène stricte pour la pose d’implant. Les connaissances sur les transmissions de l’infection se sont développées et certaines règles, comme l’établissement de circuits propres et sales ou la filtration de haut niveau de l’air ne sont pratiquement plus d’actualité.
La Haute Autorité de Santé a produit un rapport « Conditions de réalisation des actes d’implantologie orale : environnement technique » (www.has-sante.fr). Ce texte élaboré par un groupe d’experts de la profession, est un remarquable outil de travail. Il confirme que les chirurgies implantaires peuvent être effectuées dans une salle dédiée ou dans la salle de soins du cabinet dentaire, que l’incidence de la contamination aérienne est faible, etc. Il est important de le lire, l’éditer, et le conserver. Il constitue le référentiel sur lequel s’appuierait toute institution de contrôle.
Protocole de forage
Le respect du protocole de forage (vitesse de rotation, irrigation abondante, forets tranchants et de diamètre croissant) permet de limiter le traumatisme au niveau du site implantaire et donc la zone de nécrose osseuse.
Technique chirurgicale
Le chirurgien dispose aujourd’hui de différentes techniques chirurgicales permettant d’optimiser la stabilité primaire (sous forage, absence de taraudage, ostéotome…) et donc les chances d’ostéointégration (Fig. 5).
Chronologie implantaire
Dans les années 80, le Professeur Brånemark propose dans le but d’augmenter le taux de succès des implants un protocole en deux temps chirurgicaux basé sur les principes suivants :
- enfouissement de l’implant
- mise en fonction après 4 à 6 mois de cicatrisation.
Ce protocole dit conventionnel a fait ses preuves, et présente des taux de succès et un recul clinique importants. Cependant il présente certains inconvénients comme une durée de traitement plus longue (7 à 9 mois) et la multiplication des interventions chirurgicales.
Parallèlement, le Professeur Schroder développe un implant non enfoui, dit en un seul temps chirurgical. La cicatrisation osseuse et des tissus mous se fait en même temps (durée de traitement globale 5 à 7 mois). Ce type d’implant présente les mêmes taux de succès que les implants enfouis avec les avantages suivants :
- simplification du protocole chirurgical
- réduction du nombre d’interventions
- amélioration du confort pour le patient.
Cette technique présente cependant quelques inconvénients, comme un éventuel compromis esthétique du fait de la cicatrisation aléatoire des tissus mous et de la difficulté de temporisation (risque de compression importante de l’implant en cas de port d’une prothèse amovible) (Fig. 6).
Des évolutions précédemment citées (états de surface, forme de l’implant…) découle ce qu’on appelle le protocole de mise en charge rapide. Ce protocole consiste en la mise en place d’un implant en un temps chirurgical et une cicatrisation osseuse de 8 semaines ce qui entraîne un temps de traitement global de 3 mois.
Toujours dans cette optique de gain de temps et de confort pour le patient, est apparu le protocole de mise en charge immédiate. Initialement réservé aux édentements complets mandibulaires, ce protocole implique de respecter certains critères permettant de limiter les micromouvements pendant la phase d’ostéointégration.
Ces critères sont les suivants :
- longueur des implants au moins égale à 10 mm
- implants à surface rugueuse
- stabilité primaire supérieure à 35 Ncm
- nombre d’implants importants et répartis de manière stratégique
- prothèse transitoire avec armature rigide
- alimentation liquide ou semi liquide pendant 6 à 8 semaines.
L’évolution du protocole de mise en charge immédiate permet la réalisation de restaurations provisoires en sous occlusion pour les édentements unitaires ou pluraux localisés au secteur antérieur. La stabilité primaire de l’implant et la non sollicitation de la restauration provisoire sont des facteurs essentiels à la réussite de traitement.
La validation de l’ostéointégration se fait généralement de manière clinique et radiologique selon des critères édictés par Albrektsson (1986). Ces facteurs sont encore d’actualité (absence de mobilité, absence de signe d’infection visible cliniquement et radiologiquement, absence de douleur à la percussion…).
Cependant, le critère concernant la perte osseuse marginale (inférieure à 1,5 mm durant la première année de mise en fonction puis inférieure à 0,2 mm par an) doit être remis en question. En effet, les nouvelles formes implantaires, les états de surface rugueux, la fiabilité des connexions prothétiques, le “connective contour’’ ou “switching platform” permettent d’optimiser la cicatrisation osseuse, de raccourcir les temps de cicatrisation et de limiter la perte osseuse péri-implantaire.
Le maintien de l’ostéointégration dans le temps dépend de nombreux facteurs comme la conception, la précision d’adaptation et l’équilibration occlusale de la restauration prothétique (Fig. 7). La motivation et l’hygiène du patient sont essentielles à la stabilité des résultats. L’établissement de séances de maintenance permettra de préserver la stabilité tissulaire et d’intercepter toute complication péri-implantaire ou prothétique.
Fig. 6 : implants mis en 1 temps chirurgical. Les tissus mous cicatrisent autour des vis de cicatrisation en même temps que les tissus durs. Fig. 7 : une mauvaise conception prothétique associée à une occlusion anarchique peuvent entraîner une perte de l’ostéointégration.
Remerciements aux Drs Roland Zeitoun et Bernard Siksou pour leur amicale participation.
Bibliographie
1. Abrahamsson, I., and Berglundh, T. Tissue characteristics at microthreaded implants: an experimental study in dogs. Clin Impl Dent Rel Res 2006;8(3):107-113.
2. Albrektsson et al. The long-term efficacy of currently used dental implants: a review and proposed criteria of success. J Oral Maxillofac Implants 1986;1:11-25.
3. Albrektsson et al. Osseointegration of bone implants: Areview of an alternative mode of fixation. Acta Orthop. Scand. 58, 567-577, 1987.
4. Berglundh, T., et al. Bone healing at implants with a fluoridemodifi ed surface: an experimental study in dogs. Clin Oral Impl Res 2007;18:147-152.
5. Brånemark PI, Zarb GA, Albrektsson T. Tissue integrated protheses: osseointgration in clinical dentistry. Chicago: Quintescence publishing Company, 1985.
6. Davarpanah et al. Manuel d’implantologie clinique, 2 édition. Edition CdP.
7. Ellingsen, J-E. Pre-treatment of titanium implants with fluoride improves their retention in bone. J Mater Sci: Mater Med 1995;6:749- 753.
8. Martinez H, Renault P. Les implants: chirurgie et prothèse. Edition CdP.
9. Mavrogenis A.F et al. Biology of implant osseointegration. J Musculoskelet Neuronal Interact 2009;9(2):61-71.
10. O’Sullivan D, Senneby L, Meredith N. Measurement comparing the initial stability of five designs of dental implants: a human cdaver study. Clin Implant Dent Relat Res 2000; 2: 85-92.
11. Trisi P, Rao W. Bone classification: clinical-histomorphometric compariso.Clin Oral Implant Res 1999; 10: 1-7.