Face aux défis des reconstructions osseuses pré-implantaires, les allogreffes osseuses constituent aujourd’hui des biomatériaux incontournables dans l’arsenal thérapeutique du chirurgien. Le tissu osseux humain par sa composition et son architecture présente toutes les qualités requises pour assurer une ostéoconduction efficace doublée d’une tolérance tissulaire très satisfaisante. Les questions légitimes relatives à leur sécurité ont trouvé une réponse à travers un cadre réglementaire strict et la mise en œuvre de technologies modernes performantes. Dans le paysage des produits disponibles, il convient néanmoins de faire des distinctions, en allant au-delà du terme générique “d’allogreffe osseuse”, en s’intéressant à l’ensemble des mesures et procédés appliqués pour leur préparation. Les étapes qui aboutissent au produit qu’utilisera le chirurgien sont en effet très nombreuses et souvent méconnues. Sans faire de comparaison, il est pertinent de rappeler, à travers l’exemple de BIOBank, comment s’organise une banque d’os et quelles sont les caractéristiques et performances de son allogreffe osseuse.
Origine et sélection des tissus
La banque française de tissus osseux BIOBank propose depuis plus de dix ans une gamme d’allogreffes osseuses adaptées aux besoins de la chirurgie orthopédique et de la chirurgie pré-implantaire orale.
Les tissus traités par BIOBank sont des têtes fémorales prélevées sur des patients bénéficiant d’une arthroplastie de la hanche. A ce titre, le prélèvement des tissus est réalisé dans le cadre d’une intervention chirurgicale au bloc opératoire, garant d’une qualité et d’une asepsie optimales. Tous les prélèvements sont réalisés en France par des chirurgiens orthopédistes au sein d’établissements de santé agréés.

Ce type de prélèvements s’oppose à celui pratiqué sur donneurs décédés, que ce soit en morgue ou à l’occasion des prélèvements multi-organes (PMO). La stérilité du geste chirurgical de prélèvement est en effet garantie, l’organisation est simplifiée et l’abondance des dons assure un approvisionnement constant et régulier pour autant que le réseau d’établissements préleveurs soit bien géré.
Les tissus osseux collectés viennent alimenter la banque d’os. De l’autre côté, les demandes des chirurgiens greffeurs nécessitent qu’un “stock” de produits finis validés soit maintenu. Entre les deux, les étapes de sélection, de transformation et de stérilisation sont mises en œuvre et organisées pour optimiser la qualité du service proposé aux prescripteurs. C’est à ce titre, que BIOBank joue le véritable rôle d’une “banque de tissus”.
Organisation d’une banque de tissus
BIOBank assure l’activité complète d’une banque de tissus, de la prise en charge des tissus à la délivrance de greffons sécurisés. Ces opérations comprennent d’abord la sélection clinique des donneurs par le chirurgien préleveur et le dépistage biologique de maladies transmissibles. Vient ensuite la transformation proprement dite des tissus en greffons osseux par l’application d’un procédé de nettoyage, viro-inactivation et stérilisation. Toutes les opérations se font dans le respect du Code de la Santé Publique, des arrêtés et des Bonnes Pratiques des Banques de Tissus et Cellules du 27 octobre 2010. Tous ces textes transposent les Directives Européennes dans la réglementation française.
Comme pour toute banque de tissus, les activités de BIOBank font l’objet d’une autorisation délivrée par l’ANSM (Agence Nationale de Sécurité du Médicament). De même, les greffons osseux sont regroupés en familles selon leurs formes (anatomique, géométrique, granules, poudres, plaquettes) qui chacune bénéficie d’une autorisation de mise sur le marché.
Les tissus osseux prélevés bénéficient dès le départ d’une traçabilité unitaire organisée par BIOBank qui suivra le tissu et tous ses dérivés jusqu’à leur implantation chez les receveurs.
Transformation des greffons osseux
Difficultés de traitement du tissu osseux
Les greffons osseux allogéniques cryoconservés ont été largement et sont toujours utilisés en chirurgie orthopédique pour le traitement de gros défauts osseux, notamment lors des reprises d’arthroplastie de la hanche et du genou.
L’élargissement des indications vers les petits comblements osseux a favorisé le développement de techniques visant à proposer des formes adaptées. La chirurgie osseuse orale à visée implantaire constitue, de ce point de vue, un secteur d’utilisation des allogreffes en plein essor.
Diverses méthodes de traitement ont été développées, depuis la fin des années 1980, dans le but de dévitaliser le tissu osseux et le rendre propre aux trois propriétés essentielles attendues : sécurisation virale active validée (et non plus par la seule sélection des donneurs), conservation à température ambiante rendue possible par un état déshydraté et ostéo-conduction améliorée par le nettoyage des travées osseuses.
Dans les procédés classiques, un solvant organique fort (chloroforme ou acétone) est utilisé pour dégraisser le tissu osseux spongieux qui contient de nombreux adipocytes dans ses cavités médullaires. Cette fraction lipidique représente en effet près de 60 % en masse d’une tête fémorale après élimination du cartilage. Son élimination est rendue d’autant plus difficile que le réseau trabéculaire est dense et épais La présence d’une grande quantité de lipides entraîne de plus une mauvaise mouillabilité du tissu, empêchant ou gênant l’action des oxydants aqueux mis en œuvre ultérieurement pour assurer la viro-inactivation. Leur diffusion dans le tissu osseux est limitée, ce qui réduit leur capacité à garantir l’inactivation virale des fragments osseux de grandes dimensions comme les têtes fémorales entières.
Par ailleurs, l’utilisation de ces solvants dégraissants nécessite une phase d’élimination de la graisse dissoute qui passe notamment par des traitements physiques agressifs comme le jet d’eau sous pression ou la centrifugation. Ces solvants organiques peuvent en outre laisser des résidus toxiques indésirables s’ils sont mal éliminés.
Enfin, un autre inconvénient des solvants organiques pour le dégraissage du tissu osseux est leur efficacité relativement faible. Les résidus lipidiques après un traitement “classique” représentent encore 3 à 5 % de la masse du produit fini. La conséquence est une mouillabilité encore imparfaite qui freine l’ostéoconduction en gênant la vascularisation du greffon in situ.
Il est fondamental de considérer que l’élimination des graisses par un nettoyage approfondi du réseau trabéculaire osseux constitue la pierre angulaire de toutes les étapes ultérieures du traitement et un prérequis essentiel de l’ostéoconduction attendue par le chirurgien.
Une technologie innovante au dioxyde de carbone supercritique a ainsi été mise au point et développée pour être appliquée au tissu osseux humain sous le nom de procédé Supercrit®.
Figure 1 : Illustration de l’efficacité du procédé de BIOBank sur une tête fémorale avant (a) et après mise en oeuvre du procédé Supercrit® (b)
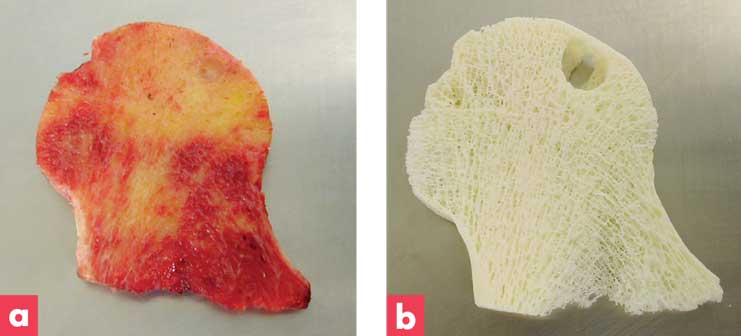
(a) tête fémorale congelée (b) tête fémorale traitée Supercrit®
Principe et mise en oeuvre du procédé Supercrit®
A contrario des procédés utilisant des solvants organiques forts, le procédé Supercrit® de BIOBank met en oeuvre un fluide non toxique, le CO2 à l’état supercritique, associée à une oxydation chimique des protéines résiduelles contenues dans les pores du tissu spongieux.
Dans son principe, au-delà d’une pression et d’une température critique, le CO2 n’est plus dans un état gazeux ou liquide, il est dans un autre état appelé fluide supercritique. Comme un liquide, il a une densité élevée et conserve un pouvoir solvant important. Comme un gaz, il a une très faible viscosité qui facilite sa diffusion dans les structures poreuses [1].
Ces deux propriétés, diffusion et pouvoir solvant élevés, rendent ce fluide très intéressant pour l’extraction de composés apolaires contenus dans une matrice poreuse tel que le tissu osseux spongieux. De plus, ses coordonnées supercritiques sont douces (pression critique 7,38 Mpa, température critique 31°C) et n’entraînent pas de dénaturation des protéines comme le collagène de l’os.
Les molécules non polaires comme les carbures d’hydrogène, les huiles et généralement tous les lipides sont solubles dans le CO2 à l’état supercritique. A l’inverse, les molécules polaires, les acides aminés et les protéines sont peu solubles. Cette dernière propriété est essentielle car elle préserve l’intégrité du collagène contenu dans le tissu osseux dont il représente environ 30 % en masse.
Grâce à l’efficacité du dégraissage, la mouillabilité du tissu osseux est totalement modifiée. Cela facilite la pénétration des produits chimiques aqueux qui sont ensuite appliqués pour assurer la viro-inactivation. Le temps nécessaire pour leur action est réduit, ce qui diminue les altérations de la trame osseuse et contribue à la meilleure préservation des propriétés mécaniques du tissu osseux.
Toutes les manipulations sur les tissus se déroulent dans un laboratoire spécialement étudié pour le traitement aseptique des tissus. L’environnement de travail est constitué de salles blanches à atmosphère contrôlée de classe C, d’une surface totale de 250 m2, équipées de matériels spécifiques de haute technicité. Un personnel formé et qualifié met en œuvre toutes les étapes du procédé Supercrit®.
Après nettoyage, séchage et conditionnement, l’obtention de l’état stérile est obtenue par irradiation aux rayons gamma à une dose stérilisante de 25 à 30 kGy sur les greffons préalablement protégés par un double emballage primaire. Comme pour les dispositifs médicaux implantables, la stérilisation par irradiation gamma est réalisée par un prestataire agréé et validée conformément aux normes EN 552 et ISO 11737-2. Outre son efficacité stérilisante et son fort pouvoir de pénétration, cette technique est classiquement retenue pour les allogreffes osseuses car elle ne provoque pas d’échauffement du matériau et ne génère pas de résidus toxiques.
A l’issue de la stérilisation terminale, une revue systématique des dossiers de production est réalisée par le Pharmacien Responsable de la banque de tissus. La validation finale autorise la distribution des greffons sur la base des prescriptions médicales nominatives émises par les praticiens, dans le respect de la réglementation.
Caractérisation in vitro et validation préclinique
Inactivation virale et stérilité
L’évaluation de l’inactivation virale a fait l’objet de deux études par le laboratoire Pasteur-Texcell. Les résultats prouvent l’efficacité des quatre étapes du procédé Supercrit® à inactiver les virus les plus résistants, y compris le parvovirus, et cela au cœur de la tête fémorale complète [2, 3, 4].
L’inactivation virale s’exprime par la capacité du traitement mis en œuvre à réduire une charge virale préalablement inoculée dans un fragment osseux. Les virus et le modèle osseux sont choisis pour représenter le cas le plus défavorable par rapport à une situation physiologique “naturelle”. Dans le cas des allogreffes osseuses, il est heureusement possible d’appliquer des traitements physico-chimiques très puissants car il n’est pas question de préservation cellulaire. La matrice osseuse est un tissu très résistant aux solvants oxydants virucides comme au rayonnement gamma. Les résultats obtenus dépassent largement 10-6 pour le seuil de sécurité requis appelé SAL (Safety Assurance Level). Dès lors, la question de la sécurité virale et de la stérilité peut être considérée comme réglée.
Cependant, l’agression excessive de la trame osseuse doit être évitée. Le procédé Supercrit® profite de l’efficacité de l’étape de dégraissage par le CO2 supercritique pour réduire la durée des étapes de trempage dans les solvants oxydants viro-inactivants.
C’est ce rapport efficacité/dégradation supérieur aux autres traitements qui caractérise le procédé Supercrit® par rapport aux autres traitements existants. Cela se traduit par des caractéristiques physico-chimiques et des propriétés biomécaniques préservées par rapport au tissu osseux frais.
Intégrité des caractéristiques du tissu osseux
Les différentes analyses biochimiques du tissu osseux après traitement Supercrit® démontrent la conservation de la composition minérale (Ca, P, Mg, Na) et organique (hydroxyproline, glycine, alanine et proline) des greffons qui reste identique au tissu osseux non traité.
L’efficacité du procédé aboutit à une réduction du taux de lipides de près de 60 % à moins de 0,5 % et une humidité résiduelle inférieure à 4 % autorisant une durée de conservation de 5 ans à température ambiante.
Mais la préservation de la matrice osseuse se traduit essentiellement dans le maintien des propriétés biomécaniques. Trois études ont été conduites pour évaluer l’influence du procédé Supercrit® sur les propriétés mécaniques du tissu osseux spongieux [6, 7, 8].
Différents procédés de traitement de l’os spongieux ont ainsi été comparés par analyse ultrasonore d’échantillons appariés avant et après traitement. Il ressort que le procédé Supercrit® est le procédé de viro-inactivation qui entraîne le moins d’effets sur l’élasticité du tissu osseux spongieux, confirmant ainsi sa capacité à mieux préserver les qualités structurales et architecturales de l’os [8].
Le maintien des propriétés mécaniques du tissu osseux est particulièrement pertinent pour les applications en chirurgie orthopédique. Il présente également un intérêt évident pour les blocs cortico-spongieux standards ou sur mesure utilisés dans les greffes d’apposition.
Utilisation clinique des allogreffes osseuses
Formes thérapeutiques et indications
Les greffons BIOBank se présentent sous des formes variées, adaptées aux différentes indications que rencontre le chirurgien pour reconstituer le capital osseux de ses patients.
Les poudres se déclinent en deux types de structure : os spongieux et os cortico-spongieux (os spongieux et os cortical dans un rapport 1:1). Cette dernière composition a pour but d’apporter une plus forte densité (environ 1,5 fois supérieure) qui ralentit le mécanisme de résorption. Cette propriété trouve son intérêt dans les situations où la poudre d’os est agressée, notamment par un contact important avec les muqueuses ou un contexte inflammatoire excessif.
Les blocs se présentent également sous deux formes. Les blocs spongieux pour le comblement pur et les plaquettes d’os cortico-spongieux pour les greffes d’apposition. Cette structure composite est rendue possible par l’architecture particulière et unique des allogreffes osseuses. La paroi corticale sous-chondrale est préservée lors de la préparation et combinée à un os spongieux particulièrement dense (Figure 2).
Cette double structure permet de proposer un biomatériau avec un intrados facilement adaptable au profil du lit osseux receveur et une paroi externe étanche à la pénétration des cellules conjonctives de la muqueuse. Ainsi protégée, la partie spongieuse va jouer son rôle ostéoconducteur et permettre la formation d’un os fonctionnel dans toute son épaisseur sans risque de résorption.

Figure 2 : Coupe d’une plaquette d’os cortico-spongieux au microscope électronique à balayage (x60)
Les allogreffes osseuses offrent ainsi une palette variée de produits qui se distinguent des produits synthétiques composés de phosphate tricalcique beta ou des produits d’origine animale composés d’hydroxyapatite pure (suite à un traitement thermique éliminant complètement la phase organique de l’os).
Dans les deux cas, la composition uniquement minérale oblige les fabricants à prédéterminer un comportement in situ qui ne peut correspondre à toutes les situations cliniques. Soit trop rapidement résorbés, soit ne l’étant quasiment jamais, leur métabolisation est difficilement appréhendable par le chirurgien.
De plus, les blocs macroporeux uniquement minéraux ne peuvent présenter une double composition à l’instar des plaquettes d’os cortico-spongieux. Ils doivent être obligatoirement associés à une membrane résorbable. Leurs propriétés biomécaniques étant caractérisées par une très faible élasticité qui les rend cassant, leur ostéosynthèse est de ce fait très délicate avec un réel risque de fracture.
Les indications thérapeutiques des allogreffes osseuses couvrent notamment les principaux enjeux de la chirurgie osseuse pré-implantaire visant à régénérer un volume osseux insuffisant avant ou simultanément à la pose d’implants.
Les allogreffes osseuses BIOBank sont ainsi selon leurs formes adaptées au comblement de cavités, à la régénération osseuse guidée (ROG) ou à la greffe d’apposition.
Mode d’utilisation et mécanisme d’action
La phase de réhydratation est une étape importante, nécessaire pour que le greffon osseux retrouve son élasticité initiale. Elle peut être réalisée avec du sérum physiologique stérile ou avantageusement avec le sang du patient. Celui-ci apporte en effet des éléments figurés et des protéines qui lors de la formation du caillot sanguin constitueront un réseau propice à l’adhésion cellulaire et à l’activation des facteurs intervenant dans la cicatrisation tissulaire. La réhydratation par le sang apporte en outre une cohésion des grains de poudre qui facilite les manipulations.
Comme tout biomatériau inerte et dépourvu de facteurs de croissance, l’allogreffe osseuse BIOBank agit par ostéoconduction.
La matrice osseuse greffée se laisse envahir par une vascularisation issue du lit osseux receveur qui va lui apporter les cellules osseuses nécessaires à son remaniement et à sa transformation en un tissu osseux vivant et fonctionnel.
Ce qui fait la différence avec les autres matériaux ostéoconducteurs tient dans la composition intrinsèque de sa structure minéralo-collagénique, la préservation de son architecture et de ses propriétés mécaniques et dans la mouillabilité particulièrement forte consécutive à l’efficacité du procédé Supercrit®.
Les cellules osseuses du patient greffé vont ainsi pénétrer dans un environnement familier du point de vue de la composition biochimique du greffon et pouvoir diffuser et se déposer à la surface des travées osseuses, cela sans frein ni délai. Dès lors, le mécanisme connu de résorption/apposition est initié dès les premières heures suivant la greffe. L’absence de résidus cellulaires facilite cette diffusion et limite considérablement les réactions cellulaires et humorales inhérentes à la greffe d’un corps étranger. La résultante est que l’ostéoconduction se déroule selon une cinétique plus rapide qu’avec les matériaux principalement composés d’une seule phase minérale ou dont le nettoyage et la mouillabilité ne sont pas aussi performants.
Ces propriétés qui associent efficacité et tolérance sont confirmées par les analyses histologiques régulièrement pratiquées lors de la pose des implants (Figure 3).
Classiquement, 4 à 6 mois après la greffe d’une poudre d’os spongieux dans un sinus ou une cavité post-extractionnelle, une image du processus de remodelage osseux intègre les éléments suivants :
- une juxtaposition intime entre les fragments résiduels du greffon et un os néoformé vivant, avec un équilibre des 2 tissus en termes de quantité, les particules de greffon jouant le rôle de ponts au sein du nouveau tissu osseux
- une moelle osseuse cellularisée dépourvue de cellules géantes ou macrophagiques
- la présence de vaisseaux sanguins participant au métabolisme tissulaire
- des fronts d’ostéoblastes à la surface du tissu ostéoïde en voie de minéralisation
- quelques rares ostéoclastes pouvant subsister, témoignant d’une certaine stabilité voire de la fin de la phase de résorption active
On observe que le processus de résorption du greffon n’est pas achevé, ce qui en soit n’est pas un problème car les particules résiduelles se comportent comme l’os vivant sur le plan biomécanique vis à vis des contraintes mécaniques consécutives à la pose des implants. Le fait remarquable est l’obtention d’une réelle cohésion des tissus au sein du volume greffé. Les particules de greffon ont été réellement assimilées dans un réseau de trabécules d’os néoformé fonctionnel.
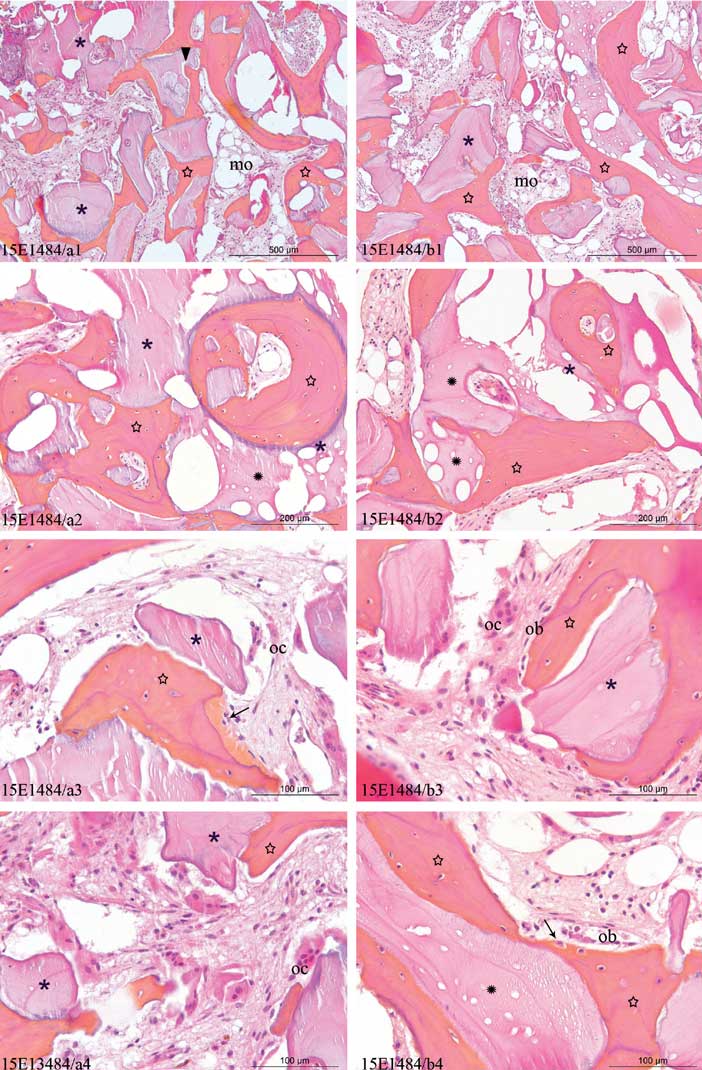
Figure 3 : Planche histologique d’une biopsie de sinus à 6 mois du Dr Carole Leconte (Paris). Coloration Hématoxylin-Eosine-Safran réalisée par le laboratoire Novotec (Lyon) – ✱ : particule greffon, ✩ : os néoformé, → : tissu ostéoïde, mo : moelle osseuse, ob : ostéoblaste, oc : ostéoclaste
Conclusion
L’ensemble des études in vitro et précliniques valident la pertinence du procédé Supercrit®. En alliant performance du nettoyage et de la viro-inactivation et respect de la trame osseuse, il constitue une approche moderne et efficace. Il convient également de retenir que la mise en oeuvre d’un tel procédé se fait au sein d’une organisation complexe, nécessitant la maîtrise de nombreuses compétences et plaçant la rigueur au cœur de chacune des étapes.
Le recul clinique aujourd’hui disponible témoigne de l’intérêt des allogreffes osseuses et confirme que le tissu osseux est un biomatériau naturel exceptionnel.
Bibliographie
1. Fages J., Marty L., Delga C., Condoret J.-S., Combes D., Frayssinet P., Use of supercritical CO2 for bone délipidation. Biomaterials, 1994, 15: 650-6
2. Fages J., Frayssinet P., Poirier B., Barbier Y., Joffret ML, Larzul D., Majewski W., Bonel G., Viral inactivation of human bone tissue using supercritical fluid extraction. ASAIO Journal, 1998, 44: 289-93
3. Pasteur-Texcell, Evaluation of the viral safety level during manufacturing process of human bone grafts. Evaluation carried out by using the whole femoral head, Report number: 250/01/5375/01, 2003
4. Fages J., Jean E., Frayssinet P., Mathon D., Poirier B., Autefage A., Larzul D., Bone allografts and supercritical processing: effects on osteointegration and viral safety. The Journal of Supercritical fluids, 1998 13: 351-6.
5. Frayssinet P., Rouquet N., Mathon D., Autefage A., Fages J., Histological integration of allogeneic cancellous bone tissue treated by supercritical CO2 implanted in sheep bones. Biomaterials, 1998, 19 : 2247-53
6. Mitton D., Rappeneau J., Bardonnet R., Effect of a supercritical CO2 based treatment on mechanical properties of human cancellous bone. Eur J Orthop Surg Traumatol, 2005, 15: 264-9
7. Vastel L., Masse C., Crozier E., Padilla F., Laugier P., Mitton D., Bardonnet R., Courpied J.-P., Effects of gamma irradiation on mechanical properties of defatted trabecular bone allografts assessed by speed-of-sound measurement. Cell Tissue Banking, 2007, 8:205-10
8. Vastel L., Masse C., Mesnil P., Crozier E., Padilla F., Laugier P., Mitton D., Courpied J. P. Comparative ultrasound evaluation of human trabecular bone graft properties after treatment with different sterilization procedures. J Biomed Mater Res B Appl Biomater. 2009 Jul;90(1):430-7