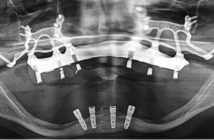
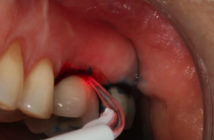
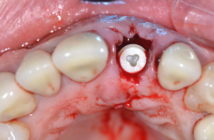
La péri-implantite est une maladie inflammatoire d’origine infectieuse (Lindhe et Meyle 2008, Zitzmann et Berglundh 2008). Son traitement, qui consiste à réduire la quantité de bactéries pour diminuer l’infection, pourrait être associé ou non à des thérapeutiques régénératives. La principale difficulté dans le traitement de la péri-implantite réside dans la complexité, voire l’impossibilité de désinfecter correctement les surfaces rugueuses dé- sormais omniprésentes des implants. La présence et l’architecture des spires ainsi que le type de reconstruction prothétique (profils d’émergences proéminents, fausse gencive…) sont autant d’obstacles à la désinfection. Le traitement des péri-implantites est encore loin de faire l’unanimité. Différents protocoles sont proposés dans la littérature avec des résultats variables. Différents facteurs, appelés cofacteurs, sont susceptibles d’induire ou d’aggraver une péri-implantite et doivent être gérés en amont.
Parmi ces cofacteurs, on pourrait retenir le facteur occlusal. D’après Fu et coll. 2012, une surcharge occlusale sur un implant peut entraîner une perte osseuse péri-implantaire, qui, en présence d’une muqueuse inflammée est susceptible d’induire une péri-implantite (Koslovsky et coll. 2007). Les surcharges occlusales devraient donc être contrôlées.
La conception prothétique
La difficulté d’accès à l’hygiène au niveau des structures implantaires est fortement associée à la péri-implantite (Serino et Ström, 2009). La modification des suprastructures peut s’avérer nécessaire. De plus, la dépose de la prothèse, lorsqu’elle est possible, permet un accès plus simple aux lésions.
L’importance de l’hygiène bucco-dentaire et des antécédents de maladies parodontales
Avant même l’implantation, les patients devront recevoir un enseignement approfondi à l’hygiène orale, qui se poursuivra par une maintenance au cabinet dentaire. Plusieurs études semblent montrer qu’il n’y aurait pas plus de péri-implantites sur des implants à surface rugueuse dès lors qu’il y a une maintenance parodontale rigoureuse. Les patients présentant une parodontite seront d’autant plus suivis, car considérés comme à risque (Wennström et coll. 2004).
Une fois la péri-implantite installée, deux approches sont possibles, le traitement non chirurgical et/ou le traitement chirurgical.
Le traitement non chirurgical
Les traitements non chirurgicaux consistent en un assainissement mécanique et chimique des surfaces implantaires et des lésions osseuses associées.
Le débridement mécanique par un surfaçage à l’aide de curettes (titane, plastique ou téflon) dont les formes permettent l’accès aux défauts faisant le tour des implants, associé ou non à la projection de poudre abrasive par des aéropolisseurs sous-muqueux avec de la poudre (glycine). L’utilisation d’inserts ultra-sons, ou du Vector system® associe projection de poudre et vibrations ultrasoniques. Il est observé avec ce dernier uniquement une diminution de l’indice de saignement (Renvert et al. 2009), sans aucune amélioration quant à la profondeur de poche. De plus, son action est tout aussi limitée dans le temps, tant au niveau clinique que bactériologique (Persson 2010) ; ainsi les résultats obtenus par débridement mécanique à l’aide de curettes semblent être identiques à ceux obtenus avec un Vector system® (Karring et al. 2005).
Le débridement mécanique seul semble inefficace pour le traitement de la péri-implantite (Muthukuru 2012, Esposito 2012 Revue Cochrane). Le laser amé- liore légèrement les conditions à court terme (Lindhe et Meyle 2008), sauf qu’à six mois aucune différence dans les résultats n’est observée entre l’utilisation d’un aéropolisseur Perioflow® ou du laser Er-Yag (Renvert et al. 2011). L’adjonction de d’oxycycline à un débridement manuel semble améliorer le niveau d’attache et la profondeur de poche par rapport au débridement manuel seul (Bütcher 2004).
Ainsi, l’adjonction d’antiseptique et/ou d’antibiotique est nécessaire pour rendre plus efficace ce débridement mécanique (Renvert et al. 2008).
Cette thérapie antimicrobienne consiste en l’administration d’antiseptique pour décontaminer la surface et/ou d’antibiotiques pour éliminer une infection bactérienne au niveau des tissus péri-implantaires. Les antibiotiques peuvent être utilisés en administration systémique ou locale. C’est ainsi que les microsphères de minocycline en administration locale montrent une supériorité quant à la diminution des poches et l’amélioration de l’indice de saignement par rapport au gel de chlorhexidine (Muthukuru 2012). Ce traitement à la minocycline doit être répété au 30e et au 90e jour car son efficacité est de courte durée (6 mois) (Renvert et al. 2008). Alors que le gel de métronidazole ne montre pas d’intérêt à être associé au débridement mécanique (Tang 2002), de même l’adjonction de chlorhexidine au laser (Er-Yag) ou au débridement manuel ne semble pas améliorer les résultats cliniques (Schwarz 2005)
Ce qu’il faut retenir
La thérapeutique mécanique non-chirurgicale associée à l’utilisation d’un bain de bouche est efficace dans le traitement de la mucosite péri-implantaire (Esposito 2012).
La thérapeutique non-chirurgicale mécanique seule ne semble pas être efficace dans le traitement des lésions péri-implantaires (Esposito 2012).
Adjonction d’une antibiothérapie locale à libération contrôlée ou d’une antibiothérapie systémique (Mombelli et al. 2001).
Il est aujourd’hui très difficile de par le manque de données de classifier de manière objective les différents traitements. Un consensus semble néanmoins se dégager sur l’inefficacité d’un débridement mécanique seul. L’apport des lasers reste très contesté (Esposito 2012, Muthukuru 2012).
Le traitement chirurgical : résultats
L’approche chirurgicale avec un lambeau permet un accès direct à la lésion péri-implantaire et consiste en un débridement mécanique, voire une détoxication de la surface implantaire à l’aide d’antiseptiques et/ou d’antibiotiques.
La difficulté aujourd’hui réside dans le fait qu’aucun protocole n’est vraiment reconnu par tous et qu’aucune technique de traitement de la péri-implantite ne semble vraiment supérieure à une autre (Claffey al. 2008, Charalampakis et al. 2011). Nous allons effectuer une revue des différentes méthodes appliquées aujourd’hui ainsi que de leurs résultats. En préambule, il semble qu’un débridement à ciel ouvert avec une décontamination de surface est plus efficace dans le traitement de la péri-implantite qu’un débridement nonchirurgical (Claffey al. 2008), (Fig. 1 et 2).
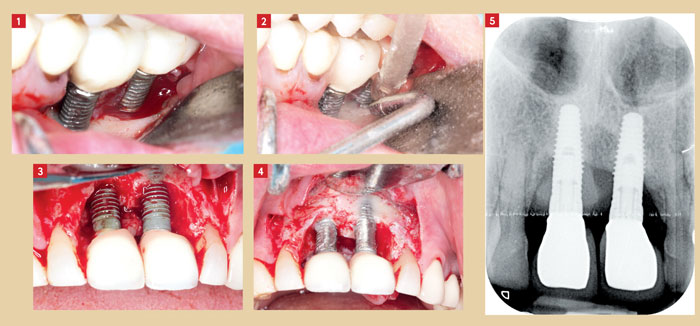
Cette approche peut être associée à des techniques de régénération ou de greffes osseuses, avec ou sans membranes. Elle pourrait entraîner une ré-ostéointégration plus importante sur les implants à surface rugueuse qui ont subi une implantoplastie (lissage mécanique avec des fraises et cupules) (Claffey al. 2008).
L’implantoplastie montre également – d’après Romeo et al. (2007) – des résultats cliniques probants en l’associant à la chirurgie résectrice et à un lambeau repositionné apicalement avec une antibiothérapie systémique (Fig. 3 à 5).
Le laser associé à un traitement chirurgical n’apporterait pas d’amélioration notable (Schwarz et al. 2011) par rapport à un simple débridement mécanique manuel (curette en plastique et coton imbibé de sérum physiologique). L’indice de saignement est diminué dans les deux méthodes et une amélioration de la profondeur de poche ainsi qu’un gain d’attache est constaté dans les deux cas. Le laser permet en outre une plus grande efficacité lorsque la configuration du défaut est difficile d’accès.
Le laser semble être capable cependant d’éliminer efficacement les dépôts bactériens sur les implants en titane à surfaces lisses ou rugueuses, sans altérer leurs surfaces (Kreisler et al. 2002, Schwarz et al. 2009a, Deppe et al. 2007, Haas et al. 2000), cependant de nombreux auteurs préconisent une implantoplastie lorsque l’implant est à surface rugueuse.
Une antibiothérapie systémique associée à un lambeau d’accès et à une décontamination antiseptique de la surface implantaire (peroxyde d’hydrogène) permettrait une guérison dans 58 % des cas à 5 ans (Leonhardt et al. 2003). Cependant, la taille réduite de l’échantillon – 26 implants – ne permet pas de confirmer cette donnée.
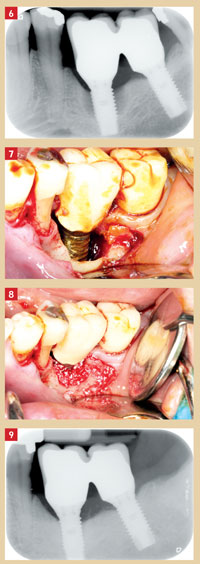 Les techniques de comblement osseux avec ou sans enfouissement des implants (Behneke et al. 2000, Jovanovic et al. 1992) semblent améliorer les résultats cliniques (Claffey al. 2008). Il faut cependant noter que ces techniques ne traitent pas la péri-implantite en tant que telle, mais permettent uniquement d’améliorer le résultat clinique en comblant le défaut. Avant tout comblement ou régénération, un débridement associé ou non à une chimiothérapie (antiseptique et/ou antibiotique) devra être entrepris. De nombreux matériaux ont été utilisés tels que l’Algipore associé à une membrane Osseoquest (RoosJansåker et al. 2007), l’hydroxyapatite nanocristalline, le Bio-Oss associé à une membrane Bio-Gide (Schwarz et al. 2006) ou encore l’os autogène (Behneke et al. 1997, 2000). Ces biomatériaux permettraient une amélioration significative de la profondeur de poche et un comblement osseux visible à l’examen radiologique (Fig. 6 à 9).
Les techniques de comblement osseux avec ou sans enfouissement des implants (Behneke et al. 2000, Jovanovic et al. 1992) semblent améliorer les résultats cliniques (Claffey al. 2008). Il faut cependant noter que ces techniques ne traitent pas la péri-implantite en tant que telle, mais permettent uniquement d’améliorer le résultat clinique en comblant le défaut. Avant tout comblement ou régénération, un débridement associé ou non à une chimiothérapie (antiseptique et/ou antibiotique) devra être entrepris. De nombreux matériaux ont été utilisés tels que l’Algipore associé à une membrane Osseoquest (RoosJansåker et al. 2007), l’hydroxyapatite nanocristalline, le Bio-Oss associé à une membrane Bio-Gide (Schwarz et al. 2006) ou encore l’os autogène (Behneke et al. 1997, 2000). Ces biomatériaux permettraient une amélioration significative de la profondeur de poche et un comblement osseux visible à l’examen radiologique (Fig. 6 à 9).
Toutefois les membranes non résorbables en polytétrafluoroéthylène expansé (e-PTFE) sans enfouissement des implants donnent des résultats variables (Aughtun et al. 1992, Jovanovic et al. 1992). Même si la régéné- ration osseuse guidée ne semble pas avoir de résultats prédictibles, un remplissage partiel du défaut semble souvent obtenu (Sahrmann et al. 2011).
Heitz-Mayfield et al. (2012) décrivent une grande efficacité (92 % de stabilité osseuse à un an) avec un maintien des résultats dans le temps pour le protocole chirurgical suivant :
- un enseignement à l’hygiène buccale et un débridement préalable
- un lambeau d’accès et une décontamination de la surface de l’implant
- une antibiothérapie systémique avec de l’amoxicilline et du métronidazole
- un protocole de soins postopératoires strict avec des bains de bouche à la chlorhexidine
- un niveau d’autonomie élevé en terme de contrôle de la plaque
Bien qu’il existe un grand nombre d’études très hétérogènes, le traitement chirurgical des péri-implantites semble donner de bons résultats à court terme d’après Renvert et al. (2012) cependant le bénéfice à long terme n’est toujours pas démontré à cause du manque d’études cliniques.
Ce qu’il faut retenir
Les éléments semblant être bénéfiques lors de l’approche chirurgicale.
- L’accès chirurgical par un lambeau de pleine épaisseur.
- Le nettoyage en profondeur des surfaces implantaires contaminées.
- L’administration d’une antibiothérapie systémique et de bains de bouche à la chlorhexidine.
- Le comblement du défaut osseux lorsque celui-ci le permet, avec un biomatériau et une membrane résorbable
Conclusion
Pour conclure, la péri-implantite, dont la prévalence semble augmenter avec la généralisation des surfaces rugueuses, constitue un véritable problème en chirurgie implantaire aujourd’hui. Il n’existe toujours pas à ce jour de consensus sur un protocole à suivre. Seules quelques grandes tendances se dégagent.
Le débridement mécanique seul semble inefficace. L’adjonction d’une chimiothérapie (antiseptique ou antibiotique) lors d’un abord chirurgical pourrait être bénéfique dans certains cas; de même une régénération pourrait améliorer les conditions cliniques sans toutefois traiter la maladie péri-implantaire. L’intérêt du laser reste toujours très controversé, son utilisation ne semble pas apporter les résultats escomptés.
Le traitement des péri-implantites est probablement lié à la décontamination de la surface implantaire. Le retour à des surfaces lisses a été envisagé par certains auteurs mais il est sans doute souhaitable de s’orienter plutôt vers une évolution des surfaces rugueuses (vers des surfaces bactériostatiques, bactéricides ou plus faciles à décontaminer) qui ont malgré tout permis une amélioration des résultats en particulier en présence d’un os de faible densité. Devant la difficulté de traiter cette maladie implantaire, l’enjeu aujourd’hui réside sans doute dans l’importance de l’hygiène orale et de la maintenance implantaire et parodontale de tous nos patients implantés. La prévention et le traitement de la mucosite reste probablement le meilleur moyen d’éviter les péri-implantites.
Lectures conseillées
1. Aparna IN, Dhanasekar B, Lingeshwar D, Gupta L. Implant crest module: a review of biomechanical considerations. Indian J Dent Res. 2012 Mar-Apr; 23(2): 257-63. doi: 10.4103/0970-9290.100437. Review.
2. Berglundh T, Persson L, Klinge B. A systematic review of the incidence of biological and technical complications in implant dentistry reported in prospective longitudinal studies of at least 5 years. J Clin Periodontol. 2002;29 Suppl 3:197-212; discussion 232-3. Review.
3. Esposito M, Grusovin MG, Worthington HV. Interventions for replacing missing teeth: treatment of peri-implantitis. Cochrane Database Syst Rev. 2012 Jan 18;1:CD004970. doi: 10.1002/14651858.CD004970.pub5. Review.
4. Esposito M, Grusovin MG, Worthington HV. Treatment of peri-implantitis: what interventions are effective? A Cochrane systematic review. Eur J Oral Implantol. 2012;
5. Suppl: S21-41. Review. 5. Khammissa RA, Feller L, Meyerov R, Lemmer J. Peri-implant mucositis and peri-implantitis: clinical and histopathological characteristics and treatment. SADJ. 2012 Apr; 67(3): 122, 124-6. Review.
6. Klinge B. Peri-implant marginal bone loss: an academic controversy or a clinical challenge? Eur J Oral Implantol. 2012; 5 Suppl: S13-9. Review.
7. Meyle J. Mechanical, chemical and laser treatments of the implant surface in the presence of marginal bone loss around implants. Eur J Oral Implantol. 2012; 5 Suppl: S71-81. Review.
8. Mombelli A, Moëne R, Décaillet F. Surgical treatments of peri-implantitis. Eur J Oral Implantol. 2012; 5 Suppl: S61-70. Review. No abstract available.
9. Renvert S, Roos-Jansåker AM, Claffey N. Non-surgical treatment of peri-implant mucositis and peri-implantitis: a literature review. J Clin Periodontol. 2008 Sep; 35 (8 Suppl): 305-15. doi: 10.1111/j.1600-051X.2008.01276.x. Review.
10. Romanos GE, Weitz D. Therapy of peri-implant diseases. Where is the evidence? J Evid Based Dent Pract. 2012 Sep; 12 (3 Suppl): 204-8. doi: 10.1016/ S1532-3382(12)70038-6. Review.
11. Subramani K, Wismeijer D. Decontamination of titanium implant surface and re-osseointegration to treat peri-implantitis: a literature review. Int J Oral Maxillofac Implants. 2012 Sep-Oct; 27(5): 1043-54. Review.
12. van Dyke TE. The impact of genotypes and immune reactivity on periimplant inflammation: Identification and therapeutic use of anti-inflammatory drugs and immunomodulators. Eur J Oral Implantol. 2012;5 Suppl: S51-60. Review.
13. van Winkelhoff AJ. Antibiotics in the treatment of peri-implantitis. Eur J Oral Implantol. 2012; 5 Suppl: S43-50. Review.