INTRODUCTION
Couramment utilisé jusqu’à maintenant, le terme « cracked tooth syndrom » fut décrit par Cameron en 19641.
Allant d’une absence de symptômes à une sensibilité exacerbée au froid et/ou au chaud en passant par des douleurs à la pression, le spectre diagnostic des fêlures peut vite devenir versatile et chargé de confusion2.
La balance entre préservation tissulaire et besoin de renforcement biomécanique doit être pondérée par le clinicien de façon systématique3.
La soustraction de tissus dentaires sains, autrefois nécessaire pour répondre aux impératifs de rétention mécanique de nos matériaux, est devenue superflue avec l’avènement de l’adhésion. Mais l’adhésion à elle seule représente-t-elle un outil suffisamment puissant pour apporter des réponses aux problématiques des fêlures ?
Les résines composites fascinent par leur omniprésence dans l’éventail des matériaux de restauration disponibles. Constamment améliorées par les fabricants qui n’ont eu de cesse de les enrichir d’innovations technologiques, leur cadre d’indications s’est élargi avec le temps. Nous nous efforcerons de préciser les contextes de fêlures dans lesquels ces matériaux permettent de répondre correctement aux exigences thérapeutiques demandées. Enfin, et à contre-courant de cette volonté perpétuelle de simplicité et de rapidité, nous nous intéresserons aux règles subtiles et exigeantes dissimulées derrière les protocoles d’apposition et de photopolymérisation des résines composites.
LES PERFORMANCES DE L’ADHÉSION
Recopier le modèle offert par la nature : voici la ligne directrice, simple et élégante, qui solidarise la philosophie de la dentisterie restauratrice biomimétique.
La dent naturelle présente une structure multi-laminaire où chaque feuillet présente son lot de propriétés singulières.
L’émail, fortement minéralisé (85 % de cristaux d’hydroxyapatite en volume), est le tissu le plus rigide du corps humain et présente un module d’élasticité d’environ 80GPa4.
Sous l’émail se trouve un tissu moins rigide : la dentine dont la composition moins minéralisée (47 % de cristaux d’hydroxyapatite en volume), plus riche en protéines, en collagène et en eau se traduit par un module d’élasticité, bien inférieur à celui de l’émail, d’environ 20GPa4.
Entre les deux : la jonction amélo-dentinaire : une interface complexe, faiblement minéralisée, d’une vingtaine de microns d’épaisseur en moyenne, au travers de laquelle transfixent un grand nombre de fibrilles de collagène. Celles-ci viennent s’incorporer solidement à la structure minérale de l’émail conférant à la dent sa cohésion caractéristique tout en lui procurant une ligne de défense performante face à la progression des fêlures3, 4.
Les nombreux travaux sur l’adhésion, et notamment ceux de Nakabayashi sur le collage dentinaire dans les années 1980, ont participé à la création d’un modèle complexe de jonction adhésive : la couche hybride. Conceptuellement proche de la jonction amélo-dentinaire, ce modèle se base également sur une exploitation du collagène dentinaire5, 6.
Pièce maîtresse d’une alliance étroite entre le naturel et l’artificiel, c’est au travers de cette couche hybride que les valeurs d’adhésion entre résine et dentine atteignent voire dépassent les valeurs de cohésion retrouvées au sein même de la jonction amélodentinaire7, 8, 9.
Comme indiqué par le Dr. Romain Chéron dans l’article ci-visé, « renforcer » ou encore « coller » les deux fragments dentaires séparés par une fêlure n’est pas possible. Le but de la thérapeutique à mettre en place est de limiter au mieux sa propagation afin d’échapper au risque biologique et/ou mécanique encouru par la dent concernée.
Si un risque mécanique élevé de séparation des fragments est présent, l’adhésion est insuffisante et le recouvrement par un matériau rigide, ne laissant que peu de place à l’expansion de la fêlure, s’avèrera nécessaire3.
L’adhésion ne constitue une solution que si la fragilisation est iatrogène, c’est-à dire causée par un matériau inadapté (amalgame) ou mal collé (composite défectueux), et à condition que la vitalité pulpaire ne soit pas menacée. C’est le cas des fêlures excentrées et peu pénétrantes, ou des fêlures cuspidiennes obliques.
MISE EN OEUVRE DES COMPOSITES
Adhésion et couche hybride émulent la jonction amélo-dentinaire et inscrivent nos protocoles restaurateurs dans une démarche plus conservatrice.
Néanmoins, une application correcte des protocoles de restauration directe implique une prise de conscience quant aux nombreuses subtilités des matériaux composites.
Bémol inhérent des résines composites, celles-ci subissent, lors de la photopolymérisation, une
contraction volumétrique qui entre en compétition avec l’adhésion. Le stress de polymérisation qui en
résulte peut mener à des échecs précoces de la restauration par micro-décollements au niveau de la
couche adhésive et/ou par fragilisation des parois dentaires résiduelles10.
Dès lors, l’impératif sera de mettre en oeuvre des stratégies visant à réduire les effets néfastes de cette
rétraction de prise.
La chémopolymérisation des composites « dual » engage une contraction plus douce, plus progressive, mais aussi bien plus lente, rendant difficile leur application clinique quotidienne11.
La composition (en charges inorganiques et en matrice résineuse) ainsi que le degré de conversion d’un composite photopolymérisable jouent un rôle prépondérant dans l’amplitude de la contraction volumétrique à laquelle il s’expose lors de sa prise10.
Un juste équilibre entre rigidité et flexibilité doit être trouvé pour réhabiliter la cohérence structurelle d’une dent.
De façon simplifiée, plus un composite est chargé, plus il est rigide et plus son module d’élasticité augmente.
Un composite fluide est généralement moins chargé.
Sa matrice résineuse occupant un espace plus important, la contraction volumétrique qu’il subira lors de la photopolymérisation sera plus importante.
Néanmoins, son module d’élasticité inférieur lui confère une meilleure capacité d’absorption et de distribution des contraintes12.
Au contact même de la couche adhésive, il semble, dès lors, préférable d’apposer un composite au module d’élasticité moins élevé dont la capacité de déformation permettra une redistribution plus harmonieuse du stress généré par la rétraction de prise12.
Bien que les promesses des fabricants quant à l’apport réel des fibres de verres courtes dans la gestion des fêlures soit un sujet controversé dans la littérature, l’Ever X flow (GC®), utilisé dans les cas cliniques qui suivent, semble présenter des propriétés mécaniques intéressantes qui l’indiquent pleinement dans son rôle de substitut dentinaire13.
En dehors de la formulation des résines composites, deux paramètres sur lesquels le clinicien peut agir lors
de la mise en oeuvre d’une restauration directe sont le protocole de photopolymérisation et l’apposition du composite.
Un protocole dit de « soft-start polymerization » consiste en une réduction de l’intensité de départ de la lumière émise par la lampe suivie de son augmentation graduelle afin d’engager une polymérisation plus progressive et plus douce du composite. Sur des incréments de composite de 2 mm, cette méthode permettrait une adaptation plus résiliente de l’interface adhésive aux contraintes subies lors de la rétraction de prise sans affecter le degré de conversion du composite, et donc sans compromettre l’obtention des propriétés mécaniques finales de ce dernier14.
L’intensité de la lumière diminue de façon proportionnelle à l’inverse du carré de la distance à la source. Ainsi, comme appliqué dans les cas cliniques qui vont suivre, débuter la photopolymérisation en tenant la lampe à distance de la dent en cours de restauration semble être, selon l’auteur, une alternative valable permettant une
polymérisation plus graduelle.
Sujet également controversé dans la littérature, le rôle du mode d’apposition du composite dans la gestion
du facteur de configuration, ou facteur-C. Ce dernier représente le ratio entre le nombre de surfaces collées
en contact avec le composite et le nombre de surfaces libres. Plus il augmente, plus le stress de polymérisation sera défavorable.
Dans les cas cliniques présentés dans cet article, nous avons opté pour un protocole d’apposition incrémentielle qui, en opposition avec une méthode de remplissage en masse de type « bulk-fill », consiste à réaliser une reconstruction en composite par de fins incréments apportés séquentiellement à la cavité à restaurer15, 16.
Chaque apport étant photopolymérisé selon la méthode de « soft-start polymerization » décrite plus haut. L’intérêt de cette méthode réside principalement dans la possibilité d’une gestion intéressante du facteur-C d’une cavité par subdivision des stress de polymérisation, incrément par incrément, dans une configuration plus favorable au maintien de l’intégrité de l’adhésion15, 16.
CAS CLINIQUES
CAS CLINIQUE N°1
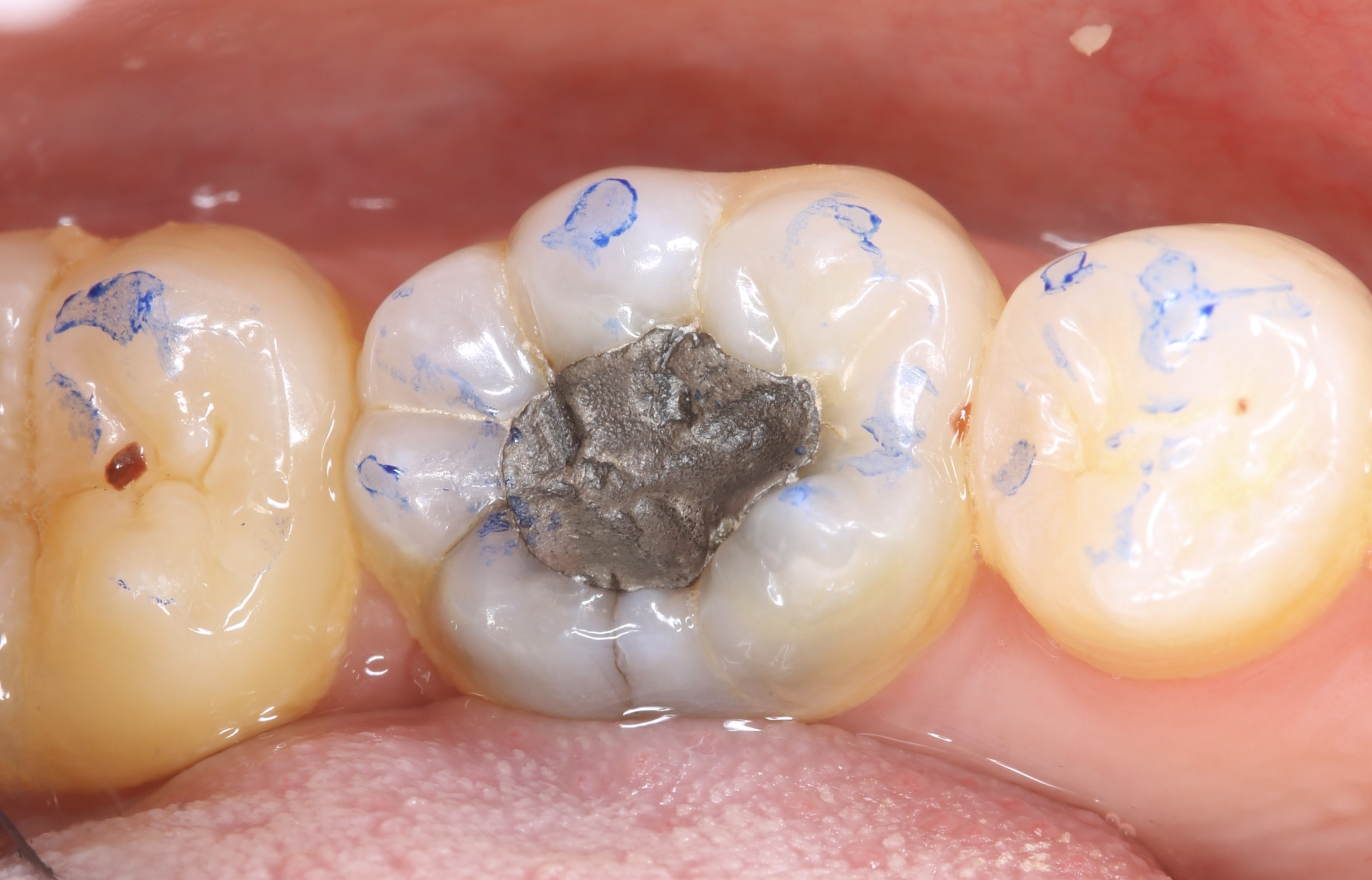
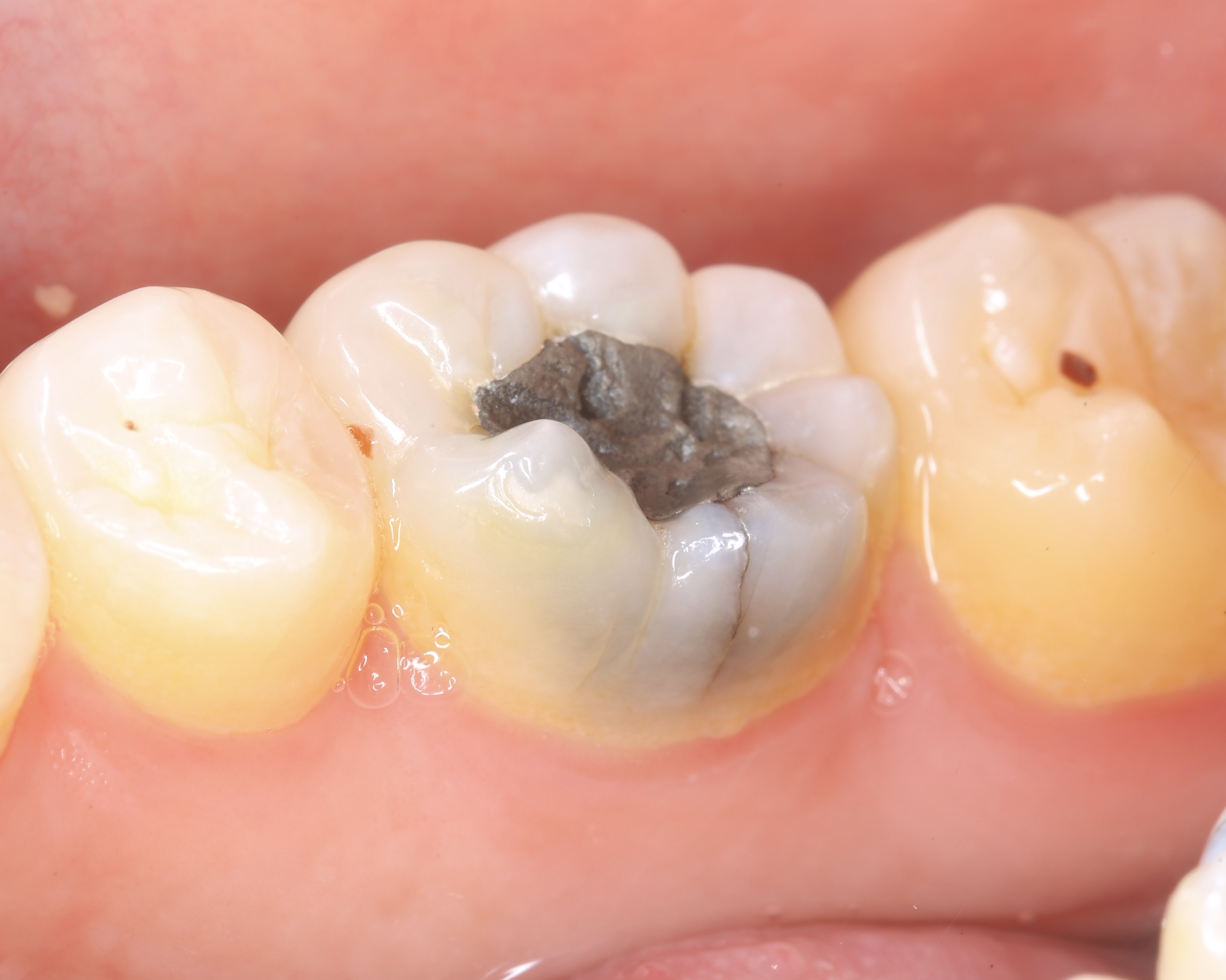
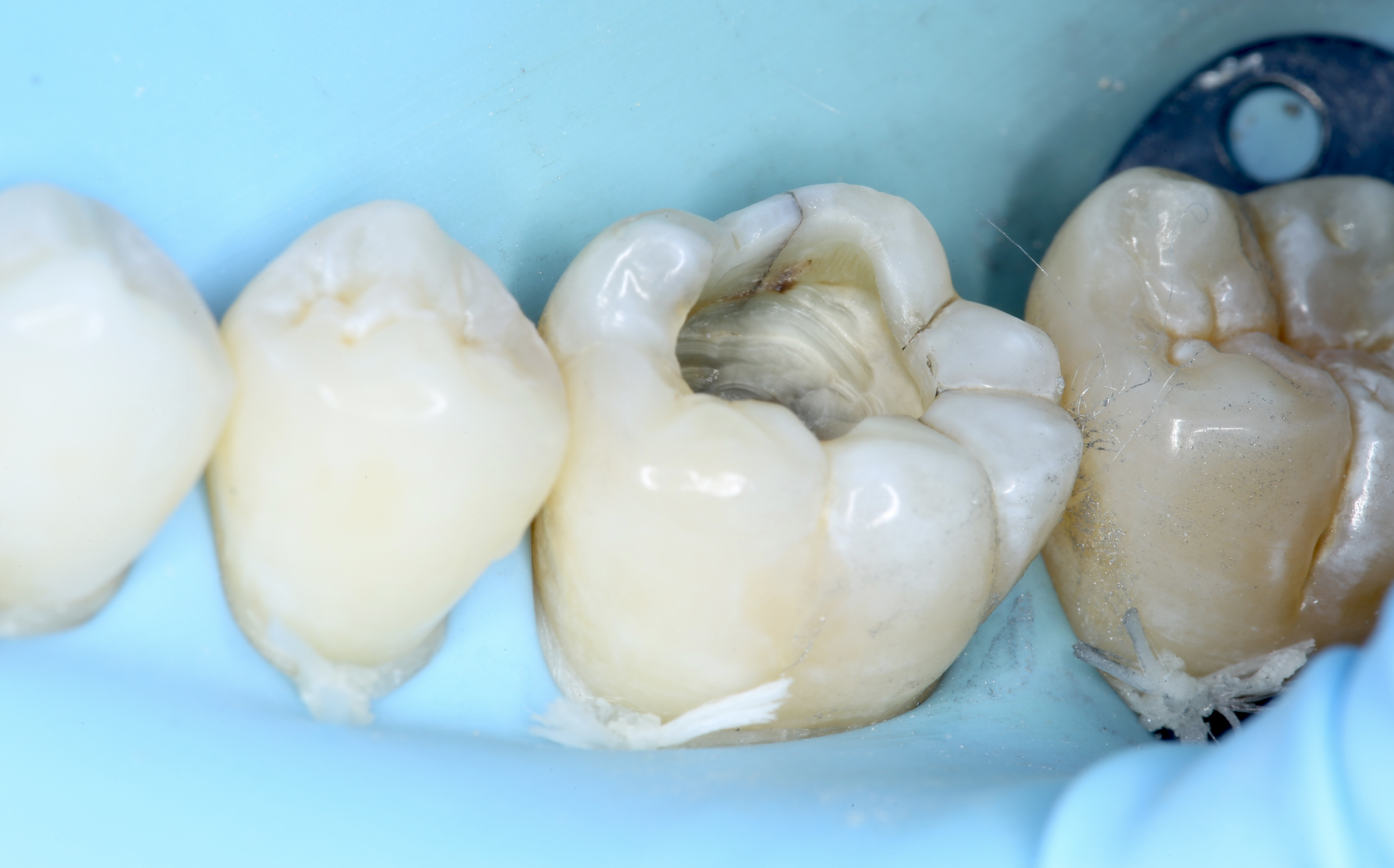
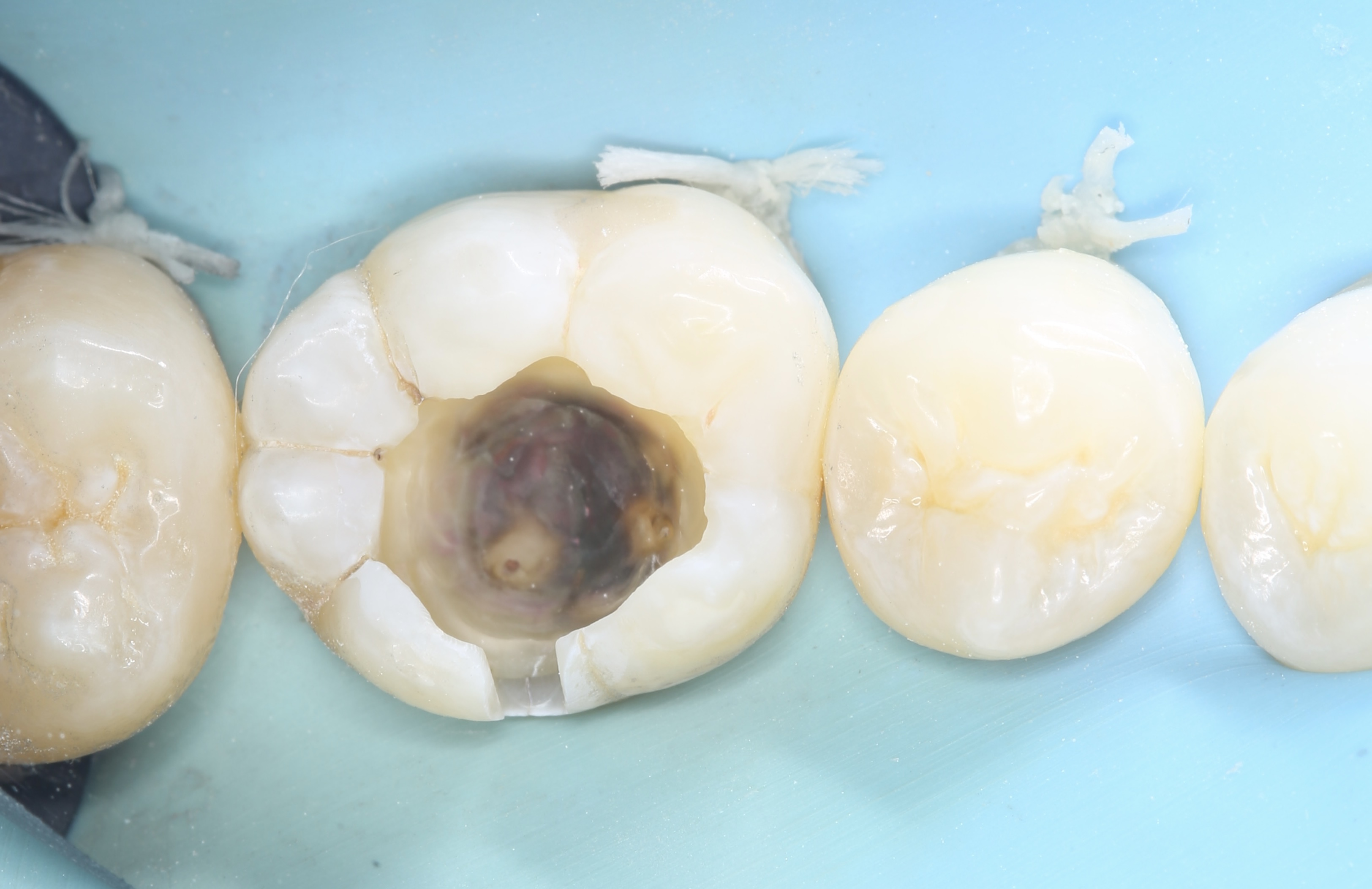
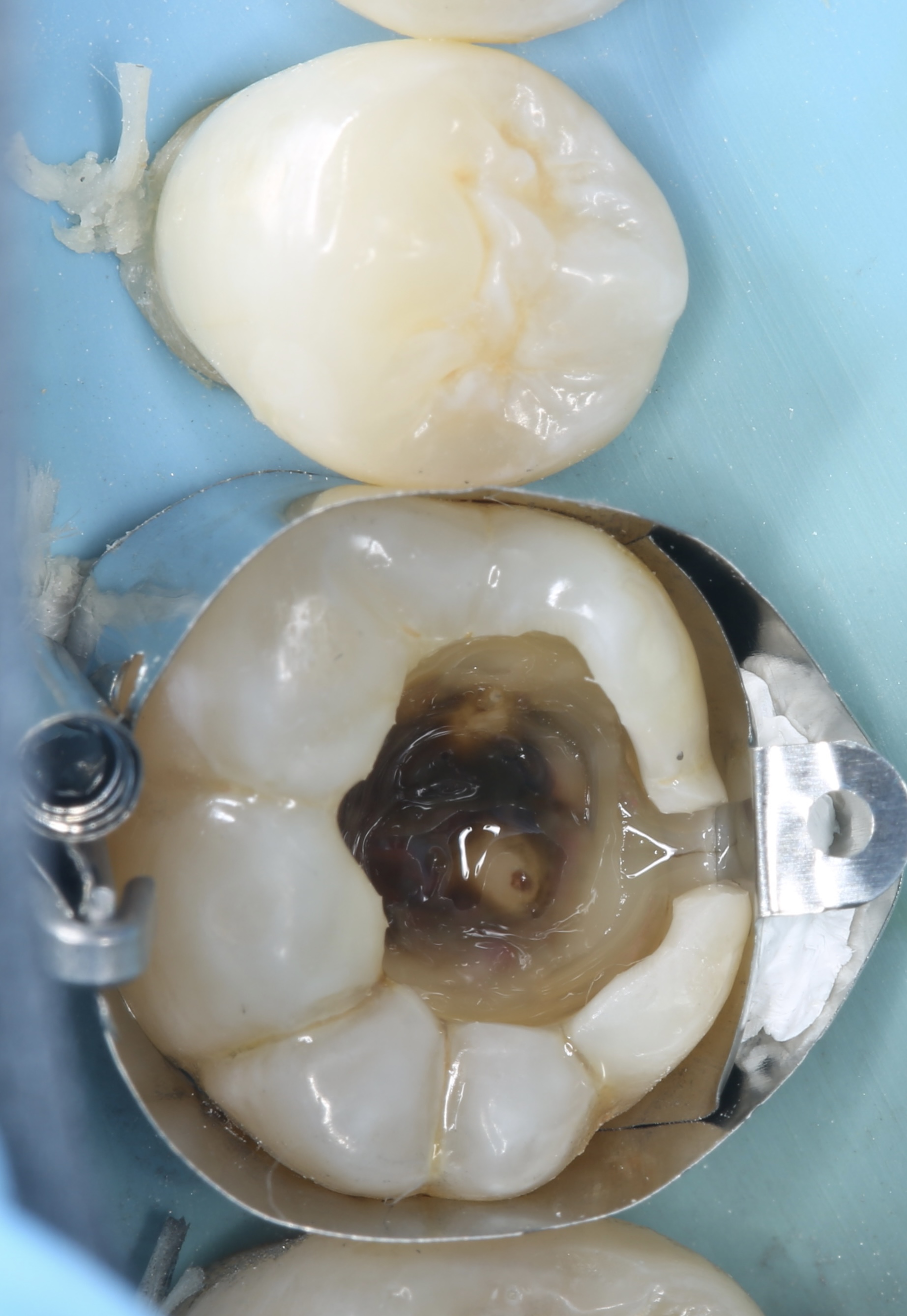
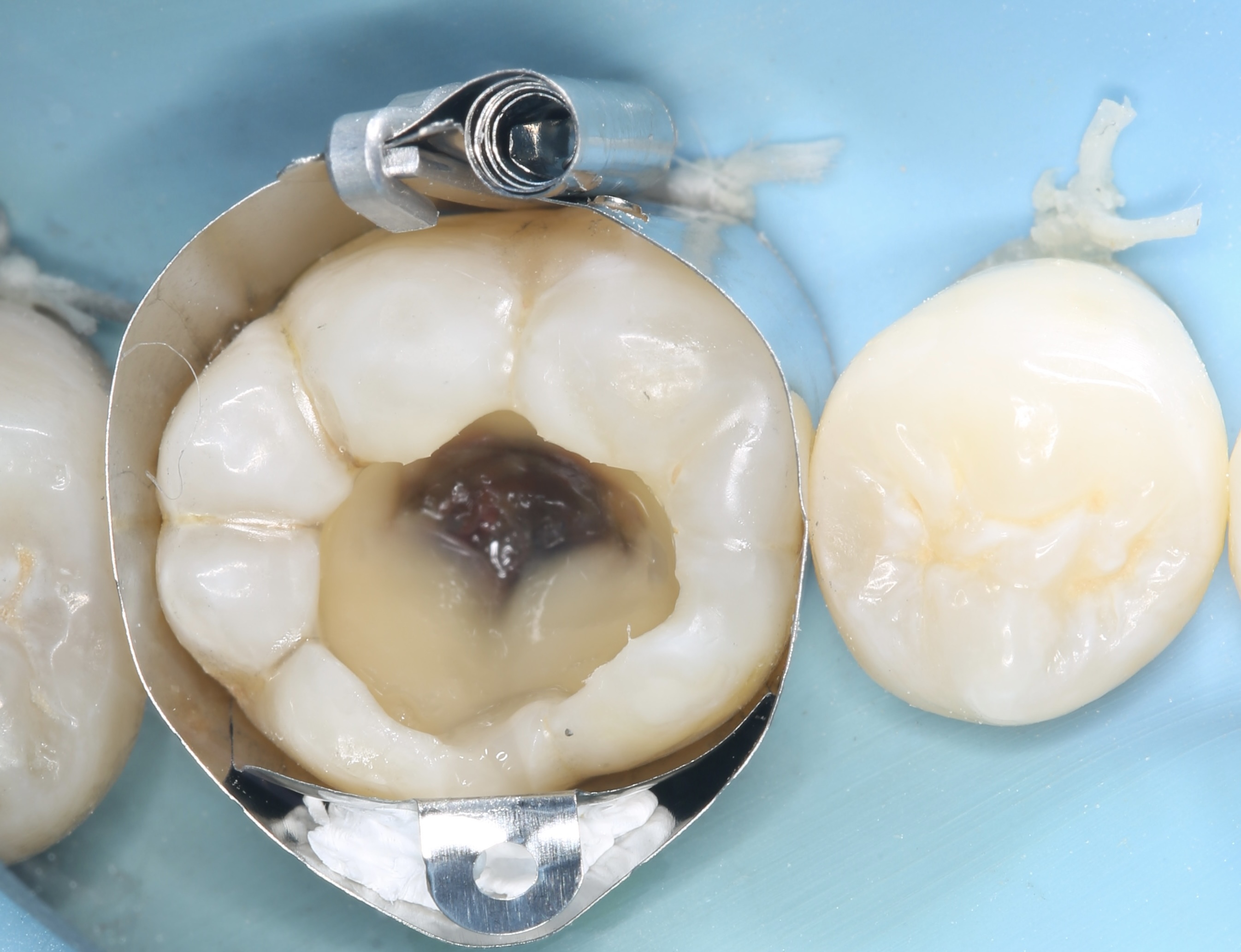
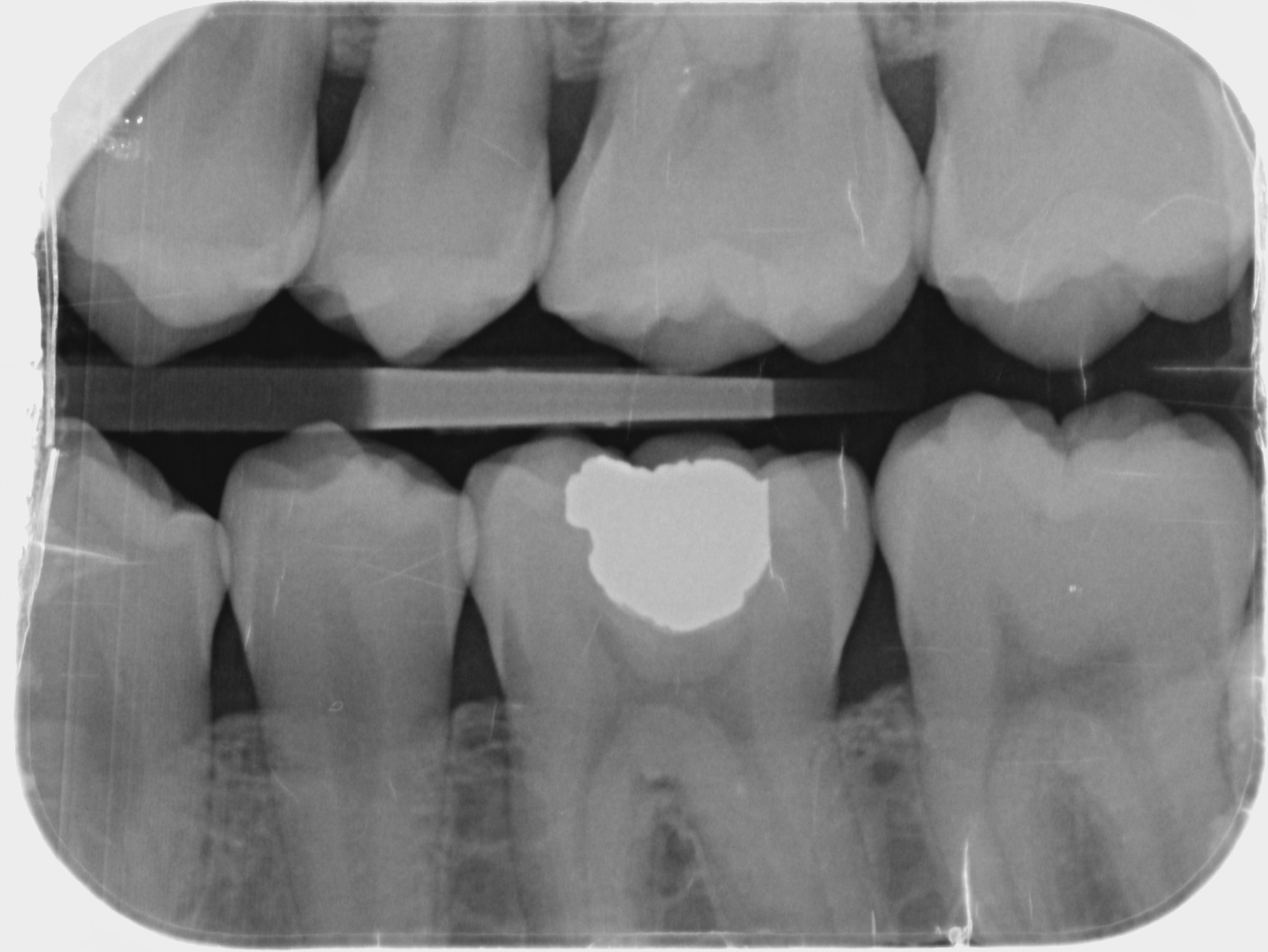
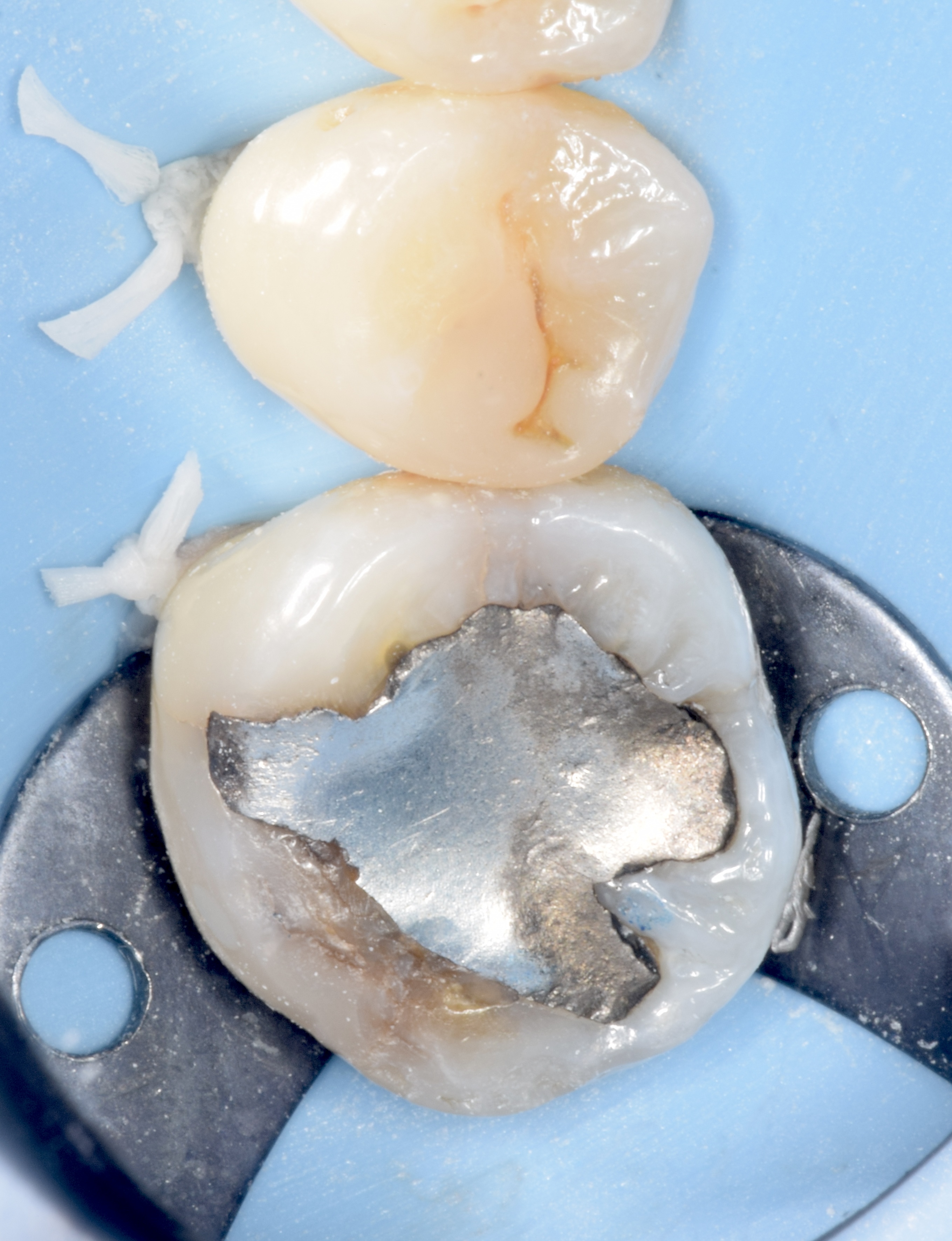
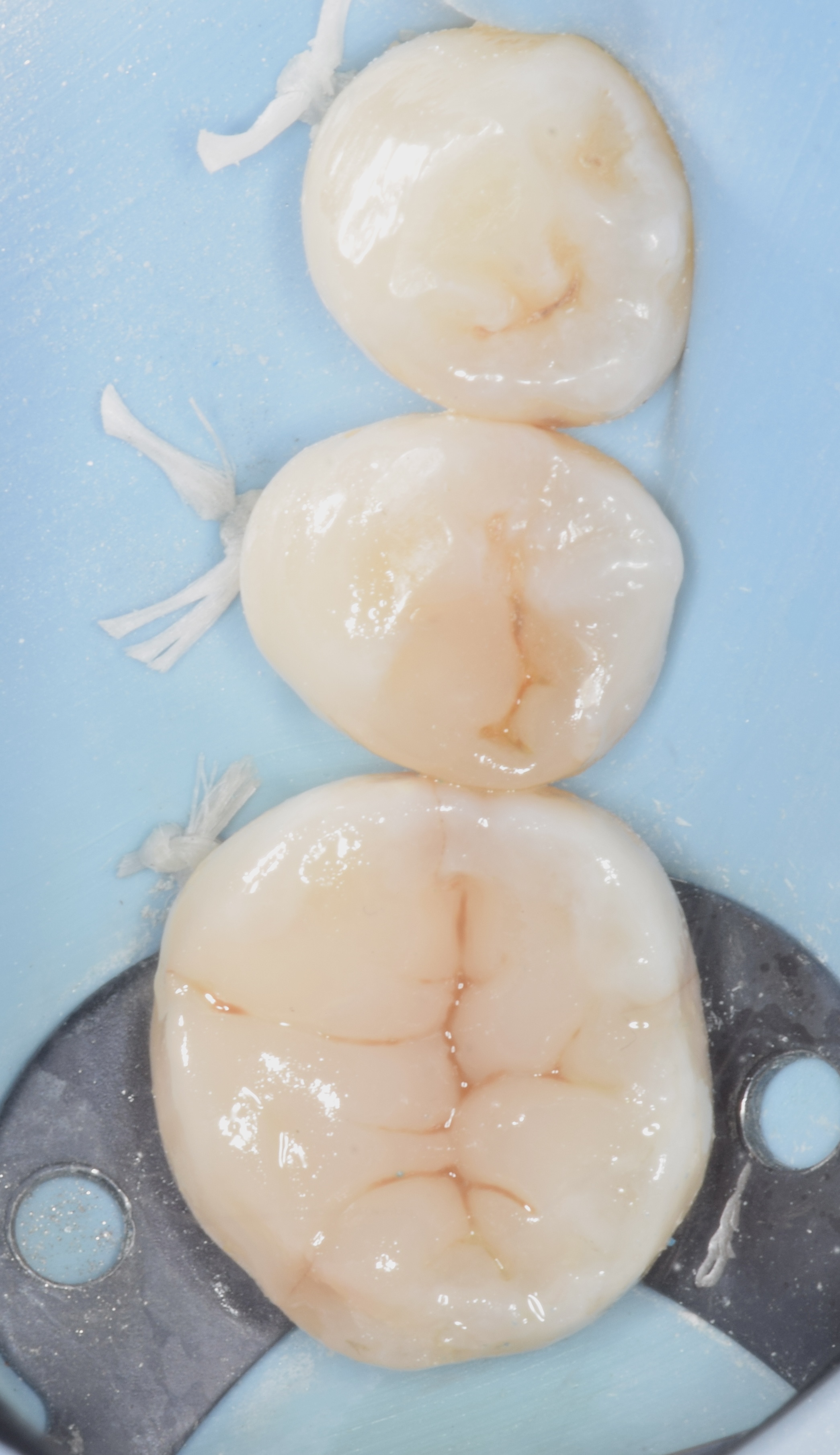
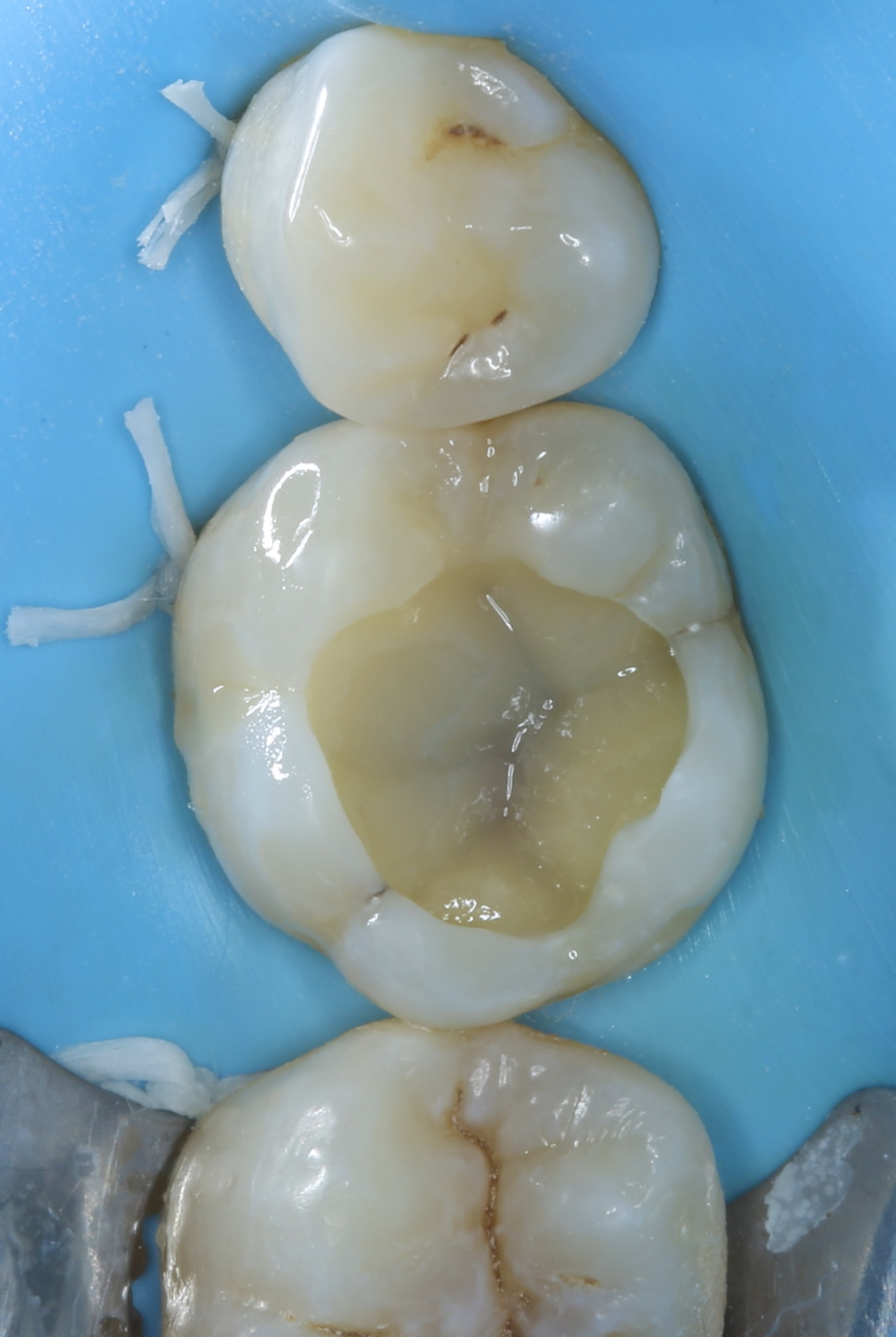
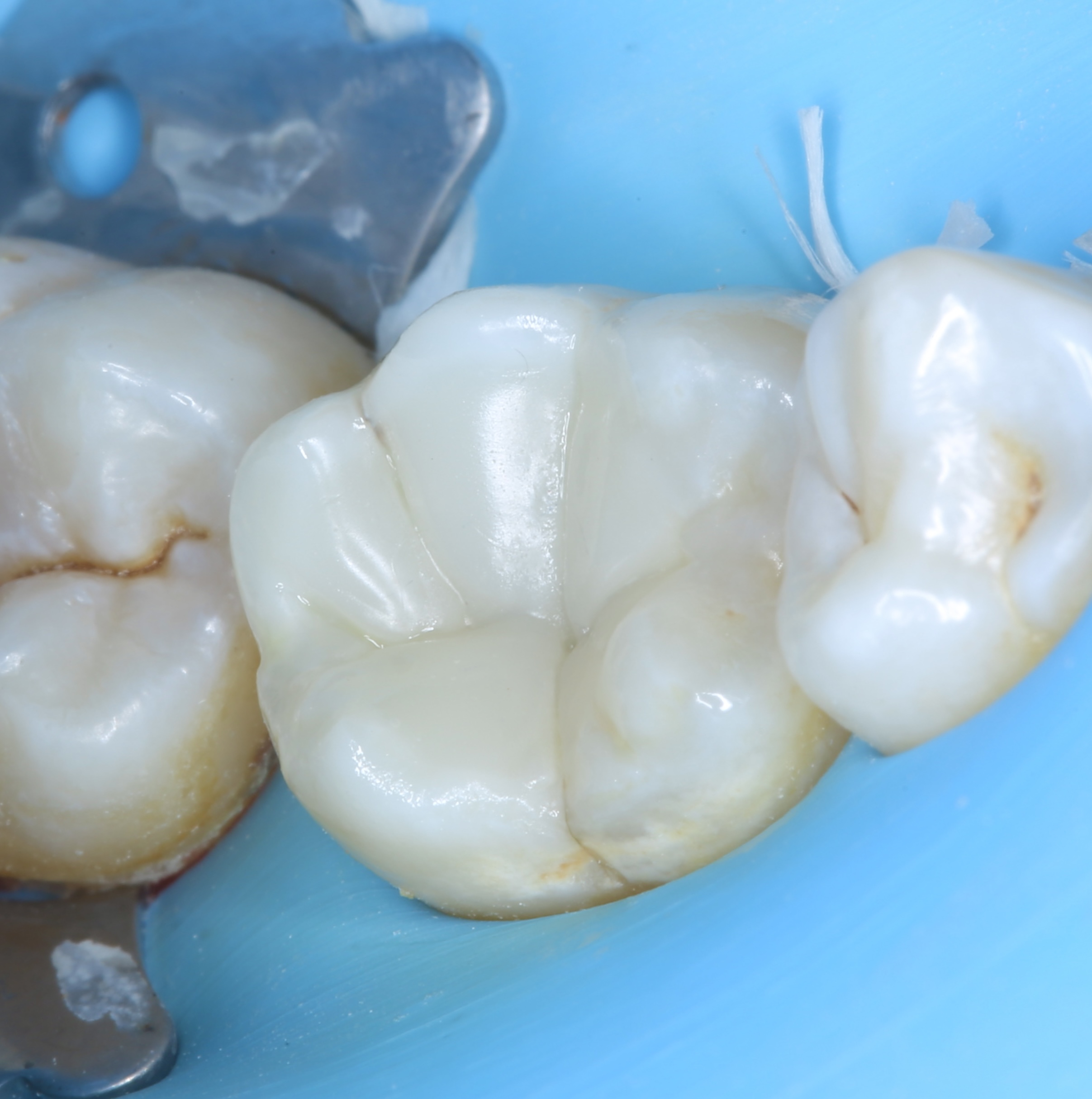
Patient de sexe masculin âgé de 26 ans présentant une fêlure verticale excentrée du côté lingual de sa
dent 36 restaurée par un amalgame occlusal. La dent est asymptomatique. Elle répond normalement au test au froid et négativement aux tests de percussion et de mordu.
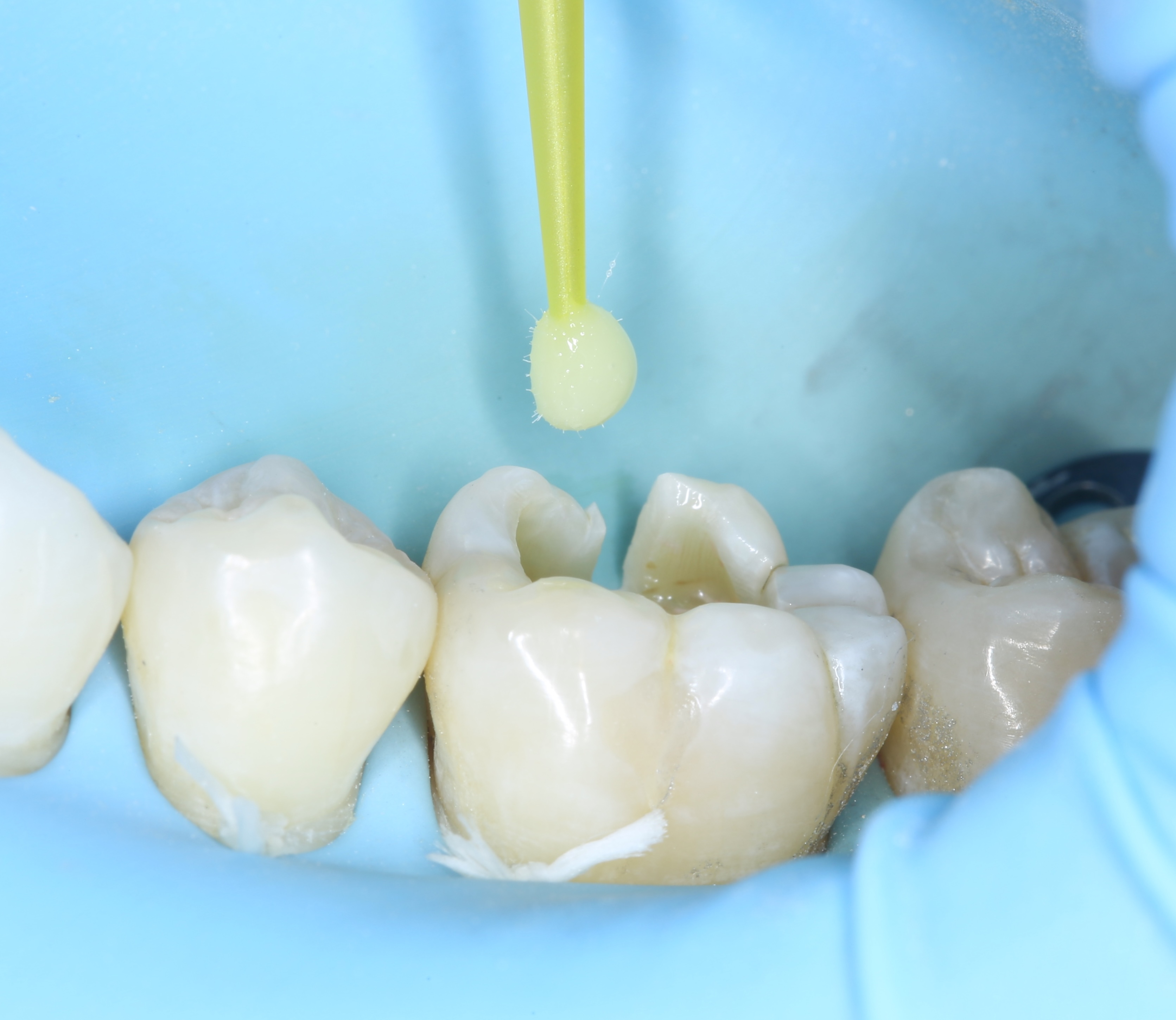
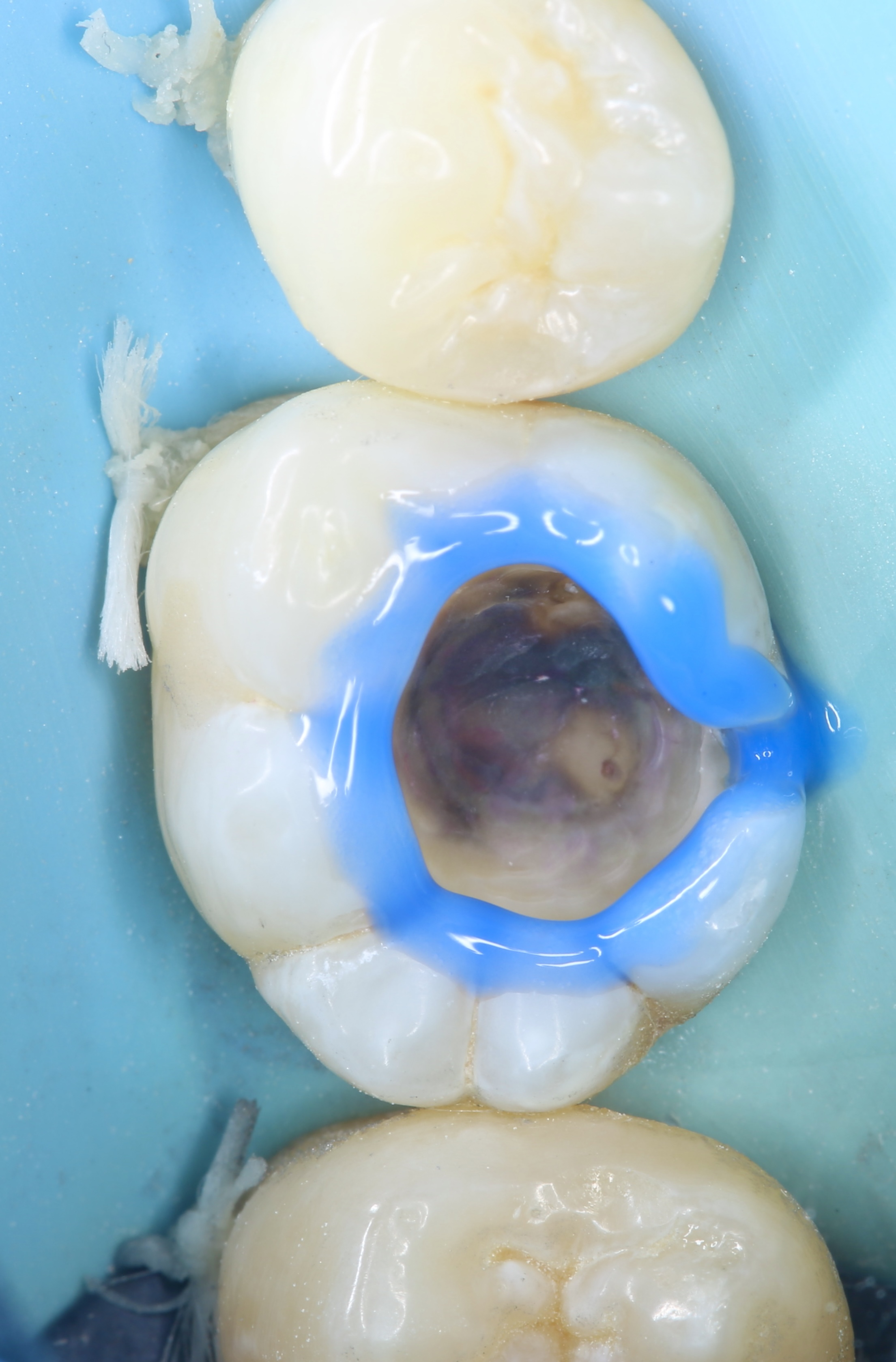
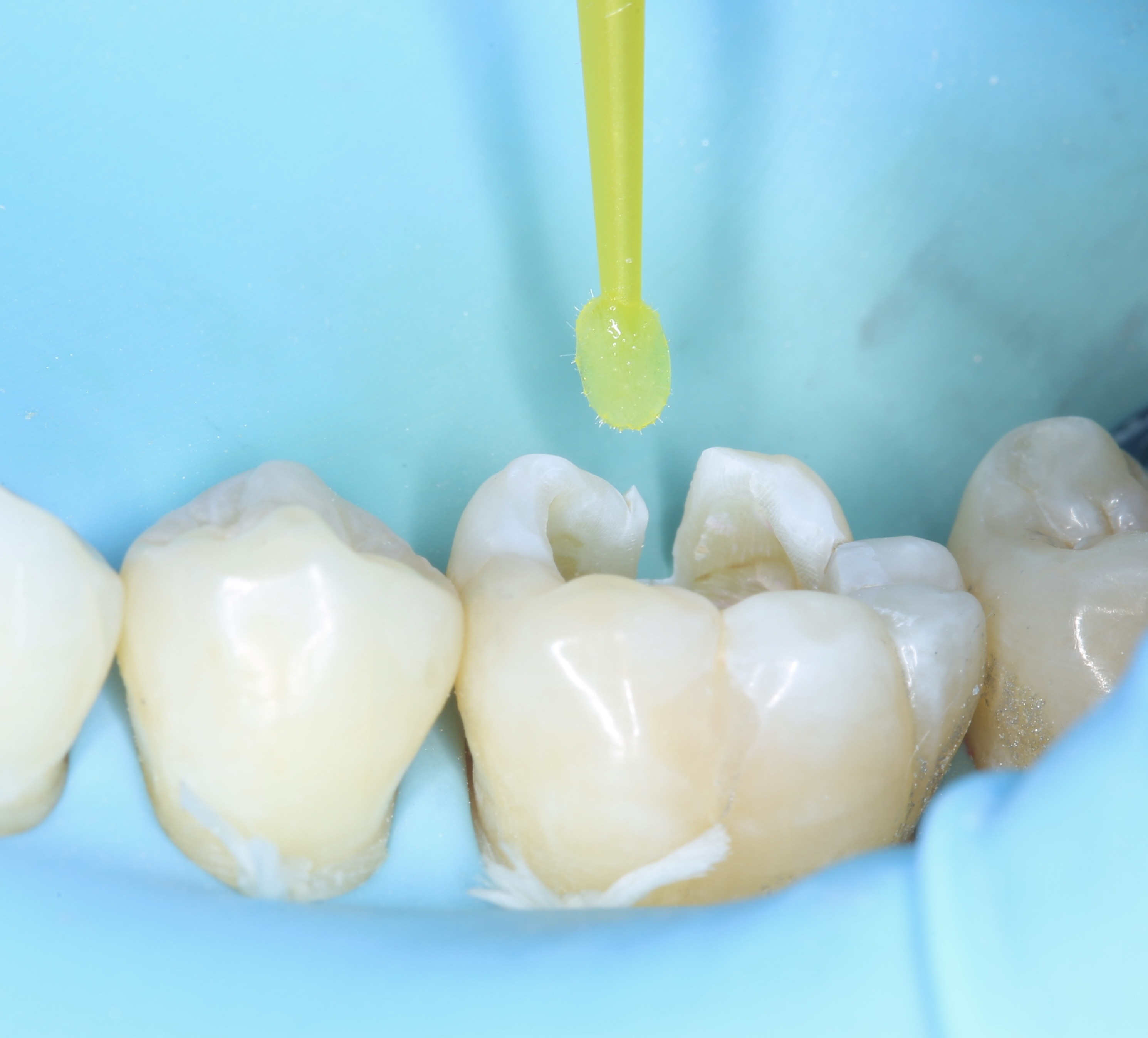
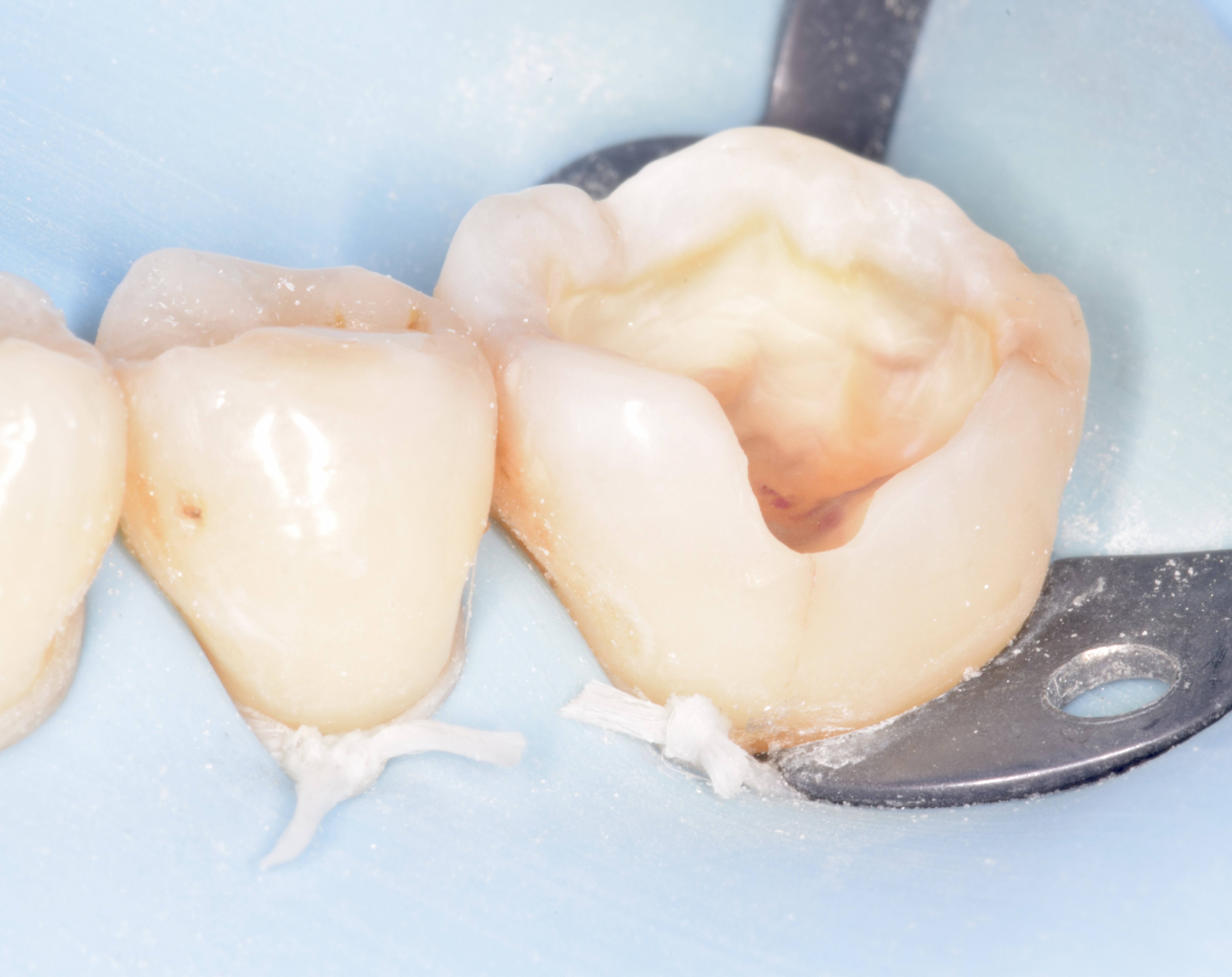
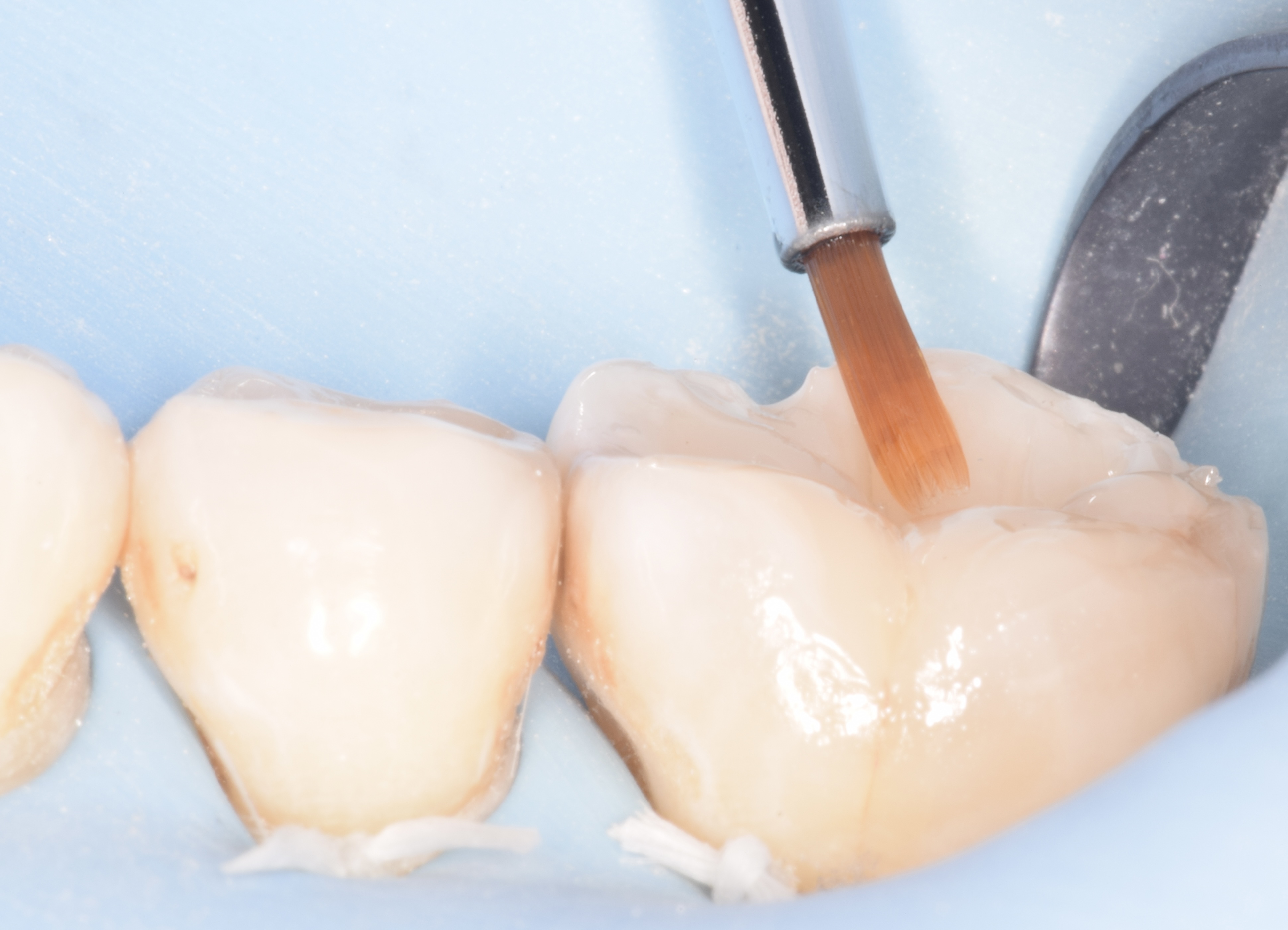
Figures 8, 9, 10 : protocole de collage en 3 étapes avec le système Optibond Fl (Kerr®) : « Etching » à l’acide orthophosphorique 37 % – Primer – Bonding
Nb : afin de respecter les bons temps de traitement à l’acide orthophosphorique (30 secondes sur l’émail, 10-15 secondes sur la dentine), seule la photographie du « etching » amélaire apparaît.
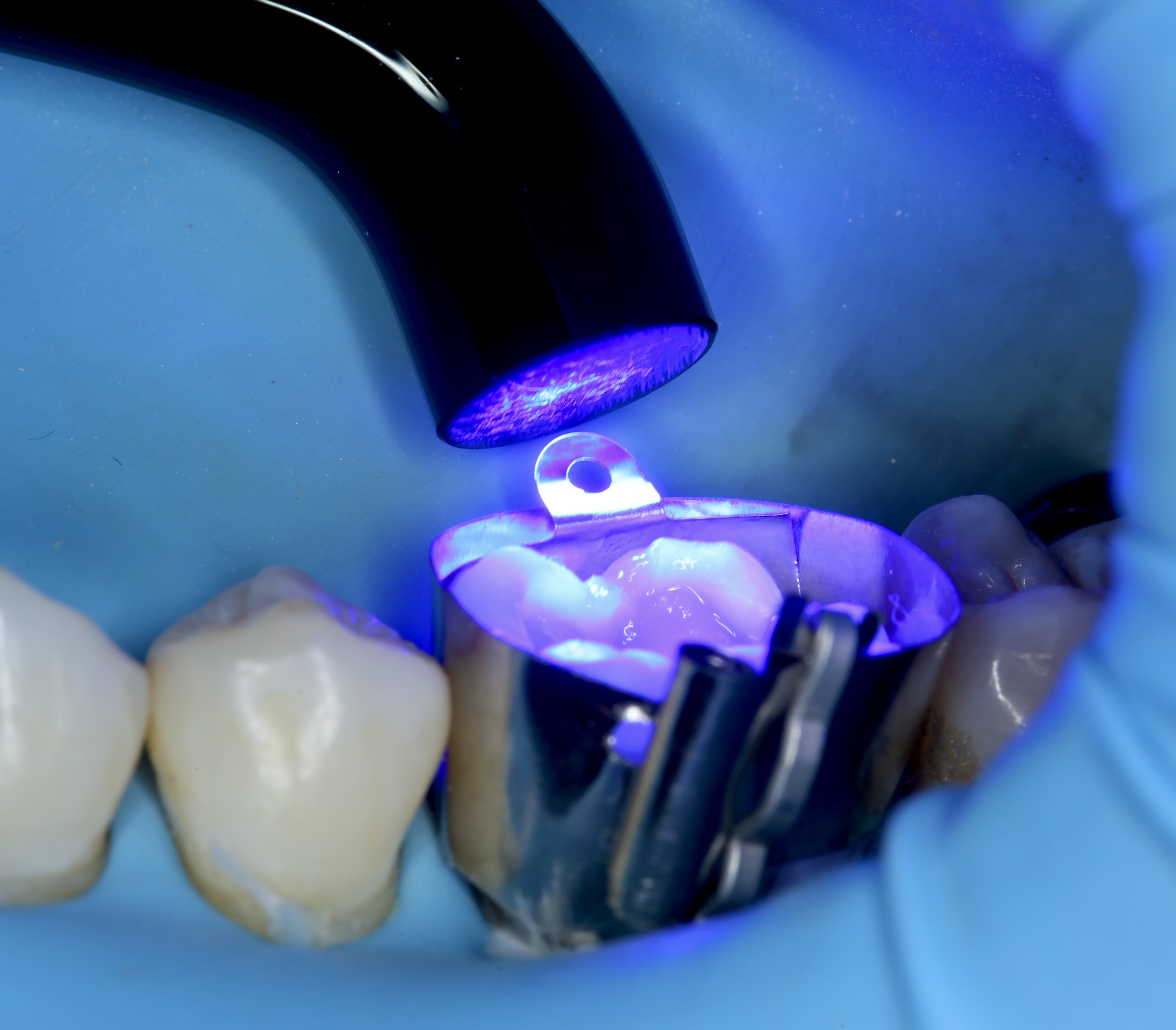
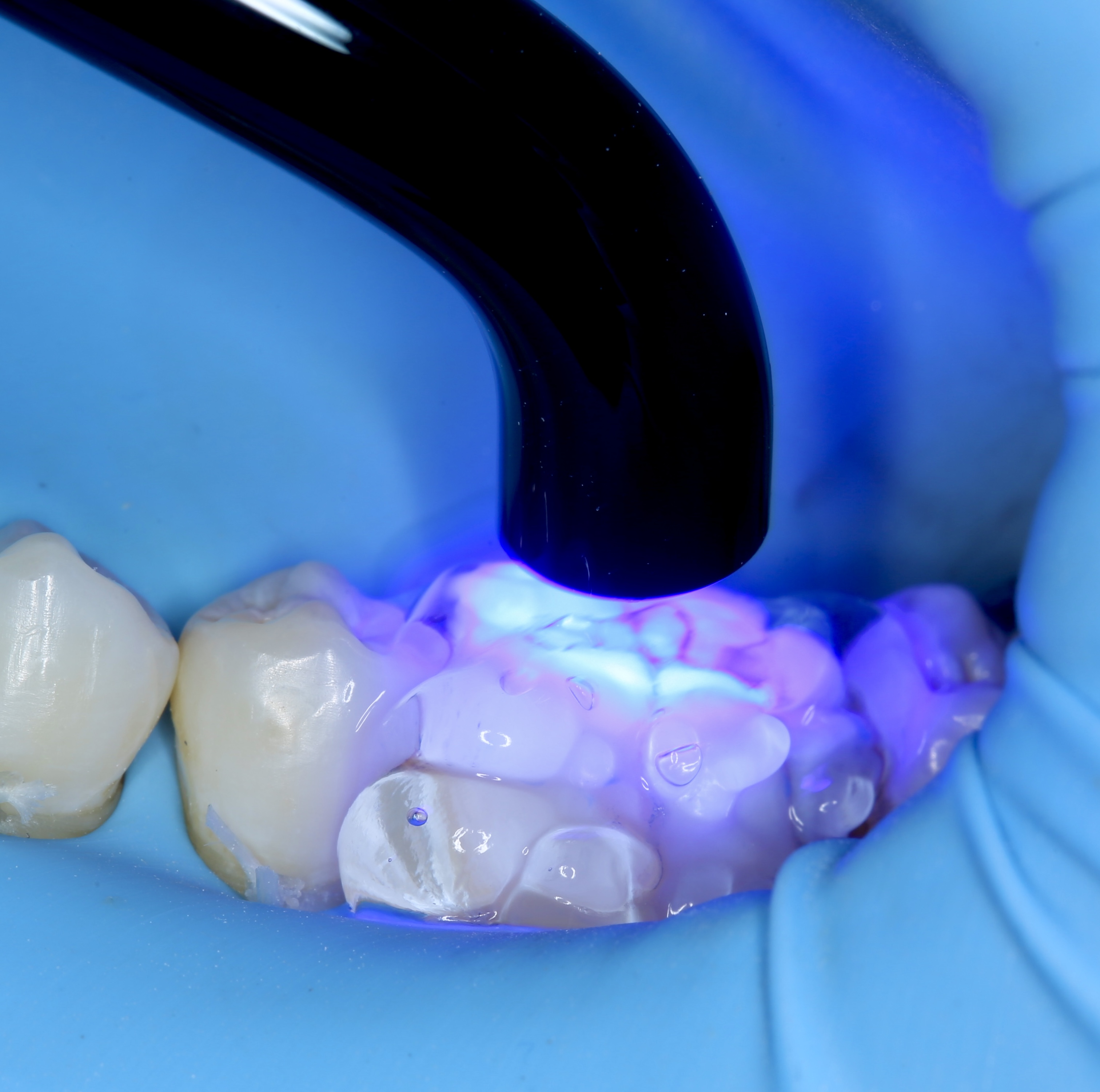
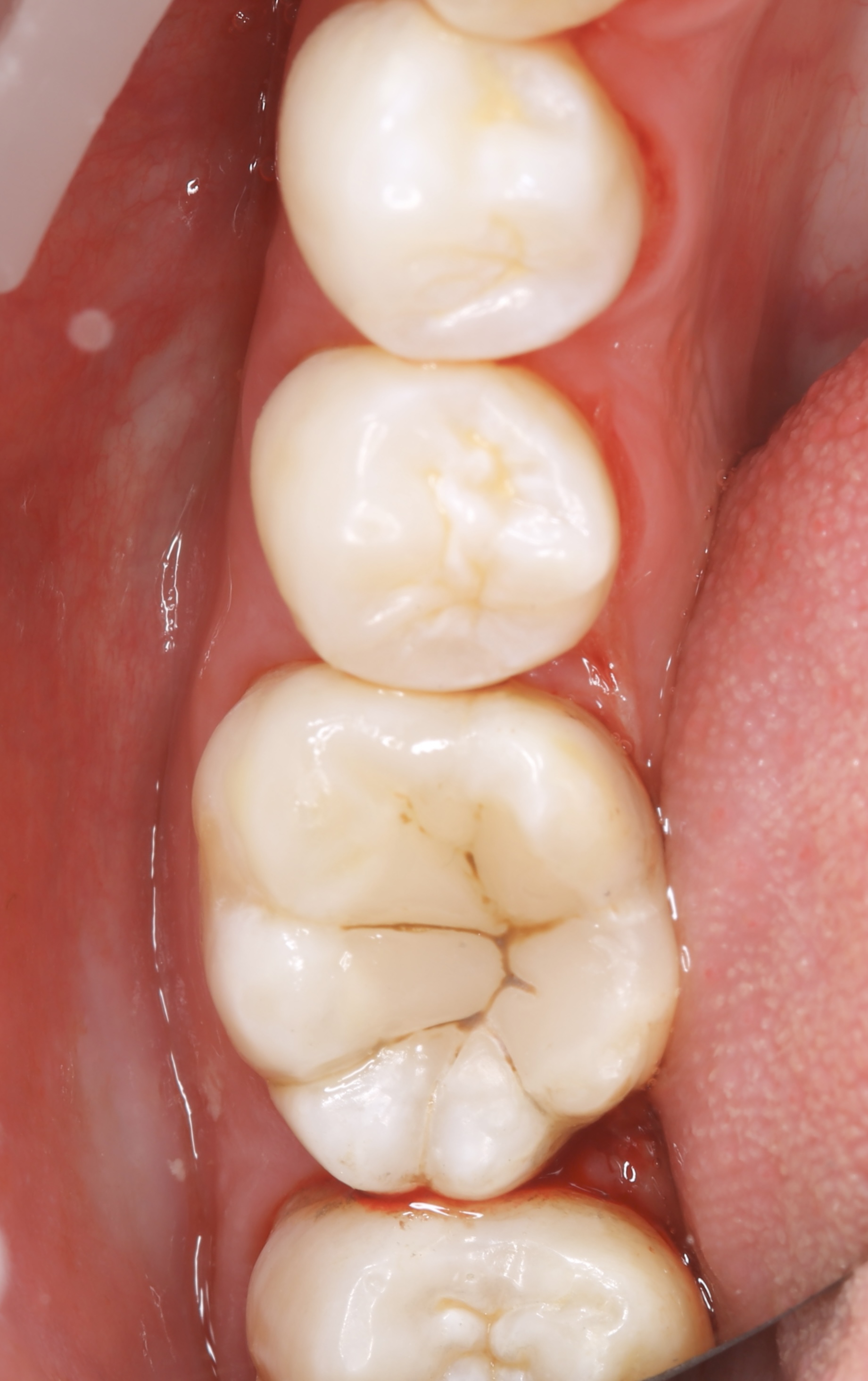
Figures 11, 12, 13 : double-matriçage, protocole de montage du composite (utilisation d’Ever X flow dentin shade (GC®) pour la partie dentinaire et de composite Inspiro enamel skin neutral (Edelweiss®) pour la partie linguale externe et la partie occlusale, photopolymérisation.
CAS CLINIQUE N°2
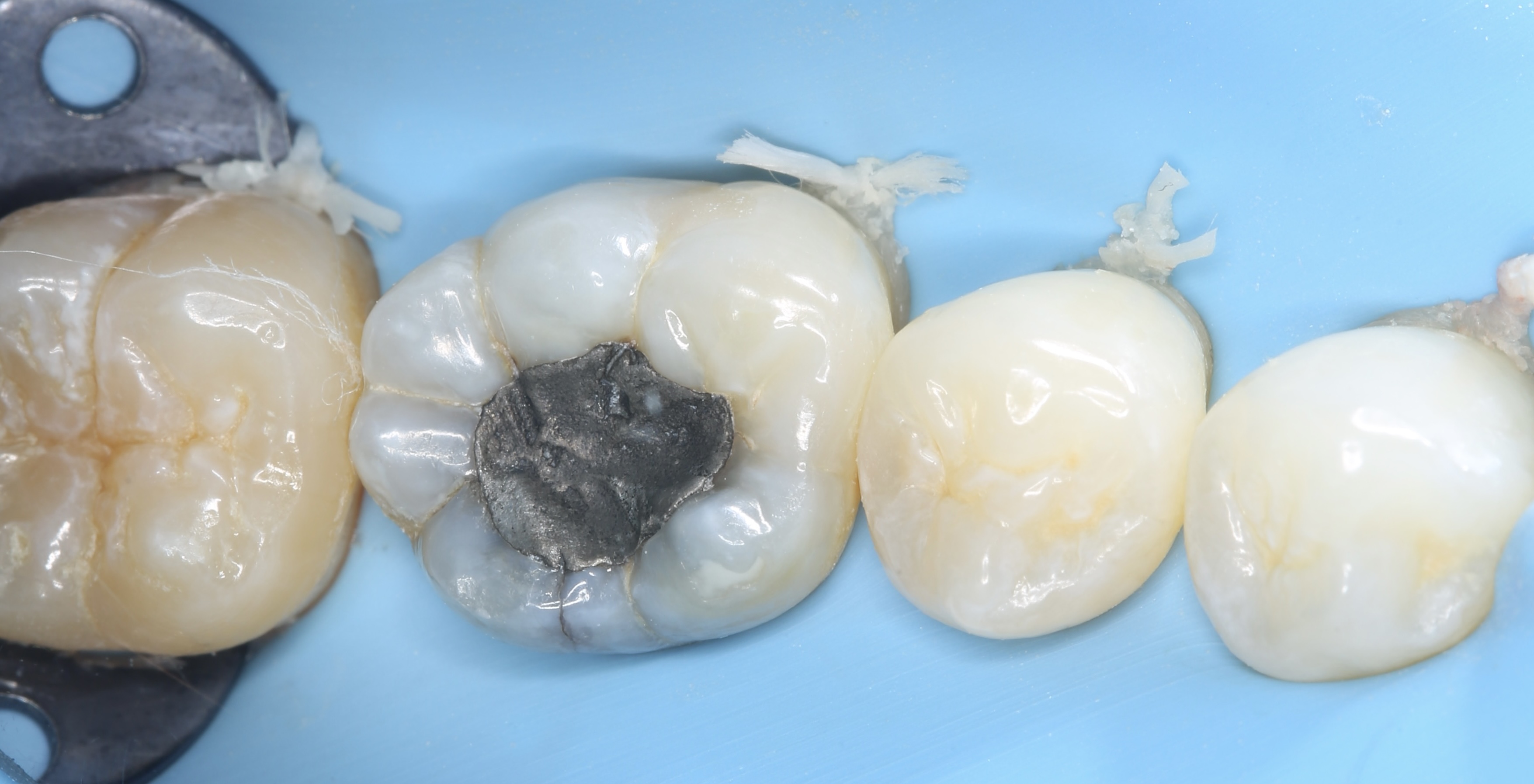
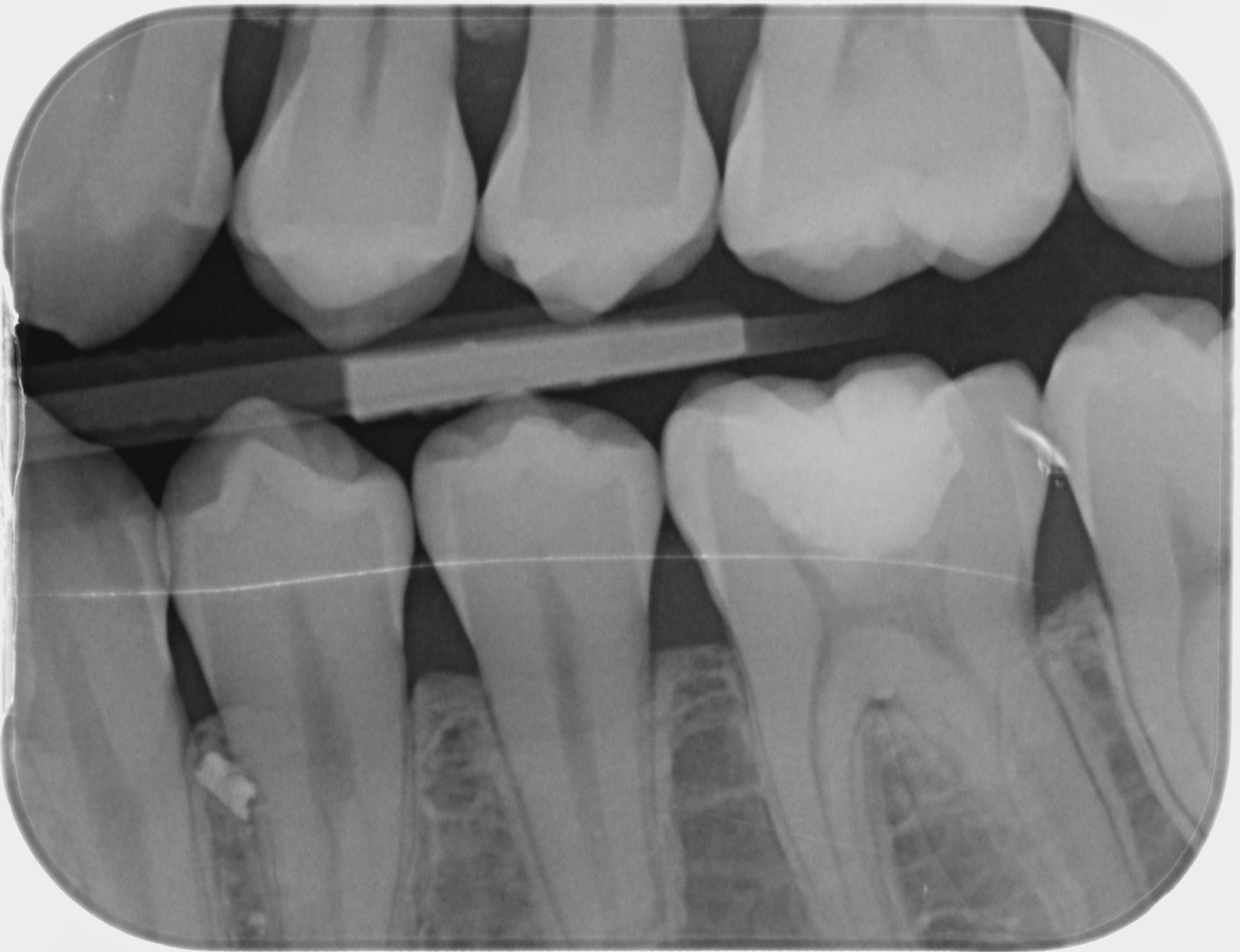
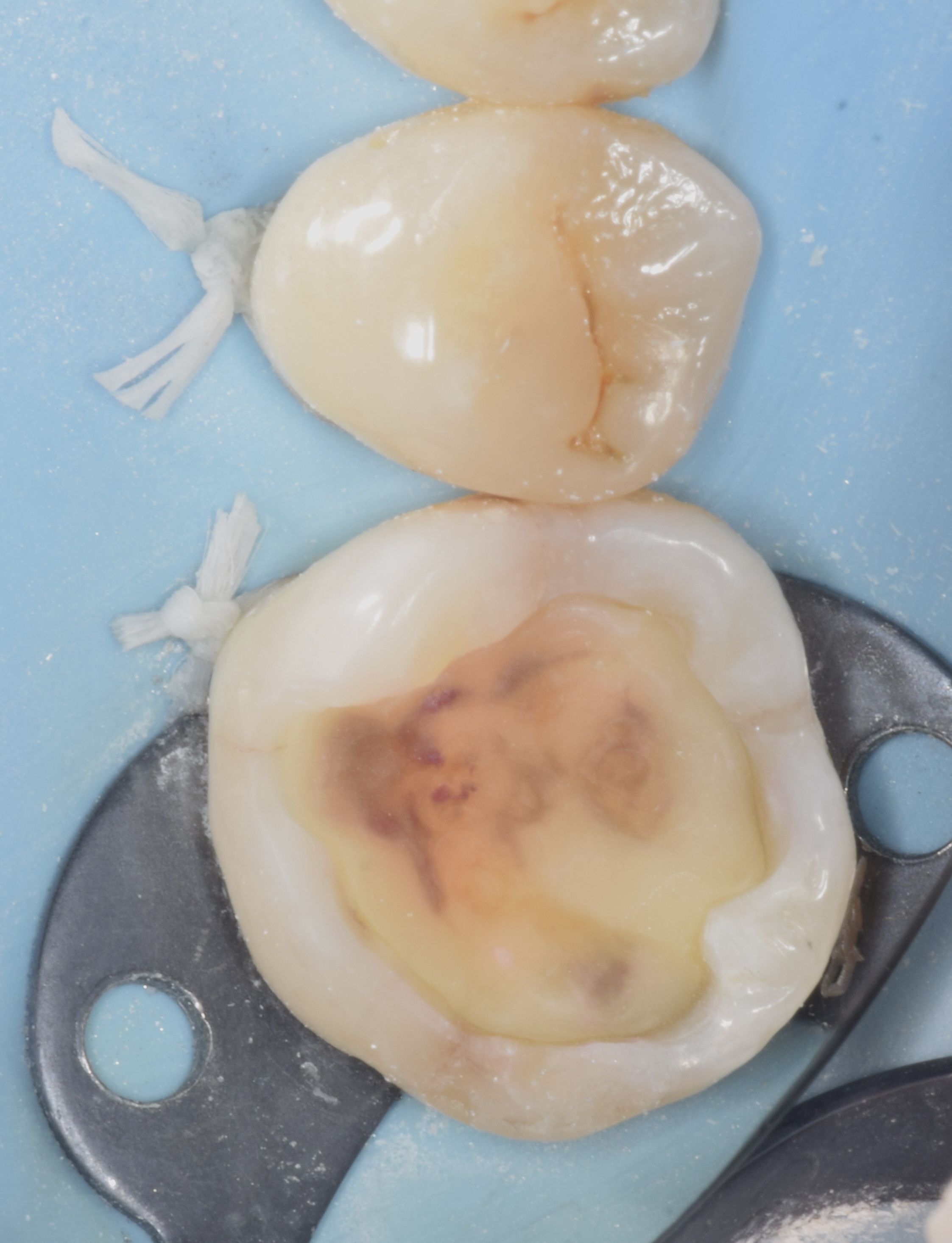
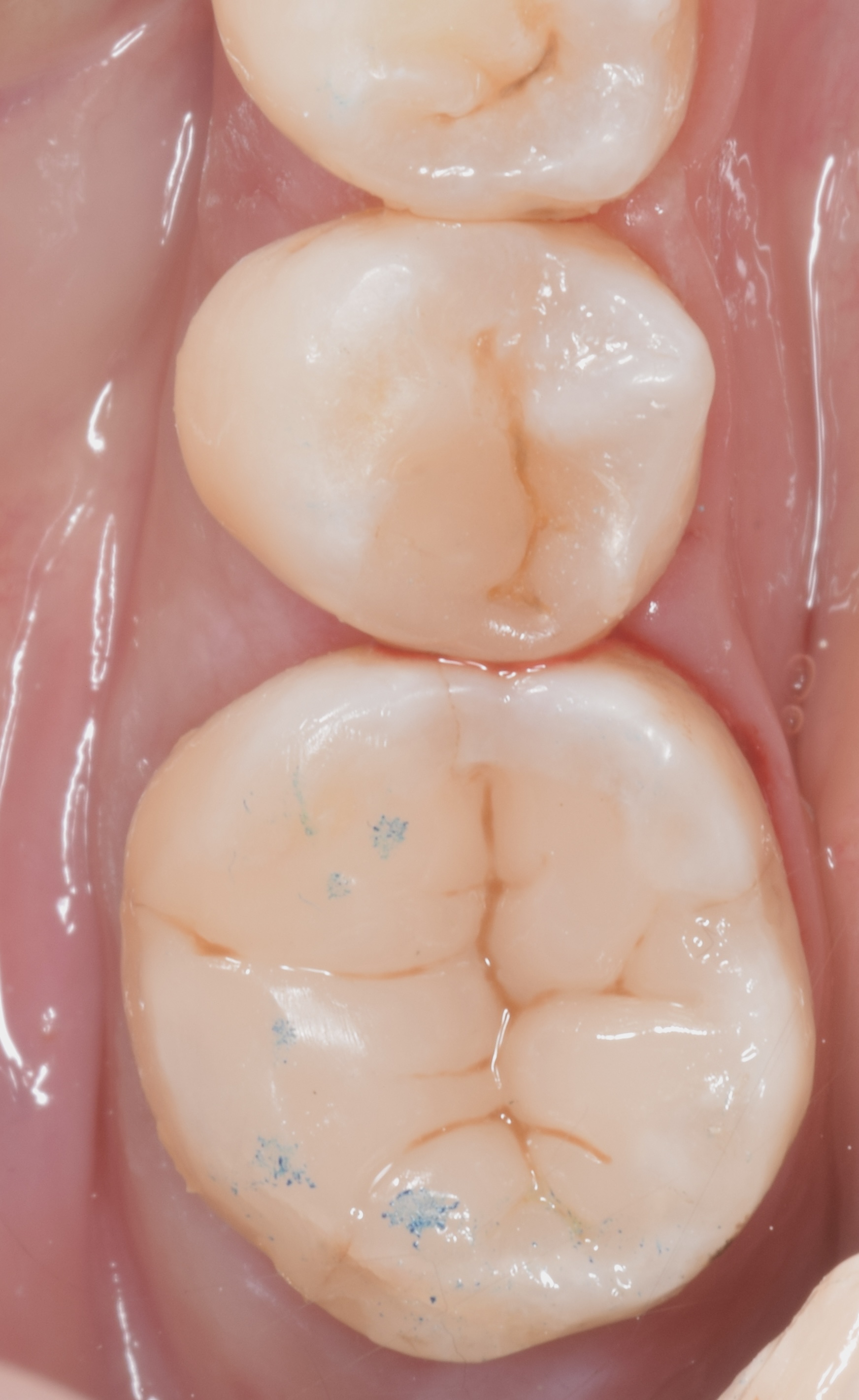
Patiente de sexe féminin âgée de 37 ans. La dent 36 est restaurée par un amalgame et présente de multiples fêlures qui s’évadent aux abords de la restauration et notamment une fêlure principale du côté vestibulaire. La dent est asymptomatique. Elle répond normalement au test au froid et négativement aux tests de percussion et de mordu.
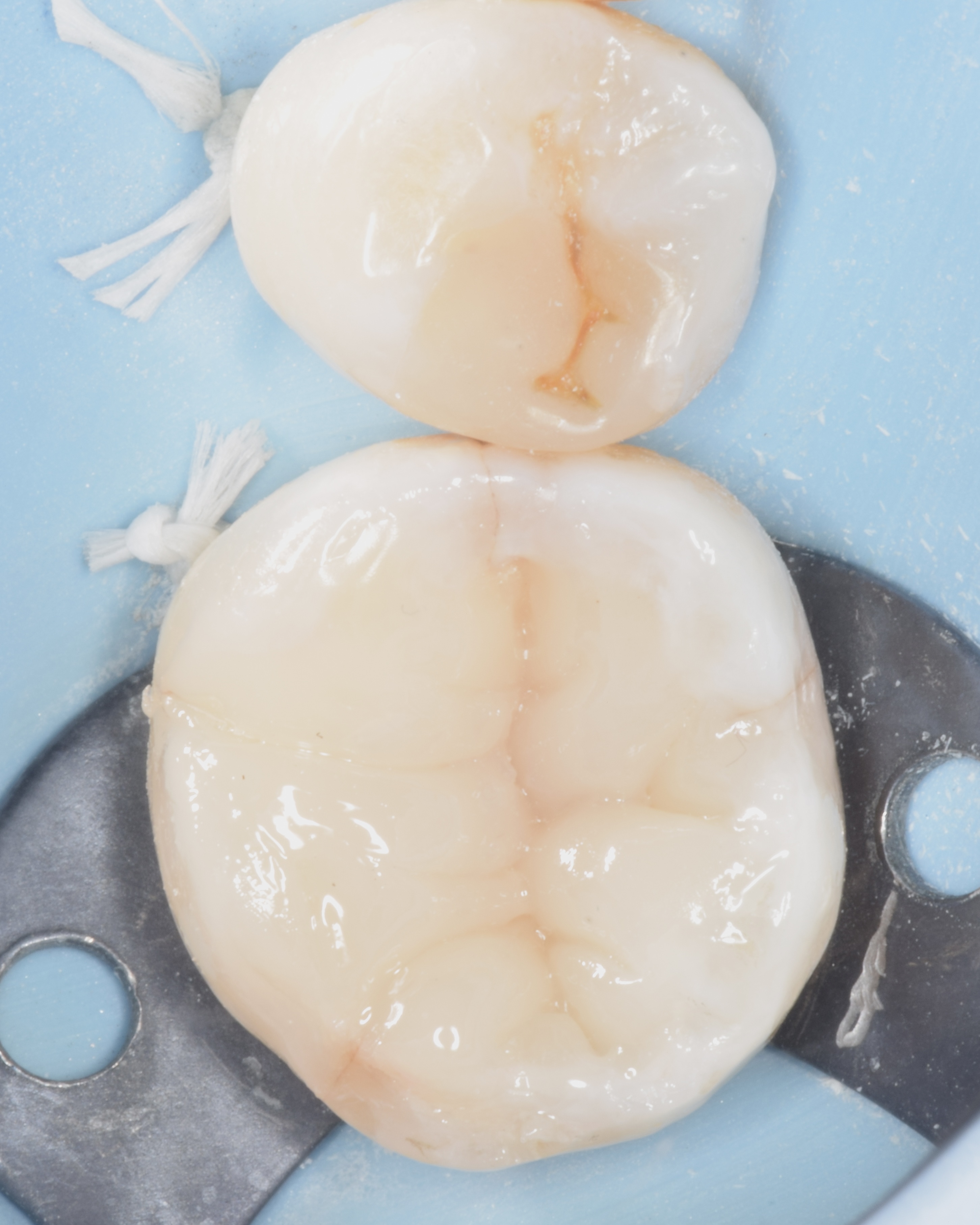
Figures 25, 26, 27 : protocole de montage du composite (Ever X flow dentin shade (GC®) pour la partie dentinaire et Inspiro enamel skin neutral (Edelweiss®) pour la partie amélaire.
CAS CLINIQUE N°3
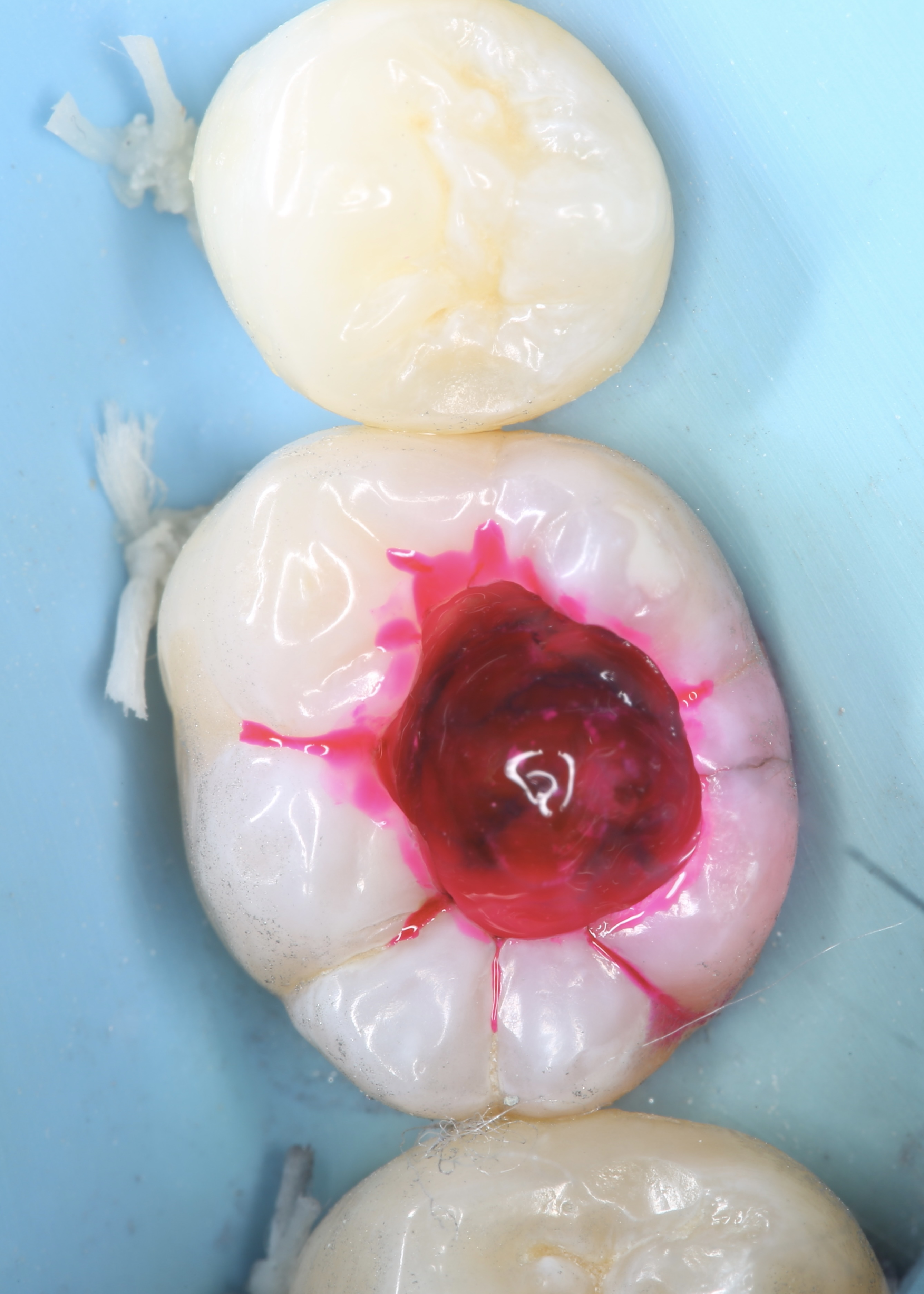
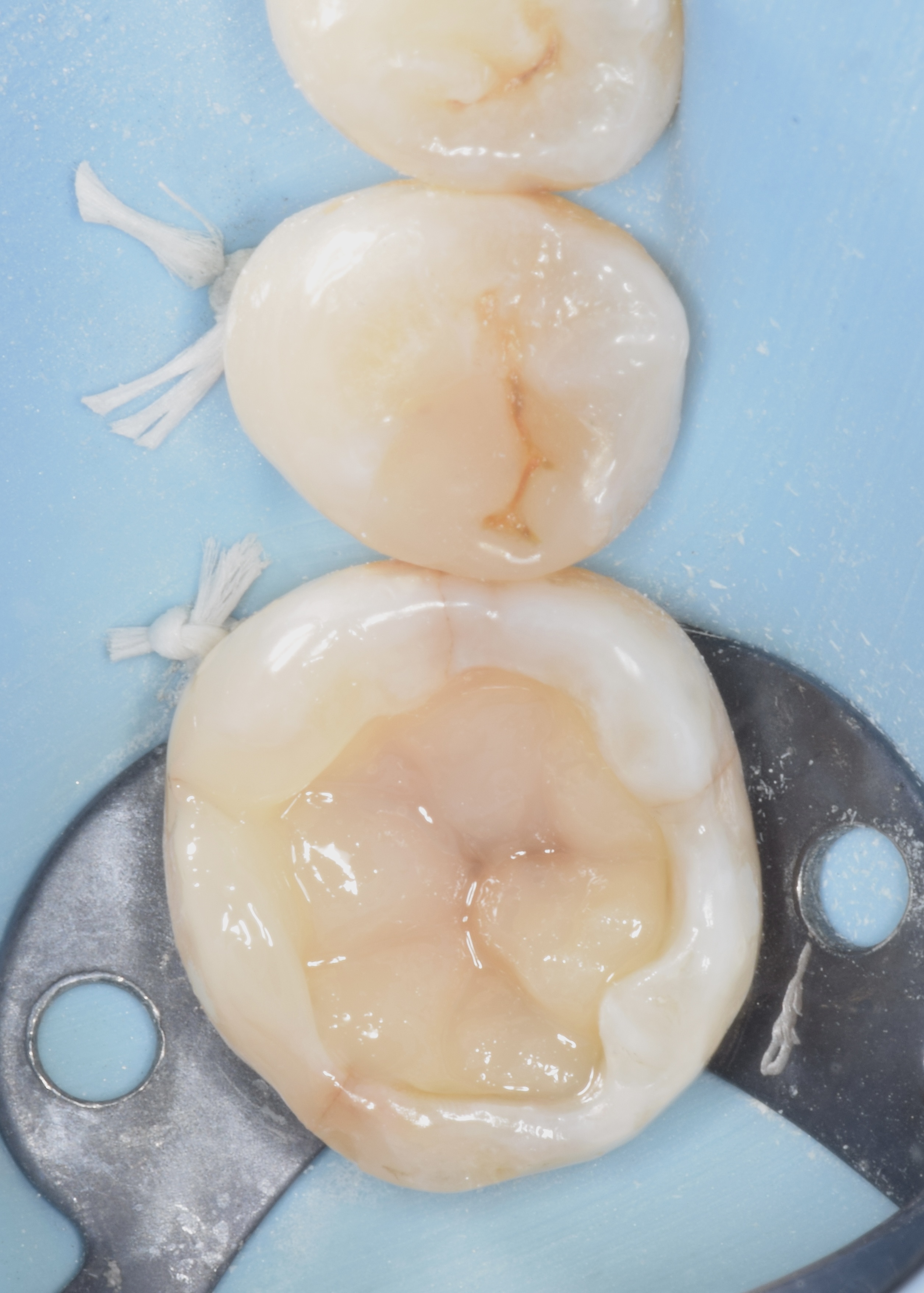
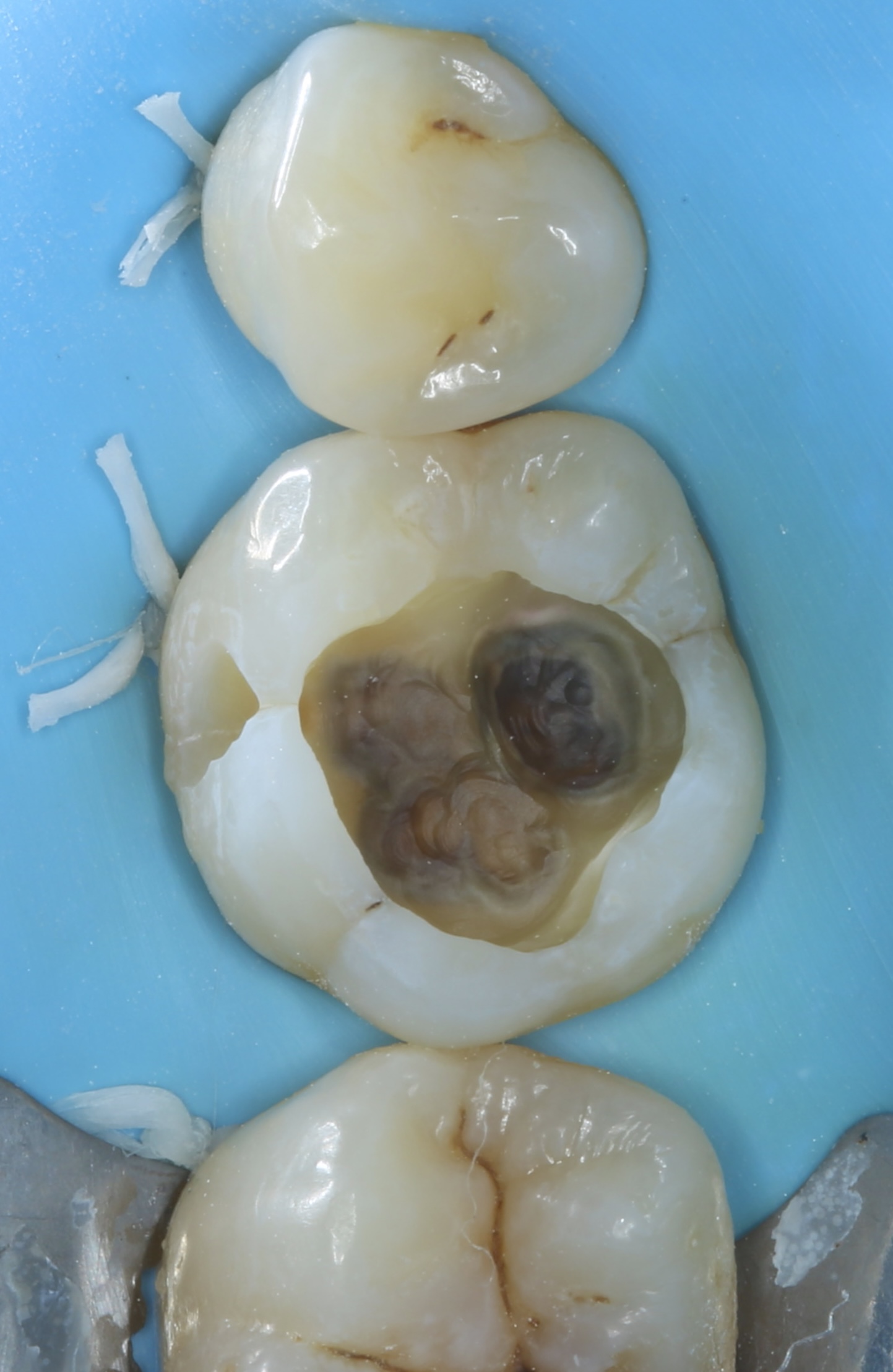
Patiente de sexe féminin âgée de 39 ans. Dent 36 anciennement restaurée avec un composite. L’intégrité de la restauration et des joints ainsi que la présence d’une sensibilité accrue au froid indique la réfection de la restauration. Le test au froid est normal. Les tests de mordu et de percussion sont normaux également.
Une sensibilité accrue et non-spontanée au froid est le seul symptôme relevé lors de l’interrogatoire clinique.
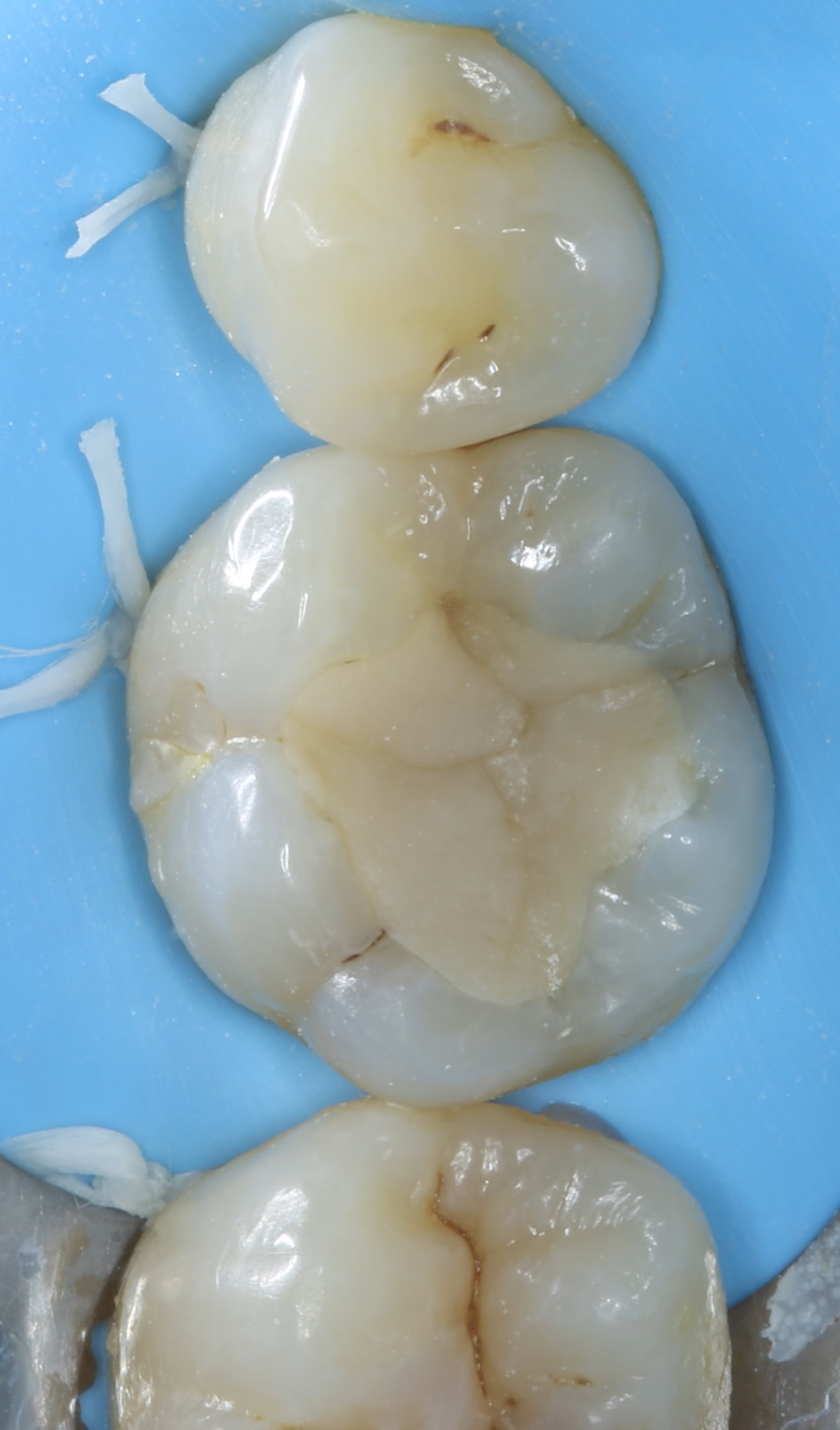
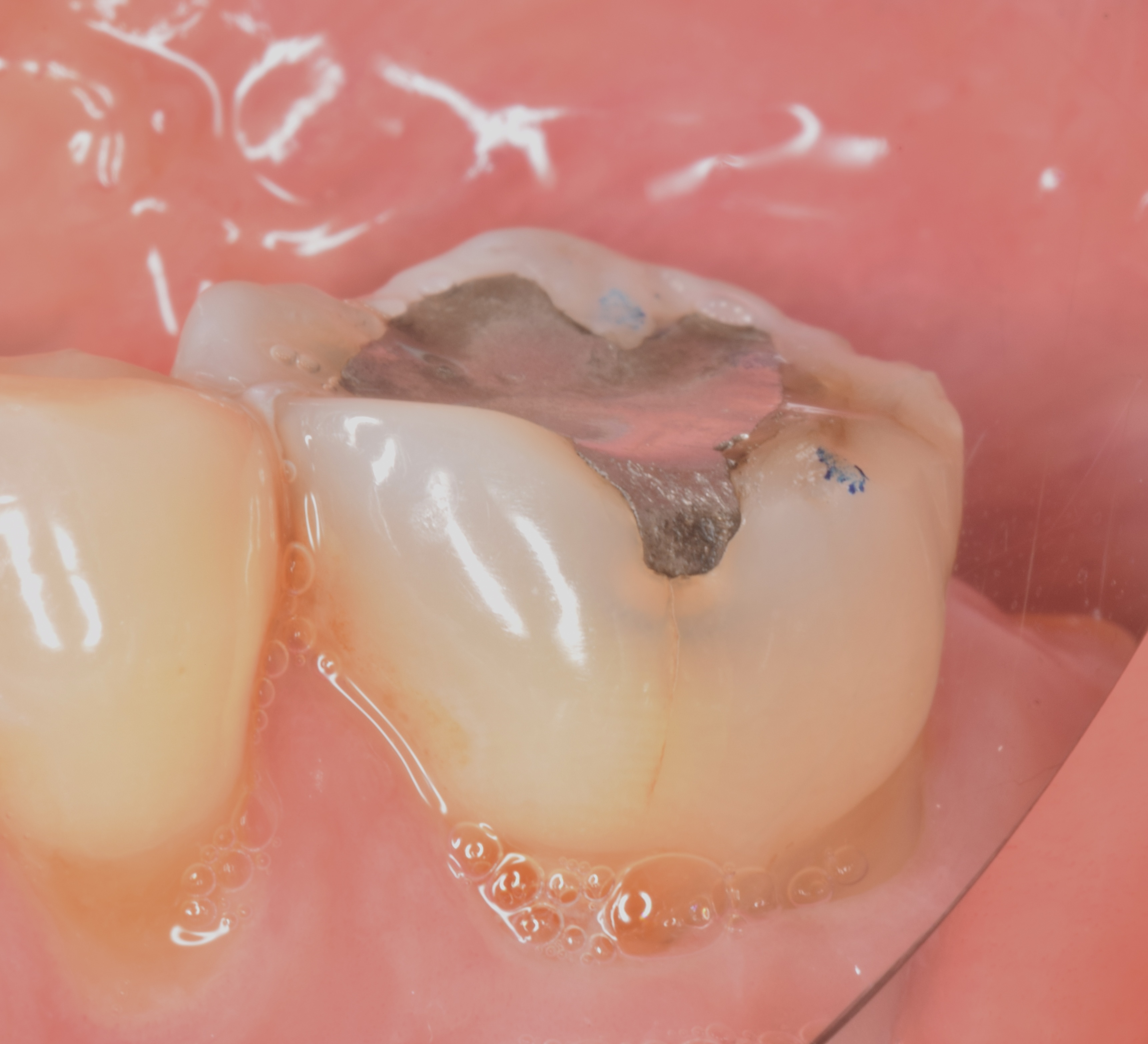
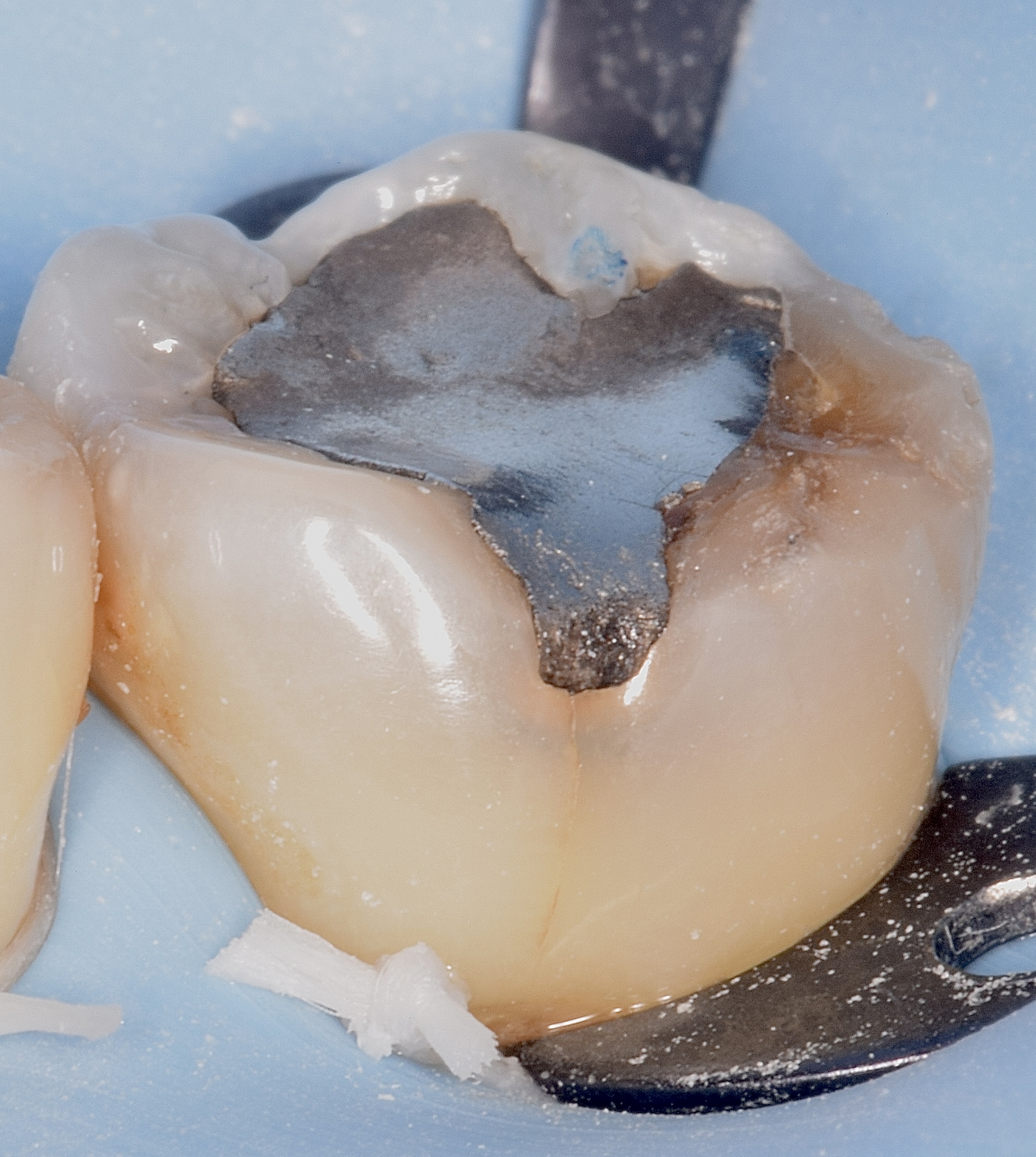
Figures 31, 32 : situation pré-opératoire et après dépose de l’ancienne restauration. A souligner la présence d’une fêlure oblique au niveau de la cuspide disto-linguale.
CONCLUSION
Comprendre les enjeux des fêlures permet d’y répondre avec plus de justesse et moins d’appréhension.
Pendant longtemps la problématique des fêlures suggérait la mise en place systématique d’une couronne périphérique, parfois au détriment collatéral des structures dentaires saines. Si à ce jour, l’adhésion, à elle seule, ne permet pas de répondre pleinement à cette problématique, elle permet néanmoins la différenciation de ses approches.
Ainsi, des dents présentant des fêlures excentrées et peu pénétrantes (régulièrement retrouvées sous d’anciennes restaurations), voire certaines fêlures cuspidiennes obliques, peuvent bénéficier d’une préservation optimale de leur structure saine par la réalisation de protocoles d’adhésion et de restauration directe en composite.
Bien que les innovations technologiques des composites soient nombreuses, et que les matériaux renforcés en fibres de verre fassent l’objet d’un engouement particulier, le praticien ne peut se soustraire à certains principes biomécaniques de base qui guideront sa réflexion dans la mise en oeuvre de ses thérapeutiques.
A contre-courant d’une volonté indémodable de protocoles plus simples et plus rapides, la manipulation des composites requiert, encore et toujours, patience et attention aux détails.
BIBLIOGRAPHIE
- Cameron, C. E. (1964). Cracked-tooth syndrome. The Journal Of The American Dental Association, 68(3), 405‑411.
- Rivera E, Walton RE. Cracking the cracked tooth code: detection and treat- ment of various longitudinal tooth fractures. Am Assoc Endod Colleagues Excellence News Lett 2008;2:1–19.
- Pacquet, W., Delebarre, C., Browet, S., & Gerdolle, D. (2022). Therapeutic strategy for cracked teeth. PubMed, 17(3), 340‑355.
- Bechtle, S., Fett, T., Rizzi, G., Habelitz, S., Klocke, A., & Schneider, G. A. (2010). Crack arrest within teeth at the dentinoenamel junction caused by elastic modulus mismatch. Biomaterials, 31(14), 4238‑4247.
- Nakabayashi, N., Kojima, K., & Masuhara, E. (1982). The promotion of adhesion by the infiltration of monomers into tooth substrates. Journal Of Biomedical Materials Research, 16(3), 265‑273.
- Nakabayashi, N., Nakamura, M., & Yasuda, N. (1991). Hybrid Layer as a Dentin‐Bonding Mechanism. Journal Of Esthetic And Restorative Dentistry, 3(4), 133‑138. 17
- Milicich G. The compression dome concept: the restorative implications. Gen Dent 2017;65:55–60.
- Magne, P., & Ubaldini, A. L. M. (2020). Thermal and bioactive optimization of a unidose 3-step etch-and-rinse dentin adhesive. The Journal Of Prosthetic Dentistry/The Journal Of Prosthetic Dentistry, 124(4), 487.e1-487.e7.
- Urabe I,Nakajima ,SSano ,HTagami J.Physical properties of the dentin-enamel junction region. Am JDent. 2000;13(3):129-135.
- Braga, R., Ballester, R., & Ferracane, J. (2005). Factors involved in the development of polymerization shrinkage stress in resin-composites : A systematic review. Dental Materials, 21(10), 962‑970.
- Burrer, P., Par, M., Fürer, L., Stübi, M., Marovic, D., Tarle, Z., Attin, T., & Tauböck, T. T. (2023). Effect of polymerization mode on shrinkage kinetics and degree of conversion of dual-curing bulk-fill resin composites. Clinical Oral Investigations, 27(6), 3169‑3180.
- Soares, C. J., Faria-E-Silva, A. L., De Paula Rodrigues, M., Vilela, A. B. F., Pfeifer, C. S., Tantbirojn, D., & Versluis, A. (2017). Polymerization shrinkage stress of composite resins and resin cements – What do we need to know ? Brazilian Oral Research, 31(suppl 1).
- Alshabib, A., Jurado, C. A., & Tsujimoto, A. (2022b). Short fiber-reinforced resin-based composites (SFRCs) ; Current status and future perspectives. Dental Materials Journal, 41(5), 647‑654.
- Ilie, N., Jelen, E., & Hickel, R. (2009). Is the soft-start polymerisation concept still relevant for modern curing units ? Clinical Oral Investigations, 15(1), 21‑29.
- How should composite be layered to reduce shrinkage stress : Incremental or bulk filling ? (2009). The Journal Of Prosthetic Dentistry/The Journal Of Prosthetic Dentistry, 101(3), 192.
- Kaisarly, D., Gezawi, M. E., Keßler, A., Rösch, P., & Kunzelmann, K. (2020). Shrinkage vectors in flowable bulk-fill and conventional composites : bulk versus incremental application. Clinical Oral Investigations, 25(3), 1127‑1139.