Les régénérations osseuses sont un des fondamentaux de la pratique implantaire moderne.
Si aux balbutiements de l’implantologie, la tendance était de n’implanter que dans l’os présent, résiduel ou néoformé spontanément par le patient, la pratique actuelle bénéficie d’un recul considérable sur tout ce qui a pu être tenté pour limiter les résorptions ou permettre de régénérer un volume de tissus osseux… qualitatif dans l’idéal !
Dans ce domaine d’excellence que constitue la régénération osseuse, nous sommes confrontés à des contrastes marqués, entre techniques élitistes et apologies de recettes fantasques vantant des solutions cliniques peu fiables faisant appel à certains biomatériaux au comportement biologique aléatoire.
Un tel contraste dans l’univers de la chirurgie orale peut s’expliquer par le contexte historique (un retard de pratique, mise en avant des stratégies d’évitement des reconstructions : les graftless solutions, un manque de formation, …), le caractère extrêmement multifactoriel qui influence les résultats, et peut-être principalement des biais cognitifs d’ancrage et de paralogisme.
On a longtemps cru que le problème des résorptions serait résolu par la technique et le bon choix du biomatériau, en restreignant des mécaniques physiologiques complexes à de la simple mécanique.
Comme pour tous les autres aspects du domaine de la chirurgie, les causes et analyses ne sont jamais binaires, et dans notre univers opaque où la transparence sur le vrai des techniques toujours plus « markettées » n’existe que trop peu, le flou est décuplé par la variabilité des configurations cliniques et les aspects de praticien-dépendances et de patient-dépendances qui sont majeurs. Cet ensemble de variables multi-factorielles complexes et intriqués rend difficile aux praticiens de faire la part des choses.
Cet article ne pourra être exhaustif par soucis de clarté, mais également parce que tout n’est pas décodé. S’il est possible de lire autrement les mécanismes sous-jacents, s’il est possible d’affirmer que telle théorie n’est plus une explication acceptable, il n’est pas pour autant possible de décoder et décrire de nouvelles explications pour tout. Parfois, l’observation sera la seule clef pour rester dans le réel, fût-il dogmatique ou pas. Nous tâcherons de redonner les clefs d’une compréhension inclusive des ROG et prodiguerons des conseils reproductibles. Cette relecture des ROG basée sur 24 ans d’expérience, de nombreuses analyses histologiques, et l’utilisation d’une diversité de biomatériaux et techniques pourra paraître quelque peu divergente vis à vis de l’approche historique, et c’est bien normal. Mais le recul et la critique constructive n’a rien d’un dénigrement de l’histoire et de ceux qui ont osé et décodé les premiers.
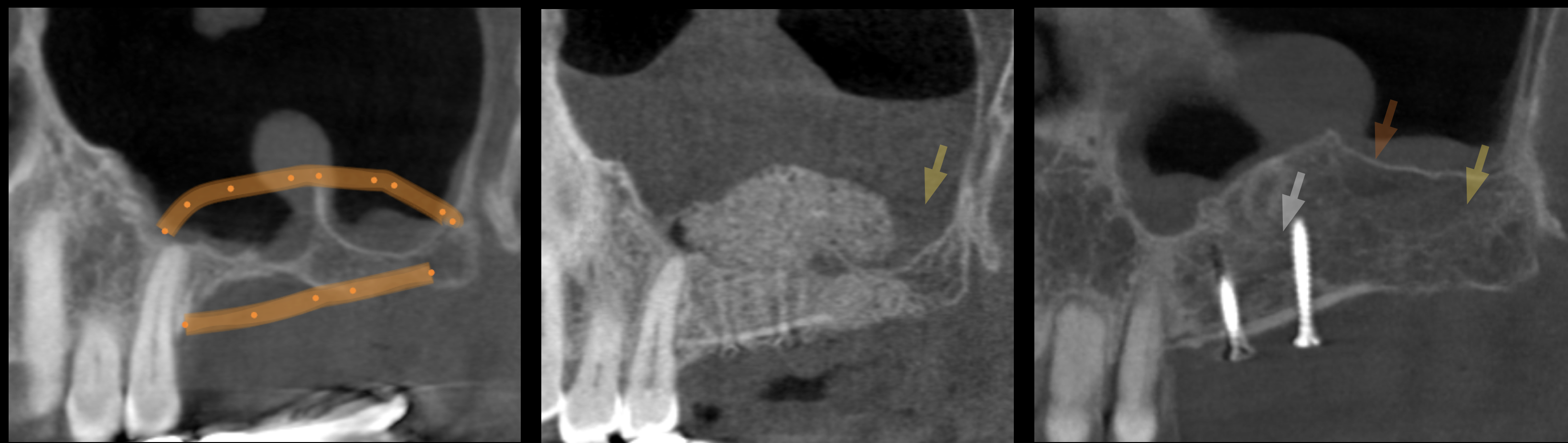
Fig. 1 : signes radiologiques de cicatrisation osseuse dans une ROG et Sinus lift simultané.
• 1a : image pré-opératoire: perte de volume crestal • 1b : image post-opératoire j0 : mise en place de Biobank Cortico-spongieux et d’une lame allogénique stabilisée par 2 vis. L’aspect de poudre est visible. • 1c : image de la cicatrisation osseuse à 6 mois : néo-corticale, trabéculations dans la masse, disparition de l’ancienne corticale signent la qualité de l’os néoformé et du turn-over par le patient.
Alors c’est avec un profond respect que je tiens à rendre tout d’abord hommage à tous les pionniers des régénérations osseuses, des hollandais du 17ème siècle aux plus récents praticiens et chercheurs qui ont pensé et trouvé comment préparer et utiliser des substituts synthétiques, xénogéniques ou allogéniques intégrables.
Si les théories d’exclusion cellulaires et des besoins de membranes semblent pouvoir être dépassés grâce à cette approche actuelle, il n’en reste pas moins que les dogmes fondamentaux décodés par les précurseurs de la discipline sont encore le socle solide de nos thérapeutiques comme la sausage technique qui représente l’approche au ratio prévisibilité/morbidité/complications/indications la plus favorable.
Ainsi, cet article sera focalisé sur les sausage technique qui représentent 97 % de ma pratique.
D’autres auteurs vous décrieront les autres techniques comme, par exemple, la box autogénique du Dr Fouad Khoury qui représente une alternative extrêmement qualitative. Chaque praticien doit pouvoir faire son choix éclairé.
CRITERES OBJECTIFS D’UNE BONNE CICATRISATION OSSEUSE (ROG ou Pas !)
Les dernières décennies ont été focalisées sur la résorption et la stabilité du volume reconstruit. Le critère dimensionnel avait pris le pas sur le caractère qualitatif de la reconstruction.
Cet article est une invitation à inverser cette échelle d’évaluation, et pour ce, à hiérarchiser les signes de néoformation osseuse en priorité.
En pratique quotidienne, nous ferons donc un focus sur la radiomorphométrie, comprenons l’évolution de l’aspect radiologique de l’os au cours de la cicatrisation.
Ainsi une cicatrisation osseuse aboutie DOIT présenter 3 signes radiologiques pathognomoniques :
• une néo-corticale
• des trabéculations dans la masse (spongieux)
• la disparition de l’ancienne corticale.
Ces éléments se retrouvent cliniquement, mais l’évaluation de la néo-corticale et de la qualité du spongieux étant per-opératoire, ils viennent après.
Les aspects particulaires de surface signent une fibrose plus ou moins majeure, plus ou moins profonde.
Et l’histologie ?
Cette discipline essentielle, dont on ne prend conscience de l’importance parfois qu’en oncologie, est pourtant le moyen ultime de mieux comprendre ce que l’on voit cliniquement et radiologiquement.
L’histologie est le seul moyen d’analyser sérieusement les biomatériaux et les résultats.
Elle seule permet de voir à l’échelle cellulaire ce qui se passe, d’analyser s’il y a des cellules inflammatoires, d’observer l’ostéoconduction ou la cytotoxicité d’un substitut… La dimension cellulaire et l’examen de la relation entre les ostéoblastes et les biomatériaux est essentielle.
Rien ne peut la substituer. Face à la réelle simplicité de son analyse, il est regrettable de voir que nombre
de publications n’en présentent pas ou avec une analyse non aboutie.
Pour lire une histologie, repérez les travées osseuses néoformées, les particules, la moelle osseuse, les
noyaux cellulaires qui prennent la coloration…
Observez la qualité du « Bone to Particles Contact » qui signe la compétence biologique d’un biomatériau.
REGENERER DE L’OS ?
Le chirurgien ne régénère pas de l’os. Réaliser une ROG est « mettre en place un échafaudage qui permette au patient de cicatriser en synthétisant de l’os autour d’une matrice, généralement minérale ».
Nous n’insisterons jamais assez sur les mécanismes physiologiques qui sont à la source de ce que l’on s’attribue.
Intégrer que la synthèse d’os est omni-dépendante :
• la technique préserve plus ou moins la vascularisation, crée plus ou moins d’ischémie per opératoire,
• les biomatériaux sont plus ou moins ostéoinducteurs/ conducteurs/cytotoxiques/neutres…
• dépendante du patient, via des mécaniques complexes, certains connus, d’autres inconnus ou mal compris.
Le facteur patient doit nous ramener à notre notion d’analyse pré-opératoire qui s’est trop longtemps limitée à une mesure millimétrique du défaut à reconstruire. Ne pas s’intéresser réellement au terrain du patient parait bien inconscient. L’analyse scanner est essentielle, mais elle ne peut être décorrelée de l’analyse des facteurs de risque patients (stress, hygiène de vie…).
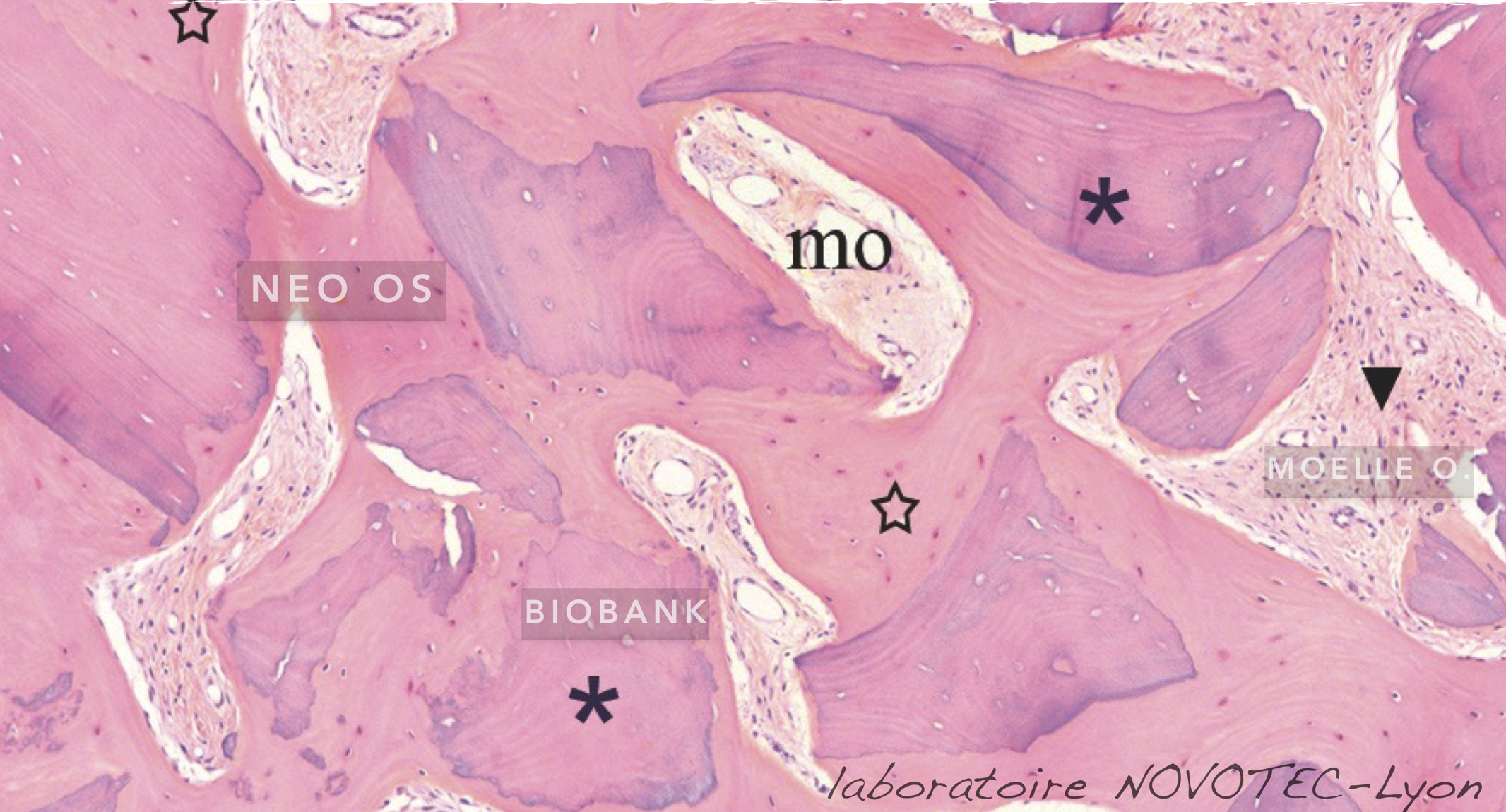
Fig. 2 : histologie témoignant d’une excellente cicatrisation osseuse d’un patient autour des particules d’allogreffe. Les particules (ici Biobank©) sont particulièrement bien ostéo-intégrées. La densité de l’os est très favorable et correspond à un complément d’alvéole d’une prémolaire
maxillaire. L’activité cellulaire est très riche, et les travées osseuses ont inclus les particules qui ne sont alors plus décelables cliniquement ou radiologiquement.
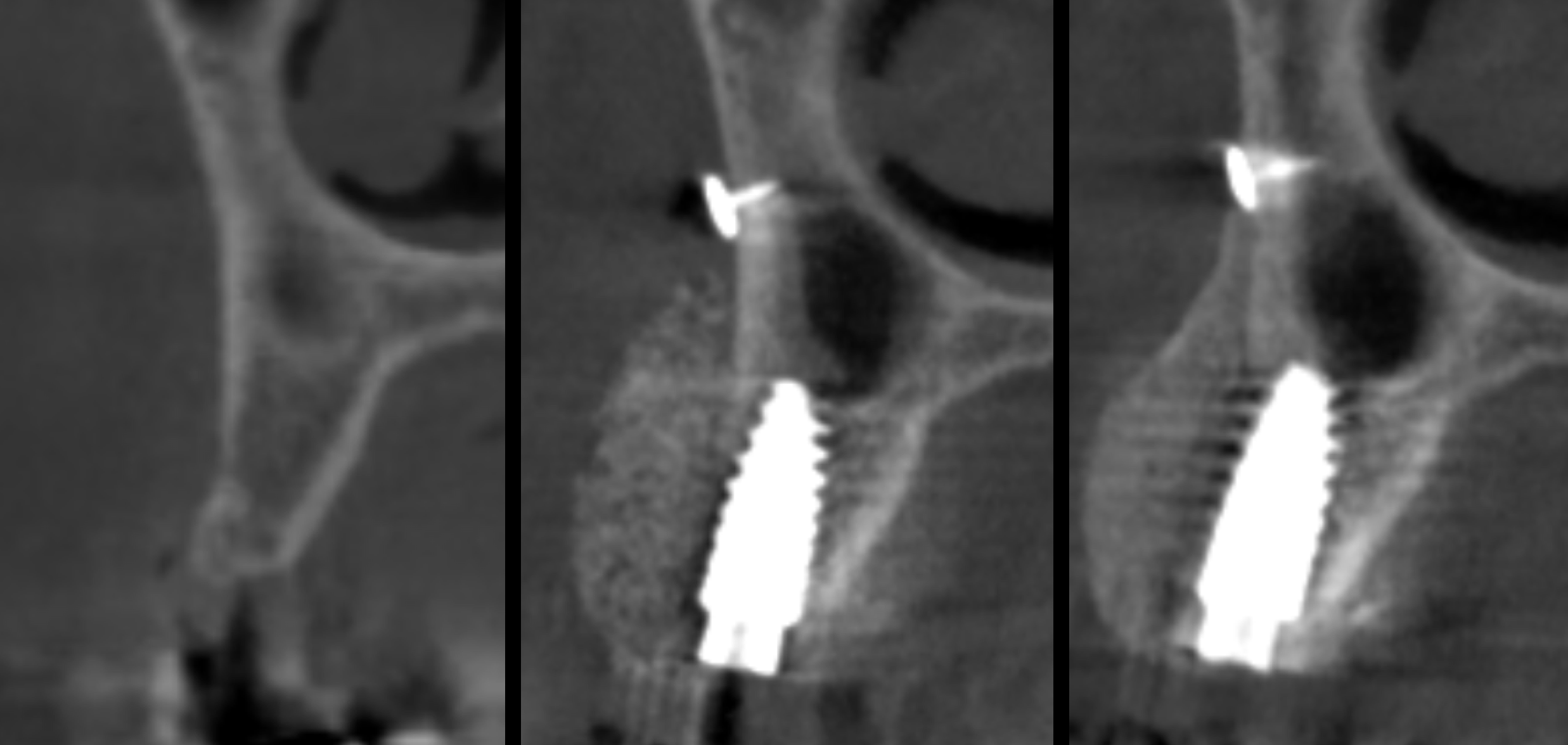
Fig.3 : ROG vestibulaire avec mise en place simultanée d’un implant.
• Fig. 3a : image pré-opératoire • Fig. 3b : CBCT j0 post opératoire. Nous noterons la densité homogène mais pas écrasée du Biobank Cortico-spongieux maintenu par une membrane Créos pinsée • Fig. 3c : cicatrisation osseuse à 6 mois. Très bonne stabilité du volume, l’analyse radiomorphométrique montre une nouvelle corticale et une trabéculation dans l’os spongieux. Notons que de l’os semble s’être formé au-dessus du pins titane.
Malheureusement, la demande est souvent de fournir des recettes avec des tutoriels mécaniciens pour résoudre une problématique biologique.
Bien souvent, face à une grande résorption, la recherche les marqueurs et les facteurs de risques de résorption n’est même pas évoquée. L’évidence de l’aléatoire conséquent à ce manquement essentiel conduit à se cacher derrière la résorbabilité ou non de biomatériaux. Mais est-ce vraiment la solution ? Est-il raisonnable de continuer à gérer les conséquences sans comprendre ni corriger les causes ?
On évoque souvent la nécessité d’un volume de 2 mm d’os nécessaire en vestibulaire d’un implant pour assurer un volume de trophycité favorable à une pérennité optimale.
Certes, cela est essentiel. Mais cela est vrai seulement s’il s’agit de 2 mm de « vrai » os : un os physiologiquement constitué, avec du turn over, et une réelle capacité d’ostéo-intégration. Pas un volume de pseudo fibrose.
L’approche métrique doit s’adoucir et se rationaliser en incluant l’approche qualitative.
La destinée de nos ROG est d’obtenir de l’os vivant, trophique, avec une corticale, du spongieux, de la moelle osseuse. Un organe conjonctif mixte complexe qui permet l’ostéo-intégration.
UNE RELECTURE NECESSAIRE DE CERTAINS MECANISMES
Nous avons tous réalisé des extractions simples, sans rien faire que laisser faire la nature : ni lambeau déplacé pour refermer le site, ni comblement. Sans aucune herméticité, sans barrière, le caillot sanguin a suffi pour activer des mécanismes de cicatrisation, généralement parfaitement opérationnels et coordonnés, qui ont permis la synthèse d’os exactement là où il fallait, d’un périoste parfait, et d’une gencive kératinisée sans cicatrice, qui pour finir d’achever la théorie d’exclusion cellulaire a poussé sans entamer sur le volume de l’os crestal.
Nous avons tous utilisé de nombreux profils de biomatériaux avec des résultats cliniquement divergents, dans des indications cliniques plus ou moins complexes. Il n’y a pas de matériaux qui ne marchent jamais, tout comme il n‘y a pas de biomatériau magique. C’est normal puisque le matériau n’est qu’un élément. La cicatrisation reste le phénomène naturel reflet de la biologie du patient.
Mais tous les biomatériaux ne se valent pas, et évaluer leurs différences en pratique quotidienne n’est pas facilement accessible à cause des nombreux paramètres.
Le plus fiable est l’histomorphométrie: l’analyse à l’échelle cellulaire et la mesure du BPC (Bone To Particule Contact), le seul moyen objectif de voir le rapport plus ou moins intime entre l’os néoformé et les particules de ROG.
L’étude histologique chez le lapin de Mahyudin (2017) (3) montre vraiment le lien entre l’influence de l’origine du biomatériau, le type de traitement et l’impact biologique sur les mécanismes de cicatrisation en évaluant les différences de réponses (quantité d’ostéoblastes, ostéoblastes spongieux, quantité de tissus fibreux, microvascularisaiton, quantité IgE et de VEGF (facteur de croissance de l’endothélium vasculaire)).
En toute logique, dans cette étude, le biomatériau absolu est l’autogène broyé mais les limites de prélèvement et la morbidité conduisent à évaluer des options alternatives. Mahyudin a comparé des xénogreffes lyophilisées, des allogreffes lyophilisées, de l’hydroxyapatite et des xénogreffes de matrice osseuse déminéralisée comme greffe osseuse (et rien dans le groupe contrôle) pour combler un défaut osseux dans une diaphyse fémorale de lapin.
Si on considère que les mécanismes biologiques, notamment les inductions, sont essentielles dès les premiers moments de cicatrisation et que l’on regarde les tableaux il en ressort que :
• VEGF (facteur de croissance de l’endothélium vasculaire) à la première semaine, est le plus élevé dans le groupe Allogène et contrôle (5,5 μm2), suivi de la xénogreffe HA (4,2 μm2) puis de la xénogreffe lyophilisée (3,4 μm2), puis de la xénogreffe déminéralisée (2,5 μm2).
• les ostéoblastes : sont plus nombreux tout le long du processus dans le groupe allogène. Dans le groupe xénogreffe déminéralisée, le nombre d’ostéoblastes est intéressant à 1 semaine (légèrement inférieur au groupe allogénique) mais s’effondre à la 4e semaine pour rejoindre le taux des xénogreffes lyophilisées qui est le plus faible dès la 2e semaine
• la microvascularisation à 1 semaine est très basse dans le groupe contrôle, et est 2 à 3 fois plus haute
dans les groupes de biomatériaux, notamment pour les groupes allogreffe et HA, mais ces 2 groupes se
normalisent les plus rapidement dès la 2e semaine.
• le taux d’ostéoclastes est le plus faible dans le groupe contrôle, suivi des groupes Allogreffe et HA.
• l’évaluation du tissu fibreux montre que, hormis le groupe contrôle moins dense à 4 semaines, il n’y a
pas de différence entre les biomatériaux.
• l’évaluation de la minéralisation des travées osseuses montre une supériorité de l’allogreffe, notamment à
la 2e semaine.
• le taux d’immunoglobuline G est similaire à 1 et 4 semaines entre le contrôle et l’allogreffe (mais
l’allogreffe présente un pic à la 2e semaine à l’inverse du groupe contrôle),
• le taux le plus élevé à la 4e semaine est dans le groupe xénogreffe déminéralisée.
• la cinétique la plus proche du groupe contrôle est obtenue avec les particules allogéniques.
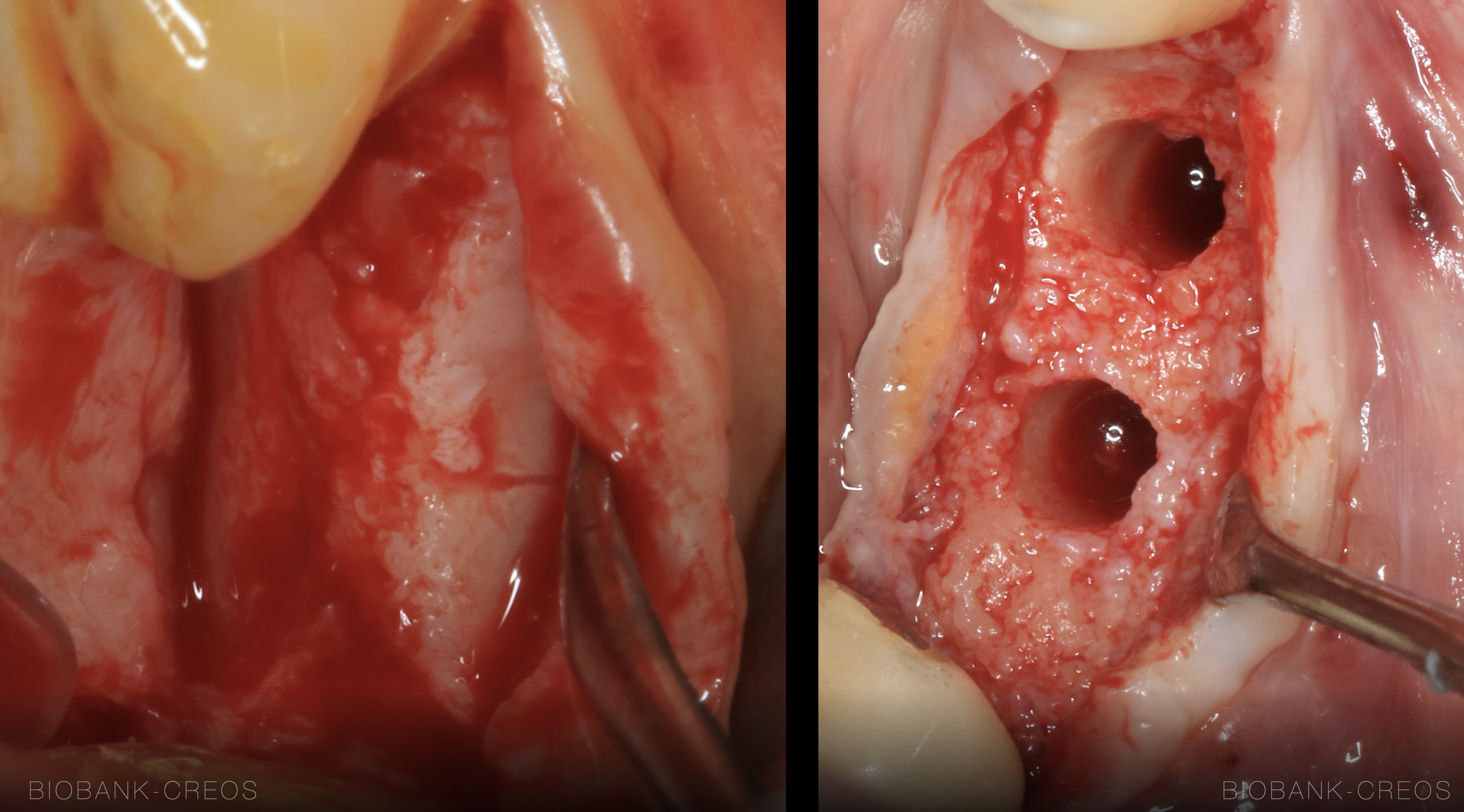
Fig. 4 : réouvertures à 6 mois de 2 ROG sausage technique similaires, réalisées avec des biomatériaux identiques (allogreffe et membrane de collagène pinsée).
• Fig. 4a : très belle cicatrisation, la néocorticale clinique signe une formation osseuse qualitative jusqu’en surface, avec une inclusion totale des particules de Biobank. Les particules sont donc
invisibles, la physiologie est idéale. • Fig. 4b : cicatrisation correcte mais avec une légère fibrose superficielle. La couche non corticalisée fait ici environ 1 mm. Son élimination est réalisée avant la mise en place d’implants sous corticaux.
Dimensions des particules : petites ou larges ?
L’étude de Basma (2022) (4) apporte des éléments très intéressants quant au choix de la taille des particules de biomatériaux.
En comparant cliniquement et histologiquement les résultats d’élargissements de crêtes en fonction de la taille des particules, elle a mis le doigt sur la divergence d’une qualité apparente (stabilité dimensionnelle) et d’une qualité réelle (biologique).
En effet, elle montre que les gains sont meilleurs avec les grosses particules, et ce avec une densité similaire.
Si on s’en tient à cela, les jeux sont faits… mais l’histologie montre que la QUALITE de l’os néoformé est supérieure avec les petites particules.
• petites particules : 31 à 51 % d’os néoformé (41.0 ± 10.1 %)
• larges particules : 16,6 à 46 % d’os néoformé (31.4 ± 14.8 %)
Si cet écart de quantité d’os néoformé n’est pas critique dans les cas favorables, il devient regrettable
dans les situations cliniques plus exigeantes.
Ceci serait lié au fait que les petites particules (inf à 1000 microns) :
• présentent une surface accrue : leur surface plus grande par rapport à leur volume, ce qui peut
potentiellement améliorer la migration des cellules nécessaires à la régénération osseuse.
• sont plus facile à manipuler: comblement amélioré et distribution plus uniforme au sein du défaut.
• ont une revascularisation plus rapide.
Influence de la nature du biomatériau sur la quantité d’os néoformé
Sujet importante s’il en est.
Il est nécessaire de connaitre les qualités et les défauts de tous les biomatériaux. Et ils en ont tous.
Cependant, dans une approche biologique où l’objectif est d’obtenir le maximum d’os néoformé, et pas seulement un volume stable, potentiellement avec plus de fibrose, évaluer histologiquement l’impact du type de biomatériau sur la quantité d’os est essentiel.
La publication de Zampara (2022) (5) apporte des réponses non équivoques en comparant des situations pourtant classiques et accessibles, loin des défis de reconstructions 3D : il fait une comparaison histologique de préservation d’alvéoles en fonction de la nature des biomatériaux en comparant une Allogreffe lyophilisée (Deutsches Institut für Zell und Gewebeersatz, Berlin), une xénogreffe (BioOss, Geistlich), un BTCP (Bondbone, Mis) et un groupe contrôle sans biomatériau.
Les 3 biomatériaux ont permis la mise en place d’implants. Quantitativement, tout est ainsi satisfaisant.
Mais qualitativement, l’histomorphométrie a mis en évidence des différences notables :
• le groupe xénogreffe a produit une quantité significativement inférieure d’os vital par rapport aux groupes allogreffe et alloplastique.
• le groupe xénogreffe a un pourcentage de particules de greffon résiduelles significativement plus élevé par rapport aux groupes allogreffe et alloplastique (Aucune différence significative n’a été observée dans le pourcentage de particules de greffon résiduelles entre les groupes allogreffe et alloplastique),
• augmentation significative du pourcentage de tissus mous dans le groupe xénogreffe par rapport à tous les autres groupes.
• lors de l’évaluation du pourcentage de moelle osseuse, la seule différence significative détectée concernait les matériaux de xénogreffe et d’alloplastique.
• aucune différence significative n’a également été détectée dans le pourcentage d’os vital entre les groupes allogreffe, alloplastique et témoin. Ceci suggère que le biomatériau qualitatif ni ralentit, ni accélère le mécanisme naturel de synthèse osseuse.
Mais il permet au mécanisme de cicatrisation osseuse de venir se réaliser dans un volume redéfini.
Dans cette étude comparative, le plus grand potentiel de ROG était associé au matériau d’allogreffe en raison du plus grand degré d’os vital et du plus faible pourcentage de particules de greffe résiduelles.
Et pourtant, cliniquement, tous les matériaux de substitution osseuse étudiés ont quand même abouti à une apposition osseuse permettant de mettre en place des implants. Avec la différence de quantité d’os néo-formé, nous pouvons imaginer un impact sur la qualité de l’ostéointégration des implants.
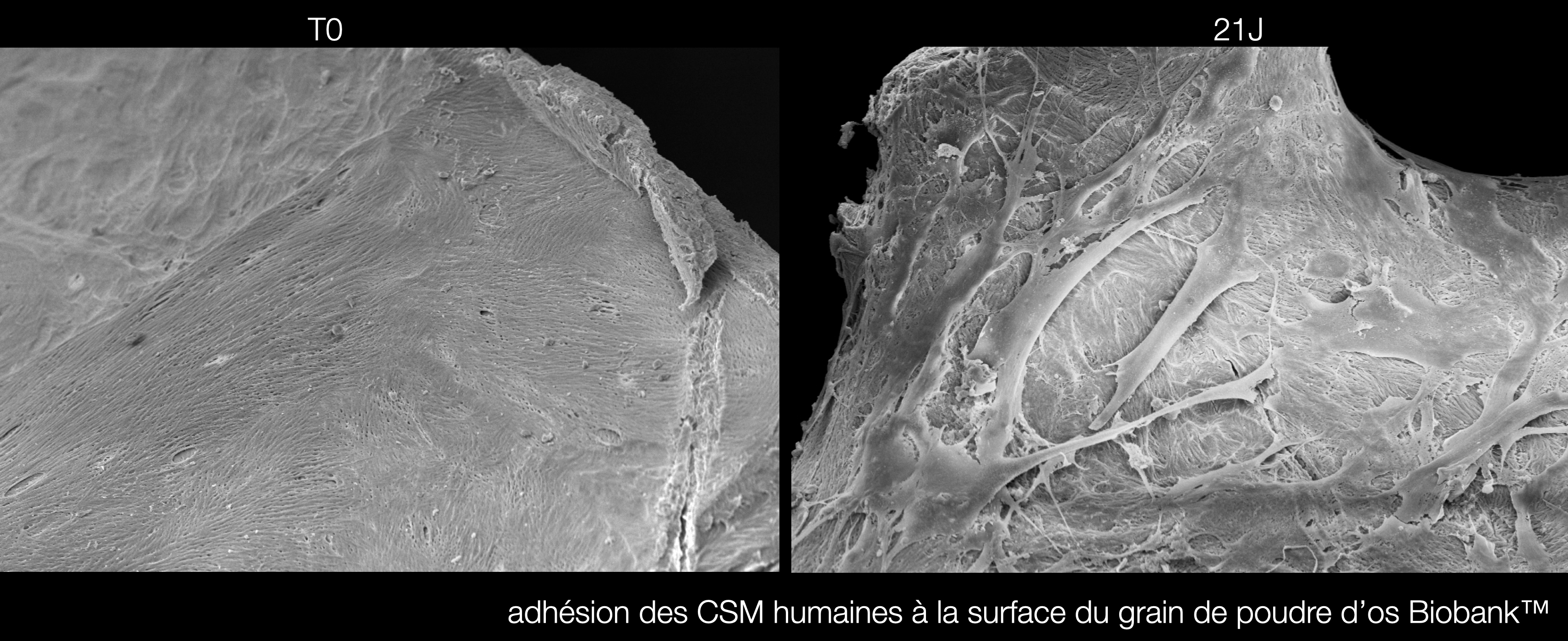
Fig. 5 : Microscopie Electronique SEM d’une particule de Biobank Spongieux J0 et à 3 semaines. Elle met en évidence l’adhésion des cellules souches mésenchymateuses à la surface des particules, essentiel pour le Bone To Particle Contact / l’ostéoconduction.
Dans un registre analogue, la méta-analyse de Canullo et Sculéan présente une constatation similaire :
« Xénogreffe et BioGide ont démontré des performances significativement meilleures en minimisant les changements de dimension des crêtes horizontales et verticales post-extraction par rapport à d’autres matériaux de greffe ou à une cicatrisation spontanée, même s’ils présentaient les pires résultats histologiques. »
Ainsi va du choix entre la qualité et la stabilité de volume qui ne peuvent être un tandem soudé.
Les barrières…qu’il va falloir voir autrement !
Nous connaissons tous les biais d’ancrage qui contraignent nos cerveaux à interpréter nos expériences sous le prisme de la donnée apprise.
Nous voulons du minéral pour obtenir de l’os, et nous voulons des membranes autour des ROG pour servir de barrières cellulaires afin de coller à la théorie de compétition cellulaire.
Beaucoup d’exemples cliniques montrent des failles dans ce raisonnement, mais l’étude histologique de Zubery (2007) (2) chez le chien a permis de montrer que dans certaines configurations, les membranes de ROG en collagène porcin allaient elles aussi s’ossifier.
Dans ces situations, la ROG n’inclut pas seulement les particules minérales mais intègrent dans les mécanismes de synthèses osseuses le volume de matrice de collagène.
Le type de tissu étant commun (conjonctif) et la capacité de servir de réservoir à protéines inductrices des membranes de collagènes semblent expliquer ce phénomène.
Oublions l’exclusion cellulaire et préférons la compréhension du besoin de membranes comme des artifices mécaniques pour réaliser les sausage techniques, en incluant les notions du besoin de leur revascularisation rapide qui n’est présent que pour les membranes de collagène, et leur capacité à stocker puis relarguer des protéines ostéogéniques.
En outre, leur dégradation semble également pro-ostéogénique. Là où nous voulions que du minéral non résorbable et bien dense pour assurer une stabilité de volume, ou des barrières absolues tel du dPTFE, nous voyons notre raisonnement toucher une première limite avec une ossification possible de certaines membranes de collagènes telle une matrice non minérale rapidement résorbable.
Si ceci est mis en évidence chez l’animal lors d’études, nombre de mes cas cliniques en sont également le reflet comme le montre l’exemple suivant avec le recouvrement osseux au contact de pins titane qui stabilisent une membrane Créos (NobelBiocare(™)) recouvrant une allogreffe (Biobank Cortico-spongieux mélangé au sang). Réouverture à 6 mois.
De plus, la qualité des membranes influence la qualité de la corticale comme la montré la méta-analyse de Del Fabbro et Sculéan (2022) (7).
Selon les auteurs, les meilleurs résultats sont obtenus avec des recouvrement avec du conjonctif autogène, suivi des membranes de collagène non réticulées.
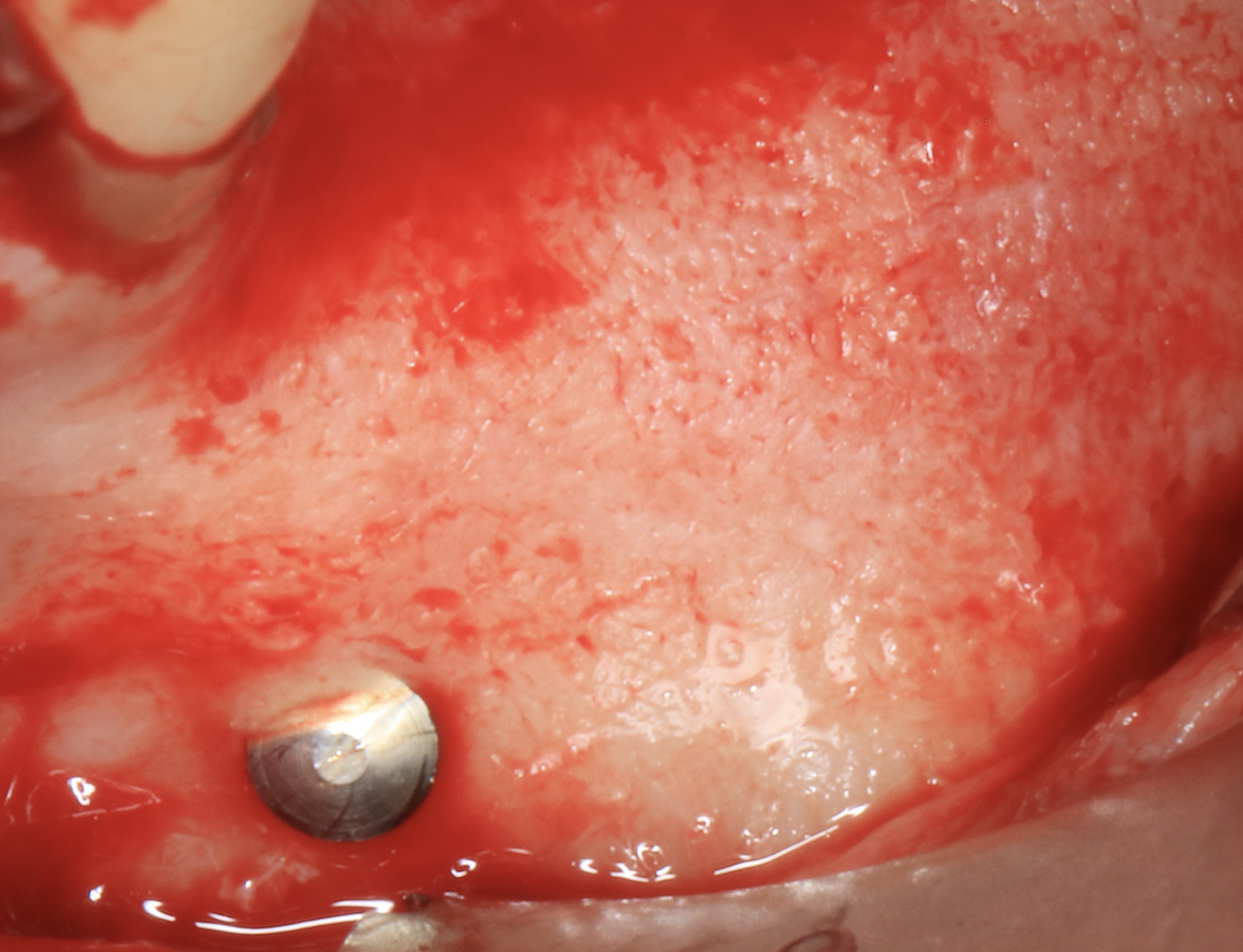
Fig. 6 : photo de réouverture à 6 mois après ROG Biobank-Creos, avec de l’os néoformé en lieu et place de la membrane de collagène.
Les membranes de collagène réticulées (cross-linked) donnent des résultats moins favorables.
Le plus mauvais résultat est le groupe témoin, sans membrane.
ROG PUIS POSE D’IMPLANT
Dans un désir de prévisibilité, la course à la vitesse mérite également une remise en question.
Nous avons compris que les études de stabilité dimensionnelles allaient à l’encontre des études d’histomorphométrie.
Comprenons que les matériaux qui conservent le mieux le volume conduisent à la régénération la moins
qualitative en termes d’os néoformé.
Ainsi, il y a toujours une part d’imprévisibilité plus ou moins grande sur le volume obtenu, surtout si l’on favorise l’approche biologique.
Dans un objectif de pérennité des traitements, au-delà du volume, il faut chercher à obtenir un tissu permettant une ostéo-intégration des implants avec un BIC le plus élevé possible, surtout le long des premiers millimètres des cols implantaires. C’est un élément majeur contre les péri-implantites, mais aussi un facteur à considérer lors de l’emploi d‘implants courts : dépassons la notion réductrice de la taille de l’implant au profit de la notion de surface ostéo-intégrée, corrélant la taille d’implant, la qualité/densité osseuse, ainsi que le protocole de pose.
Tabassum (2010)(1) a démontré qu’insérer des implants dans un os cicatrisé en sous-forage augmente l’ostéointégration : il y a plus de contact de tissus osseux grâce à la translocation de l’os « écrasé » en surface de l’implant lors de l’insertion. Comme si cela étalait les BMP à la surface de l’implant.
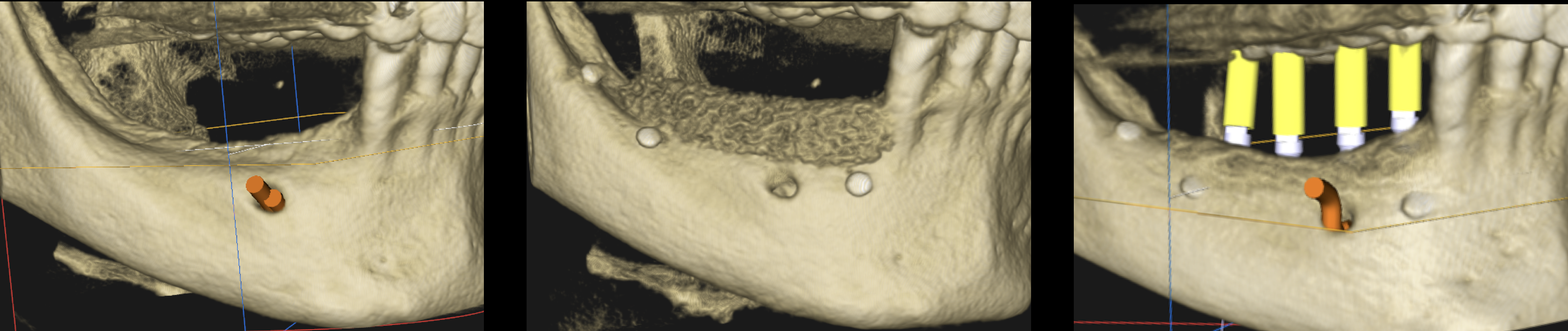
Fig. 7 : reconstructions CBCT 3D Carestream avant, j0 et à 6 mois d’une ROG mandibulaire. La corticalisation et l’ossification au contact des pins est clairement visible.
Dans un souci de compromis efficacité/prévisibilité, nous traitons les situations de déficit osseux où le col implantaire n’est pas intégralement dans de l’os natif en plusieurs temps chirurgicaux :
• ROG,
• cicatrisation de 6 mois,
• pose de l’implant,
Alors que les configurations de gain horizontal léger à modéré où le col implantaire est dans l’os natif (notamment verticalement), sont traitées avec une ROG et pose d’implant simultanée.
N’oublions pas que les mois gagnés peuvent coûter cher, et ont bien peu de sens dès mise en perspective avec le désir de fiabilité maximale de traitements.
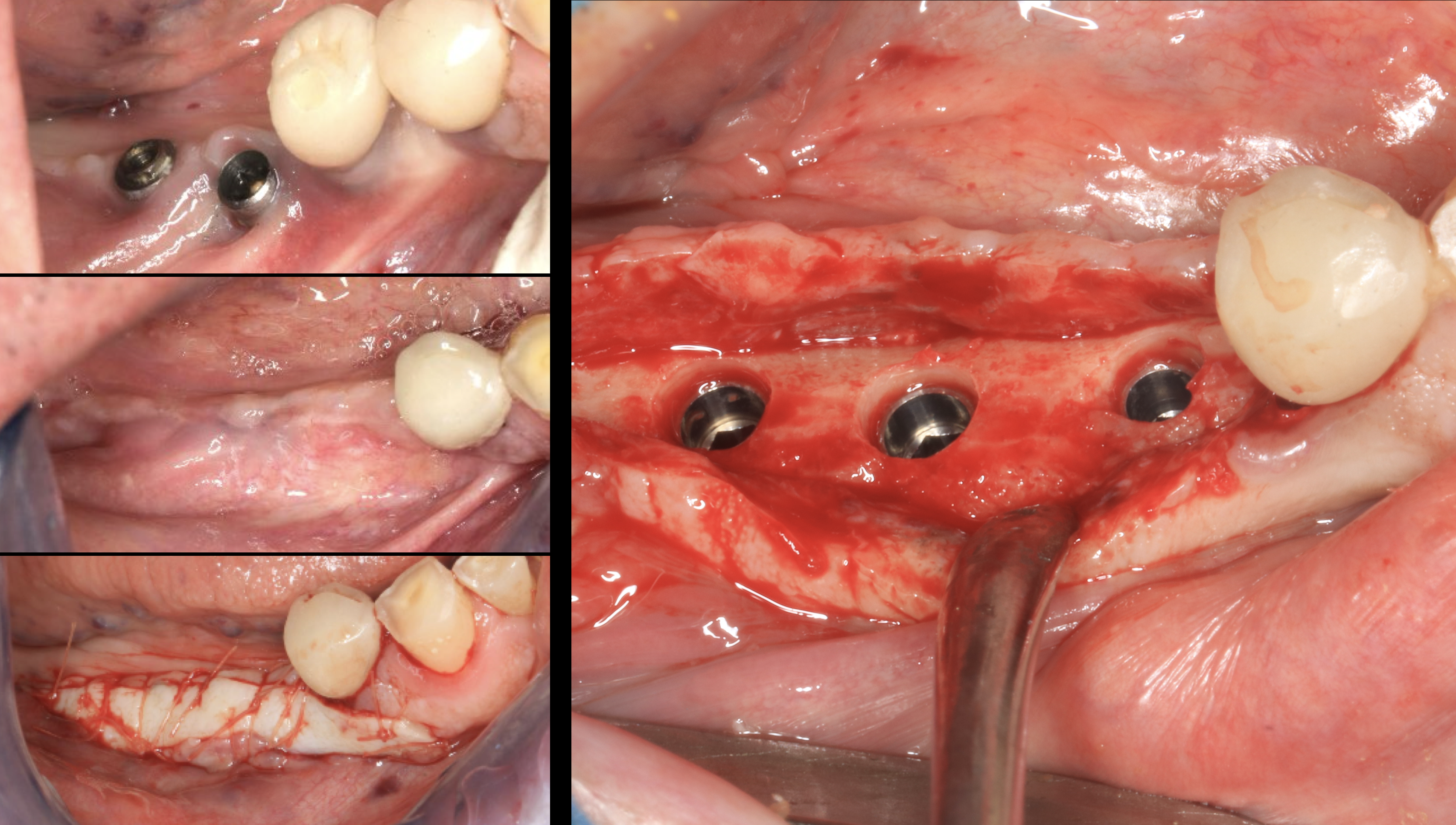
Fig. 8 : cas clinique classique de gestion d’échec de traitement implantaire initial. Dépose des implants et ROG simultanée. Cicatrisation 6 mois. Approfondissement vestibulaire et greffe épithélio-conjonctive associée. Puis mise en place d’implants InKone et InKone Wide (Global D) en sous cortical dans le volume osseux cicatrisé et corticalisé.
RESORBABILITE ET RESORPTION
Comme dernier opus de cet article, je voudrai vous inciter à dépasser un paralogisme.
Il est admis que les particules non résorbables évitent la résorption, et que les particules résorbables favorisent la résorption.
Comme il a été présenté grâce aux études cités, la réalité est plus fine et complexe.
Certes, la stabilité volumétrique des grosses particules et des xénogreffes est meilleure. Mais l’ostéointégration
des particules allogéniques résorbables et de petites tailles est supérieur. Cette meilleure synthèse osseuse est plus biologique, mais permet de fait le risque d’une activité ostéoclasique supérieure.
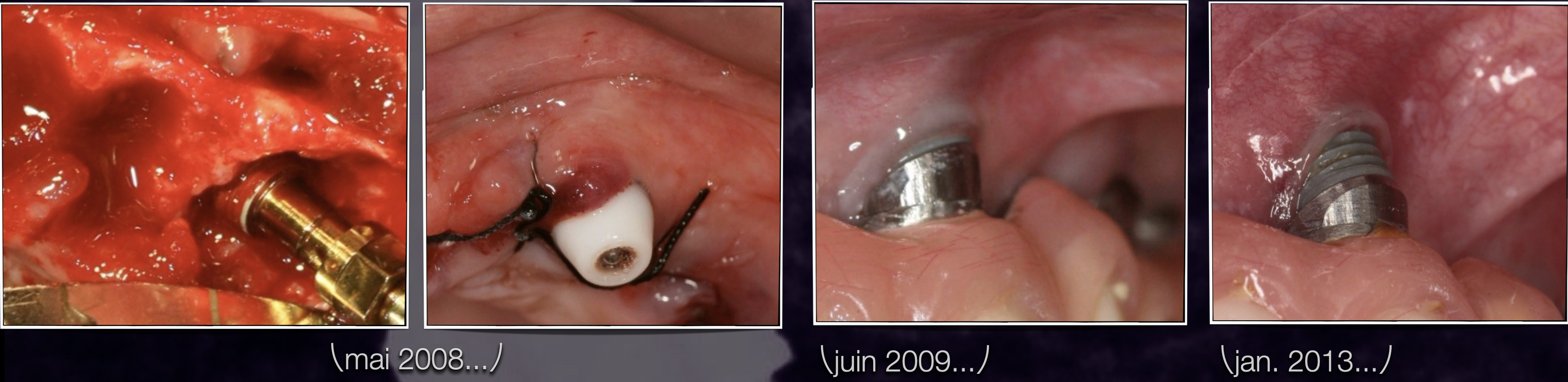
Fig. 9 : situation d’une patiente en 2008 qui avait besoin d’un All on 6. C’est une époque où nous n’avions pas encore compris l’impact de la santé du patient. C’était ce problème même d’hygiène de vie qui conduisait à l’indication de cette technique dont les extractions multiples avec implantations immédiates ont conduit à des remaniements majeurs. Les comblements avaient pourtant été réalisés en xénogreffe.
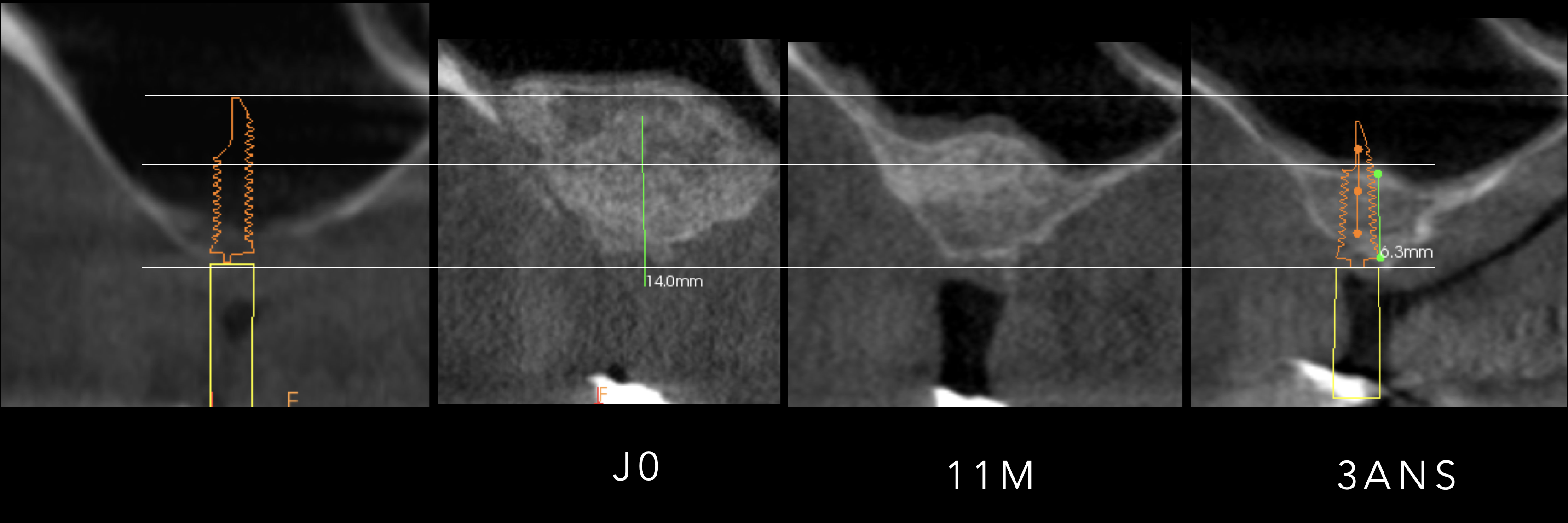
Fig. 10 : cas d’un sinus lift en allogreffe chez une patiente multicarencée et qui a tardé à réaliser les étapes implantaires. Le remaniement conduisant à la résorption est particulièrement mis en
évidence. L’analyse de la résorption initiale aurait dû nous alerter.
Fig. 11 : situation classique et correcte d’une reconstruction très stable alors qu’il s’agit d’une sausage technique avec gain vertical et horizontal. Aucune perte de volume, mais au contraire belle densification. La notion terrain est fondamentale pour comprendre ces mécanismes
complexes.
L’analyse des histologies à 6 mois d’allogreffes montre la présence résiduelle des particules et leur ostéointégration dans l’os néoformé. Ainsi de l’os « dur » s’est déjà formé tout autour des particules après quelques mois de cicatrisation et avant leur résorption.
Ainsi, une fois cette étape aboutie, la résorption des particules doit-elle toujours induire un volume de ROG ? Bien sûr que non.
La résorption secondaire ne conduira à un remaniement que si la patient ou la configuration clinique sont délétères. Et la qualité d’ostéo-intégration des particules augmente la capacité de remaniement en cas de dysfonction biologique.
C’est l’inverse du volume stable plus ou moins inerte, plus ou moins ostéo-intégré, qui masquera et limitera
l’ostéoclasie.
Les reconstructions physiologiques comme les greffes autogènes particulaires ou les reconstructions avec os
allogénique vont donc permettre les mécanismes du patient d’être visible, d’évaluer non pas un volume de
reconstruction mécanique plus ou moins ossifié mais de suivre un volume synthétisé.
Les remaniements sont plus précoces mais permettent de travailler normalement sur ces os régénérés globalement plus qualitatifs, très proches des os de cicatrisation spontanées.
La néo-corticale se crée et sera aussi stable ou instable que le reste du squelette du patient.
Il est grisant de vouloir faire plus que la nature et de rêver à des reconstructions résistantes à toutes les avaries biologiques, mais le prix à payer est une moindre néo-synthèse osseuse, une moindre ostéointégration, une moindre capacité de réintervention.
CONCLUSION
L’ère du purement quantitatif donne progressivement la scène à l’ère du qualitatif. Les ROG seront de moins en moins évaluées en stabilité dimensionnelle mais en incluant de plus en plus les histo-morphométries et radiomorphométries.
Les notions de patient-dépendances vont donc s’inviter dans nos analyse pré-opératoires tout comme les scanners ont su se rendre indispensables. En plus des mesures de densité, des hauteurs, des distances vis à vis des obstacles anatomiques, il faudra désormais aussi mesurer les carences, certaines hormones, le profil génétique et tous les autres facteurs physiologiques influençant la cicatrisation.
BIBLIOGRAPHIE
- Tabassum A, Walboomers XF, Wolke JG, Meijer GJ, Jansen JA. Bone particles and the undersized surgical technique. J Dent Res. 2010 Jun;89(6):581-6. doi: 10.1177/0022034510363263. Epub 2010 Mar 8. PMID: 20212102.
- Zubery Y, Goldlust A, Alves A, Nir E. Ossification of a novel cross-linked porcine collagen barrier in guided bone regeneration in dogs. J Periodontol. 2007 Jan;78(1):112-21. doi: 10.1902/jop.2007.060055. PMID: 17199547.
- Mahyudin F, Utomo DN, Suroto H, Martanto TW, Edward M, Gaol IL. Comparative Effectiveness of Bone Grafting Using Xenograft Freeze-Dried Cortical Bovine, Allograft Freeze-Dried Cortical New Zealand White Rabbit, Xenograft Hydroxyapatite Bovine, and Xenograft Demineralized Bone Matrix Bovine in Bone Defect of Femoral Diaphysis of White Rabbit: Experimental Study In Vivo. Int J Biomater. 2017;2017:7571523. doi: 10.1155/2017/7571523. Epub 2017 Sep 28. PMID: 29093738; PMCID: PMC5637838.
- Basma HS, Saleh MHA, Geurs NC, Li P, Ravidà A, Wang HL, Abou-Arraj RV. The effect of bone particle size on the histomorphometric and clinical outcomes following lateral ridge augmentation procedures: A randomized double-blinded controlled trial. J Periodontol. 2023 Feb;94(2):163-173. doi: 10.1002/JPER.22-0212. Epub 2022 Nov 17. PMID: 35959712.
- Zampara E, Alshammari M, De Bortoli J, Mullings O, Gkisakis IG, Benalcázar Jalkh EB, Tovar N, Coelho PG, Witek L. A Histologic and Histomorphometric Evaluation of an Allograft, Xenograft, and Alloplast Graft for Alveolar Ridge Preservation in Humans: A Randomized Controlled Clinical Trial. J Oral Implantol. 2022 Dec 1;48(6):541-549. doi: 10.1563/aaid-joi-D-21-00012. PMID: 35446950.
- Canullo L, Del Fabbro M, Khijmatgar S, Panda S, Ravidà A, Tommasato G, Sculean A, Pesce P. Dimensional and histomorphometric evaluation of biomaterials used for alveolar ridge preservation: a systematic review and network meta-analysis. Clin Oral Investig. 2022 Jan;26(1):141-158. doi: 10.1007/s00784-021-04248-1. Epub 2021 Nov 26. PMID: 34826029.
- Del Fabbro M, Tommasato G, Pesce P, Ravidà A, Khijmatgar S, Sculean A, Galli M, Antonacci D, Canullo L. Sealing materials for post-extraction site: a systematic review and network meta-analysis. Clin Oral Investig. 2022 Feb;26(2):1137-1154. doi: 10.1007/s00784-021-04262-3. Epub 2021 Nov 25. PMID: 34825280; PMCID: PMC8816783.






