Dès qu’un implant est exposé à l’environnement buccal, il est très rapidement colonisé par des bactéries. Il existe, en effet, une migration bactérienne à partir des différentes niches buccales vers les sites péri-implantaires. Cette microbiologie des implants dentaires est influencée par de nombreux facteurs parmi lesquels l’état bucco-dentaire du patient. La flore péri-implantaire des sujets partiellement édentés est beaucoup plus abondante en bacilles à Gram négatif anaérobies que celle des sujets totalement édentés. Logiquement, ces espèces bactériennes normalement impliquées dans l’étiologie des maladies parodontales, sont également impliquées dans la destruction irréversible des structures péri-implantaires profondes. Lors de la pose d’implants chez des sujets partiellement édentés un examen clinique et le contrôle des infections parodontales doivent impérativement être effectués. Une réduction significative de la charge bactérienne globale, en particulier des espèces bactériennes parodontopathogènes, permettrons de minimiser le risque de complication implantaire. Péri-implant et parodonte sont ainsi soumis aux mêmes risques infectieux.
La pérennité des réhabilitations implanto-portées a largement été démontrée dans le traitement de l’édentement partiel ou total. L’ostéo-intégration, qui est la seule garantie du succès, dépend de la capacité des cellules des tissus hôtes à adhérer et proliférer à la surface de l’implant. Cependant, il a été rapporté dans certaines situations une perte progressive de l’ostéo-intégration préalablement (6). Les raisons de ces destructions des tissus péri-implantaires peuvent être soit une transmission excessive de contraintes à l’interface os/implant soit la progression d’une infection péri-implantaire soit une combinaison de ces facteurs (25). Les matériaux des implants dentaires, choisis au départ pour leurs propriétés biocompatibles, offrent naturellement une surface favorable à l’adhésion bactérienne. Les principes physiques et moléculaires de l’adhésion bactérienne lors de la colonisation des surfaces implantaires sont semblables à ceux des cellules eucaryotes lors de la cicatrisation tissulaire (8). C’est pourquoi, une meilleure compréhension de la colonisation des surfaces implantaires et de l’infection du péri-implant est indispensable pour prévenir et contrôler la contamination bactérienne.
La microbiologie de l’environnement peri-implantaire sain
Les micro-organismes présents dans la cavité buccale vont déterminer la composition de la flore péri-implantaire.
Les principaux biofilms buccaux (épithélium buccal, face dorsale de la langue, surfaces dentaires supra et sousgingivales, amygdales) vont influencer le biofilm péri-implantaire.
Dans ce contexte, l’absence ou la présence de dents, avec leurs biofilms supra et sous gingivaux, semble être l’élément clé de la microbiologie de l’environnement péri-implantaire (1 ; 23).
La microbiologie des implants dentaires chez les sujets totalement édentés
Chez ces sujets, de très importantes variations de compositions microbiennes sont observées dans les divers biofilms.
Un mois après l’avulsion de l’ensemble des dents, une réduction significative des micro-organismes impliqués dans les maladies parodontales (parodontopathogènes) est mise en évidence. Les pathogènes majeurs, Aggregatibacter actinomycetemcomitans (Aa) et Porphyromonas gingivalis (Pg), deviennent alors indétectables (3).
Mombelli et collaborateurs (15) ont étudié la maturation de la flore sous-muqueuse au cours des 6 premiers mois qui ont suivi la pose d’implants chez 5 patients totalement édentés. Durant la période d’observation, aucune modification significative de la flore n’a été observée pour les implants ostéo-intégrés. Plus de 95 % de la flore était composé de cocci, dont 46 à 72 % de Gram-positifs. Le ratio bactéries aérobies/bactéries anaérobies était de 1 pour 1. La détection de spirochètes, de bactéries mobiles et de bactéries parodontopathogènes (Aa, Pg, Prevotella intermedia (Pi)) était très faible. Cette flore était plus proche de celle associée à la bonne santé gingivale (Fig. 1a, 1b).
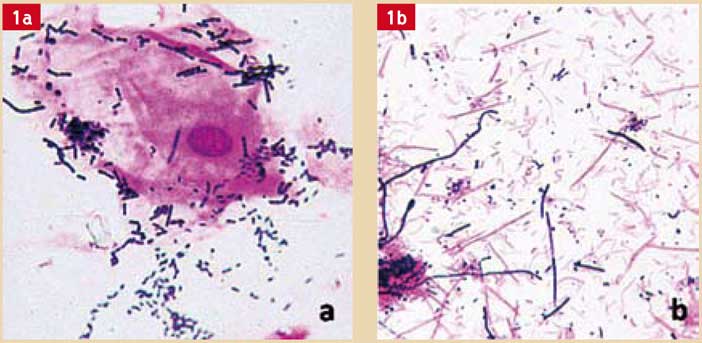
Fig. 1a, 1b : Suivi de la microflore d’un site péri-implantaire par coloration de Gram. a) site sain : flore peu dense, essentiellement coccoïde à Gram positif (streptocoques, actinomyces). b) mucosite péri-implantaire : flore abondante, essentiellement à Gram négatif (Fusobacterium, Porphyromonas, Prevotella, Campylobactermobile, Capnocytophagamobile) (documents Dr. O. BARSOTTI – Laboratoire d’Etude des Interfaces et des Biofilms en Odontologie – Faculté d’Odontologie – LYON I)
Le même groupe de travail a publié des données à long terme concernant la composition de la flore des implants dentaires de 18 sujets totalement édentés (16). Après deux ans de mise en charge, 83 % de la flore était composé de cocci, les spirochètes étaient toujours indétectables, le ratio de bactéries aérobies/bactéries anaérobies restait inchangé (1/1) et les parodontopathogènes étaient la plus part du temps indétectables quoique quelques bactéries mobiles aient fait leur apparition (5,6 %). A 3 ans, bien que des modifications de composition aient été observées en fonction de l’indice de plaque, aucune variation significative n’est survenue au cours du temps.
La microbiologie des implants dentaires chez les sujets partiellement édentés
Contrairement aux sujets totalement édentés, la flore périimplantaire des sujets partiellement édentés est caractérisée par la présence de bacilles à Gram négatif anaérobies.
De fortes similitudes microbiologiques sont observées entre la flore sous-muqueuse des implants et la flore sousgingivale des dents adjacentes. Chez les patients dentés, les bactéries parodontopathogènes, présentes en faible quantité dans les situations parodontales saines, sont en mesure de coloniser les sites implantaires. Un mois après leur exposition à l’environnement buccal, la majorité des sites implantaires est porteuse de Pi, de Peptostreptococcus micros (Pm) et de Fusobacterium nucleatum (Fn).
Six mois plus tard, les compositions microbiennes des poches parodontales et des poches péri-implantaires sont similaires. Un équilibre microbiologique semblerait s’établir entre poches parodontales et sites péri-implantaires au cours des six premiers mois de mise en fonction (26).
Leonhardt et collaborateurs (11) ont également constaté des prévalences similaires de Aa et de Pg entre parodonte et sulcus implantaire 6 mois après la pose des implants.
Bien que ces similitudes bactériennes aient été observées pendant 3 ans, aucune perte osseuse n’a été diagnostiquée pour les implants contaminés par ces bactéries. La présence, en faible quantité, de bactéries parodontopathogènes n’entraîne donc pas nécessairement d’infection ou d’échec implantaire, et est compatible avec le bon état de santé péri-implantaire. Chez les sujets partiellement édentés Quirynen et collaborateurs ont donc observé une augmentation de la charge bactérienne totale, une augmentation de la proportion de bactéries mobiles et de spirochètes ainsi qu’une faible augmentation du nombre de bactéries parodontopathogènes (24).
La microbiologie des infections peri-implantaires
Dans certaines situations, il est possible d’observer une perte progressive de l’ostéo-intégration préalablement établie. Ces complications regroupées sous le terme de « complications biologiques implantaires tardives » peuvent avoir deux étiologies (25). La première, constituée par la surcharge occlusale, (situation pour laquelle la contrainte transmise à l’interface os/implant dépasse la capacité de cicatrisation du tissu osseux), est une cause fréquente d’échec (7). La seconde, la pathologie infectieuse (mucosite ou péri-implantite), correspond à un processus inflammatoire destructeur affectant les tissus mous et les tissus durs péri-implantaires pouvant aboutir à la destruction de l’os support (1st European Workshop on periodontology, Ittingen, Switzerland, 1993).
La microbiologie des péri-implantites
Les implants atteints de péri-implantites présentent une flore complexe, proche de celle associée aux parodontites en phase active. Mombelli et collaborateurs ont observé dans les cas de péri-implantites une augmentation de la proportion des bactéries anaérobies (ratio bactéries
aérobies/bactéries anaérobies de 1 pour 6), des bactéries mobiles (8 %), dont les spirochètes (11,5 %), par rapport aux implants sains (Fig. 2). Ces complications infectieuses étaient associées à une diminution des streptocoques anaérobies facultatifs et une augmentation des bacilles à Gram négatif anaérobies stricts (14).
Les espèces classiquement associées aux péri-implantites, qu’elles soient à Gram négatif (Tannerella forsythia (Tf), Fn, Campylobacter gracilis (Cg)) ou à Gram positif (Pm et Streptococcus intermedius (Si)), possèdent des facteurs de virulence pouvant expliquer les destructions tissulaires (17). Certaines espèces comme Aa, Pg et Pi ont été retrouvées plus fréquemment dans les cas de péri-implantites chez les patients partiellement édentés, que dans les cas de péri-implantites chez les patients totalement édentés (10).
Les poches parodontales semblent être le réservoir des pathogènes retrouvés dans les lésions péri-implantaires (19).
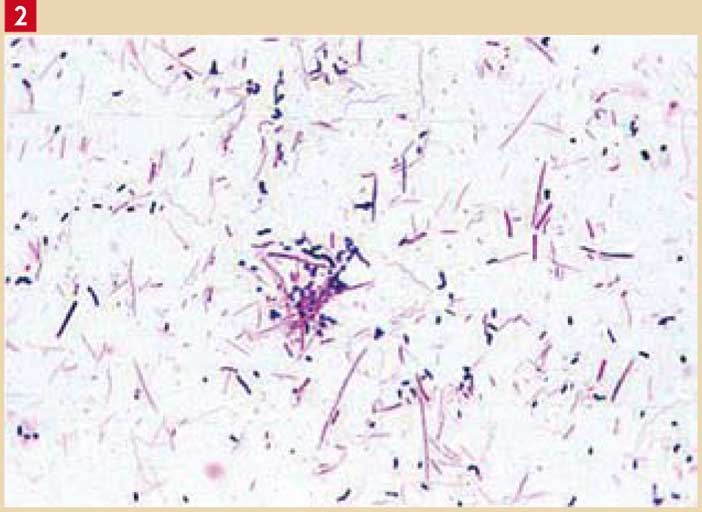
Fig. 2 : Coloration de Gram. Flore d’une péri-implantite : abondante essentiellement à Gram négatif (Fusobacterium, Porphyromonas, Prevotella, Treponemamobile, Campylobactermobile, Capnocytophagamobile) (document Dr. O. BARSOTTI – Laboratoire d’Etude des Interfaces et des Biofilms en Odontologie – Faculté d’Odontologie – LYON I).
Les preuves de l’origine infectieuse des péri-implantites
La seule détection de bactéries parodontopathogènes lors des péri-implantites n’est pas suffisante pour établir une relation de causalité entre infection et destruction tissulaire.
Certaines expérimentations ont permis de clairement identifier le rôle étiologique des bactéries dans la destruction des tissus péri-implantaires.
La mucosite péri-implantaire expérimentale (5) établit un lien direct entre l’accumulation du biofilm et la mucosite péri-implantaire. L’arrêt des mesures d’hygiène bucco-dentaire durant 3 semaines entraîne une accumulation de biofilm, une augmentation de l’indice d’inflammation et une augmentation de la profondeur de poche péri-implantaire.
Chez l’animal, l’accumulation de biofilm secondaire à l’insertion sous-muqueuse d’une ligature entraîne une inflammation tissulaire. Cette réaction de défense est suivie d’une destruction osseuse irréversible (12).
Les thérapies anti-infectieuses par débridement mécanique de la poche péri-implantaire et/ou utilisation d’antibiotiques permettent une amélioration clinique et la stabilisation des lésions péri-implantaires (11). L’objectif principal du traitement des péri-implantites est de réduire significativement la proportion de bactéries anaérobies, et en particulier les espèces parodontopathogènes, de l’environnement sous-muqueux.
Il a été démontré qu’une mauvaise hygiène bucco-dentaire entraînait une résorption osseuse péri-implantaire plus importante que chez les sujets ayant un bon contrôle du biofilm (13).
Tous ces éléments nous permettent d’affirmer la relation directe entre flore péri-implantaire et destructions tissulaires.
Certains paramètres, en mesure de modifier cette flore, vont pouvoir favoriser l’apparition de complications biologiques tardives.
Les facteurs influencant la microbiologie des implants dentaires
La présence de dents et leur statut parodontal
La migration bactérienne d’une niche buccale à l’autre a largement été démontrée. En effet, la majorité des bactéries parodontopathogènes (à l’exception des spirochètes limités aux poches parodontales) sont en mesure de coloniser chacune de ces niches (4). Cependant, après l’avulsion de toutes les dents, la majorité de ces bactéries disparaît du milieu buccal (3). Les poches parodontales se comportent comme des « réservoirs bactériens » en permettant la survie des germes pathogènes du biofilm sousgingival et leur migration vers les sillons péri-implantaires des sujets partiellement édentés (20). Leonhardt et collaborateurs ont mis en évidence que cette migration était très précoce avec la détection de pathogène dans le mois qui suivait l’exposition de l’implant à l’environnement buccal (10).
Le statut parodontal des dents restantes influence donc fortement la microbiologie des implants dentaires (19). Van Winkelhoff et Wolf ont démontré que la conservation, même provisoire, de dents atteintes de maladies parodontales au cours du traitement implantaire avait des conséquences dramatiques sur le pronostic des implants (27).
La profondeur de poche
La similitude des flores parodontales et péri-implantaires des sujets partiellement édentés est encore plus marquée lorsque les profondeurs de poches dentaires et implantaires sont identiques. Papaioannou et collaborateurs ont observé que la profondeur de poche était le paramètre clinique implantaire le plus étroitement corrélé à la pathogénicité de la flore (18). La proportion en effet, de spirochètes et de bactéries mobiles était plus importante au niveau des poches péri-implantaires profondes. Pour Quirynen et collaborateurs, chez les sujets partiellement édentés atteints de parodontites chroniques, seule une profondeur de poche péri-implantaire inférieure à 4 mm garantit l’absence de spirochètes et de bactéries mobiles (23).
Ces observations doivent encourager le chirurgien dentiste à prévenir la présence de poches péri-implantaires profondes lors de la mise en place de l’implant ou lors du second temps chirurgical lorsque l’esthétique le permet.
L’état de surface du pilier transmuqueux
La colonisation des surfaces implantaires débute à partir d’irrégularités de surface au niveau supra-muqueux.
Les biofilms se développant à partir de ces irrégularités finissent par confluer et recouvrir les surfaces implantaires sous-muqueuses. Les surfaces rugueuses permettent la formation d’un biofilm plus dense et plus mature qui se caractérise par une diminution des cocci et une augmentation des bactéries mobiles et des spirochètes (21). Ces surfaces, qui augmentent la rétention et l’accumulation du biofilm, ont de nombreuses conséquences cliniques (22).
Les couronnes, les bases prothétiques et les cols implantaires rugueux favorisent aussi l’apparition d’une inflammation, d’une augmentation du saignement au sondage et d’une sécrétion plus importante de fluide péri-implantaire.
Les corps étrangers dans le sulcus péri-implantaire
Les péri-implantites peuvent être provoquées par l’insertion sous-muqueuse de corps étrangers. Les restes de ciment de scellement peuvent initier une inflammation et d’importantes destructions osseuses. Après suppression du corps étranger, bien que la cicatrisation et la réduction de l’inflammation soient obtenues, le défaut osseux et la poche profonde altèrent la flore péri-implantaire (24).
Adaptation prothétique
Au niveau dentaire il a été démontré que la présence de limites prothétiques sous gingivales en sur-contour était responsable de l’apparition d’une inflammation et de destructions tissulaires. La flore microbienne prélevée au niveau de ces restaurations présente de fortes similitudes avec celle des poches parodontales profondes (9).
La qualité de l’hygiène bucco-dentaire
Le niveau d’hygiène bucco-dentaire a une forte influence sur la stabilité des tissus péri-implantaires. Chez les patients totalement édentés, l’hygiène défaillante est associée à une augmentation de la perte osseuse péri-implantaire. Ces observations sont encore plus probantes chez les fumeurs (13).
Conclusion
Après l’exposition d’un implant à l’environnement buccal, le sillon péri-implantaire est très rapidement colonisé par des bactéries provenant des différentes niches buccales.
Cette colonisation est sous l’influence de nombreux facteurs, parmi lesquels la profondeur de poche péri-implantaire, l’état de surface du col implantaire, la qualité de l’hygiène bucco-dentaire du patient… Il a été démontré que les états dentaires et parodontaux des patients ont une très forte influence sur la microbiologie des implants. En effet, chez les sujets partiellement édentés, contrairement aux sujets totalement édentés, la présence de bactéries impliquées dans l’étiologie des maladies parodontales est beaucoup plus fréquente.
Il existe une relation directe entre bactéries parodontopathogènes et infections péri-implantaires. Les fortes similitudes microbiologiques entre parodontites et péri-implantites nous permettent d’affirmer que les mêmes espèces bactériennes sont impliquées dans l’étiologie de ces deux pathologies infectieuses.
Ainsi, lors de la pose d’implants, l’examen et le contrôle des infections bucco-dentaires doivent être systématiques.
La diminution de la charge bactérienne et la réduction significative des bactéries parodontopathogènes du milieu buccal sont indispensables avant toute chirurgie implantaire. Le remplacement par un implant, d’une dent compromise d’un point de vue parodontal, n’exclut en rien le risque de complication infectieuse péri-implantaire.
L’environnement péri-implantaire et le parodonte sont en effet soumis aux mêmes risques infectieux.
Bibliographie
1. Apse P, Ellen RP, Overall CM, Zarb GA. Microbiota and crevicular fluid collagenase activity in the osseointegrated dental implant sulcus : A comparison of sites in edentulous and partially edentulous patients. J Perio Res 1989;24:96-105.
2. Barsotti et Exbrayat, Implants et bactéries buccales, dans Microbiologie en Odonto-Stomatologie, Chardin, Barsotti, Bonnaure-Mallet – édition Maloine, 2006.
3. Danser MM, vn Winkelhoff AJ, de Graaf J, Loos BG, van der Velden U. Shortterm effect of full-mouth extraction on periodontal pathogens colonizing the oral mucous membranes. J Clin Periodontol. 1994;21:484-9.
4. Danser MM, Timmerman MF, van Winkelhoff AJ, van der Velden U. The effect of eriodontal treatment on periodontal bacteria on the oral mucous membranes. J Periodontol. 1996;67:478-85.
5. Ericsson I, Berglundh T, Marinello C, Liljenberg B, Lindhe J. Long-standing plaque and gingivitis at implants and teeth in the dog. Clin Oral Implants Res. 1992;3:99-103.
6. Esposito M, Hirsch JM, Lekholm U, Thomsen P. Biological factors contributing to failures of osseointegrated orfal implants (1). Succes criteria and epidemiology. Eur J Oral Sci. 1998a;106:527-51.
7. Esposito M, Hirsch JM, Lekholm U, Thomsen P. Biological factors contributing to failures of osseointegrated orfal implants (2). Etiopathogenesis. Eur J Oral Sci. 1998b;106:721-64.
8. Gristina AG. Biomaterial-centered infection: Microbial adhesion versus tissue integration. Science. 1987;237:1588-95.
9. Lang NP, Kiel RA, Anderhalden K. Clinical and microbiological effects of subgingival restorations with overhanging or clinically perfect margins. J Clin Periodontol. 1983;10:563-78.
10. Leonhardt A, Adolfsson B, Lekholm U, Wikström M, DahlénG. A longitudinal microbiological study on osseointegrated titanium imùplants in partially patients. Clin Oral Implants Res. 1993;4:113-20.