Durant les 30-40 dernières années, l’industrie médicale a connu un véritable développement des matériaux exploitables dans le domaine de la régénération et de la réparation tissulaire. A partir de 1960, des avancées considérables ont été réalisées au niveau technologique et scientifique permettant d’introduire dans notre pratique quotidienne un groupe de matériaux appelés « biocéramiques ».
Ce terme souvent entendu au cours de conférences et utilisé parfois à tort, dans les publications professionnelles, nous est de plus en plus familier. Mais qu’est-ce une biocéramique ? Le préfixe « bio » nous autorise-t-il à tout faire ? Comment et quand peut-on les utiliser et quand leur indication doit-elle être posée ? Que sont réellement ces matériaux ? Valent-ils vraiment le coup que l’on se pose la question du changement de nos habitudes cliniques ? C’est ce que nous aborderons dans ce manuscrit.
Une famille de biomatériaux
Les biocéramiques constituent une famille de matériaux, applicables dans différentes domaines de la science médicale.
Selon le type de céramique utilisé et de l’interaction avec l’hôte, elles peuvent être catégorisées en céramiques Bioinertes ou Bio- actives. (Best et al. 2008)
- Les céramiques bio-inertes, comme leur nom l’indique, ne déclenchent aucune réaction biologique lorsqu’elles sont en contact avec l’hôte, (alumina, zircone, carbone) ; pourtant elles sont biocompatibles.
- Les céramiques bioactives qui déclenchent ou stimulent un processus biologique au sein du tissu avec lequel elles sont mises en contact (verre bioactif, hydroxyapatite, silicates de calcium).
Intérêt clinique
En médecine, les céramiques bio-inertes sont utilisés dans la fabrication de certains dispositifs orthopédiques. Les bioactives sont, quant à elles, utilisés comme matériau de comblement des défauts osseux ou pour les thérapeutiques de régénération et réparation tissulaire.
En odontologie, le champ d’indications des « biocéramiques bioactives » est très vaste, et concerne plusieurs disciplines.
En endodontie, elles sont utilisées pour le coiffage pulpaire, le traitement des perforations dentaires et plus récemment pour l’obturation canalaire.
La connaissance du mécanisme d’action de ces matériaux bioactifs devient essentielle afin d’assurer le choix du matériau le plus adapté dans chaque situation clinique. Pourtant, ces mécanismes restent mal connus et leur utilisation reste empirique. Mais les succès cliniques rapportés sont tels que leur utilisation et leurs champs d’application tend à se développer considérablement.
La diversité des situations cliniques dans lesquelles les biocéramiques peuvent être utiles justifient une diversité de matériaux. Le choix du produit idéal se fera sur la base d’une réflexion clinique, de l’objectif à atteindre, des contraintes techniques (fluidité, rhéologie, temps de prise etc.).
Biocéramiques en endodontie
MTA (Minéral Trioxide Aggregate)
Développé par le Dr. Mahmoud Torabinejad, la première version du MTA a été commercialisée en 1999 sous le nom de Pro-Root MTA (Dentsply Maillefer).
Initialement conçu pour une utilisation en endodontie chirurgicale, ses indications ont depuis été grandement élargies. Sa composition est proche de celle du ciment de Portland auquel de l’oxyde de Bismuth a été ajouté pour améliorer sa radio opacité.
Le ciment Portland est un terme appliqué à une classe de matériaux couvrant une gamme de compositions entre alumine de silice et calcia. La première utilisation rapportée du ciment de Portland dans la littérature dentaire remonte à 1878 lorsque le Dr Witte en Allemagne publia un rapport de cas sur l’utilisation du ciment Portland pour remplir les canaux radiculaires. (Witte 1978).
Contrairement au MTA, le ciment Portland contient des métaux lourds et a de grosses particules irrégulières qui interdisent son utilisation clinique en tant que tel.
Le MTA est disponible sous deux formes: le MTA gris (MTAG), commercialisé en premier, et le MTA blanc (MTAB). Ce dernier ne contiendrait pas d’aluminate ferrique (Camilleri et al. 2005)
Mélangé à de l’eau, son temps moyen de prise est de 2 h 45 mn. Mélangé à de l’eau enrichi avec de Chlorure de Calcium, le temps de prise est réduit à 14-15 minutes (le MTA-Angelus par exemple).
Propriétés physiques
La solubilité du MTA est décrite comme faible ou nulle (Shie et al.2009) et est dépendante du ratio poudre/liquide. Plus l’on ajoute de l’eau plus il devient soluble et poreux.
Il possède d’excellentes aptitudes de scellement et d’étanchéité (Torabinejad et al .1993 et 1995b) grâce à la taille micrométrique de ses particules (1,5 um) qui s’infiltrent dans le faible diamètre des tubuli dentinaires. Cette pénétration au sein de la structure dentinaire explique en partie son excellente adhésion aux tissus dentaires.
En milieu humide, les propriétés du matériau s’améliorent avec le temps. L’hydratation permanente le bonifie (Parirokh et Torabinejad, 2010). De plus, une éventuelle contamination avec du sang n’altère en rien ses propriétés biologiques mais diminue sa résistance à la compression.
Propriétés biologiques
Les études histologiques en coiffage pulpaire direct, aussi bien chez l’animal que chez l’humain, montrent que le MTA génère moins d’inflammation pulpaire et induit la formation d’un pont dentinaire plus épais et de manière plus reproductible comparé à l’hydroxide de calcium (Nair et al 2008).
Pour le traitement des perforations et en chirurgie endodontique pour l’obturation a retro, la cicatrisation des tissus parodontaux au contact du MTA est excellente. (Shanbahang et Torabinejad, 2000; Ham et al. 2005).
Indications cliniques
L’utilisation du MTA est indiquée pour les traitements suivants :
- coiffage pulpaire direct
- pulpotomie
- bouchon apical en cas de dents à apex ouvertes (résorption externe inflammatoire)
- bouchon apical sur de dents immatures (apexification)
- scellement de communications endo-parodontales iatrogènes (stripping, zipping) ou non iatrogènes (résorptions externes)
- obturation a retro en endodontie chirurgicale
On retrouve dans toutes ces indications un même objectif : le matériau vient fermer la brèche entre deux espaces anatomiques, que ce soit entre la pulpe et le milieu buccal, pour le coiffage pulpaire direct et la pulpotomie ou entre l’endodonte et le parodonte, pour le cas d’apexification, perforations ou comme matériau d’obturation en endodontie chirurgicale. Une fois la brèche fermée, ces matériaux induisent une réaction biologique à leur contact qui permet la mise en place d’une seconde fermeture, biologique quant à elle.
Inconvénients
Ces matériaux présentent quelques désagréments voire inconvénients
- Décoloration
L’oxyde de bismuth utilisé comme radio-opacifiant est responsable du changement de couleur du jaune au brun foncé de la dent traitée.
- Difficulté de manipulation
- Temps de prise long (Asgary et al .2006) et difficilement compatible avec des traitements en une séance.
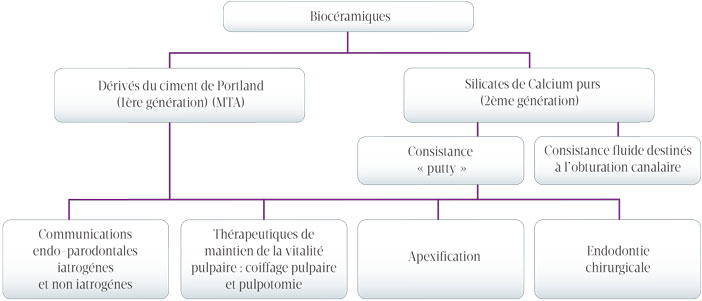
Tableau 1 : biocéramiques type et indications thérapeutiques
Les silicates tricalciques
Pour pallier les problèmes rencontrés avec ces matériaux pourtant très intéressants sur le plan biologique, des matériaux de deuxième génération ont été développés. Les principales évolutions ont été d’éliminer les métaux lourds et la présence d’aluminium, en fabricant de façon synthétique le principe actif des ciments de Portland. C’est ainsi que sont nés les ciments mono ou diphasiques à base de Silicate de calcium.
L’oxyde de bismuth a été remplacé par d’autres radio-opacifiants (oxyde de zirconium notamment) et la manipulation a été facilitée. L’introduction des matériaux de deuxième génération s’est accompagnée de la démocratisation du terme de Biocéramique.
Cependant, scientifiquement, le terme peut n’est pas être assez précis. Le terme « céramique » fait généralement référence à tous les verres, à la zircone et à la porcelaine.
Le terme biocéramique est fréquemment utilisé pour décrire les matériaux de seconde génération (tableau 1).
Les biocéramiques sont composées essentiellement de silicate tricalcique pur pour les monophases (Biodentine et BioRoot par exemple) ou par un mélange de Silicate di- et tri-calcique pour les ciments diphasiques (Totalfill (FKG Suisse) par exemple.
L’oxyde de bismuth a également été remplacé par de l’oxyde de tantale ou de zirconium.
Biodentine
La biodentine est un silicate de calcium commercialisé en 2009 par le laboratoire Septodont (Saint Maur des Fossés, France), elle combine de hautes propriétés mécaniques et une excellente bioactivité.
Grâce à ses propriétés physiques proches de la dentine, elle est souvent appelée « dentine en capsule » faisant référence à sa présentation commerciale.
L’unicité de Biodentine réside non seulement dans sa chimie innovante, mais également dans son application universelle, tant au niveau de la couronne que de la racine.
Propriétés physiques
Comme pour le MTA le respect du ratio poudre/liquide est important pour le maintien des propriétés physiques du matériau après sa prise. Si du liquide est ajouté en excès, la porosité augmente et la résistance est altérée.
Le temps de travail de Biodentine est d’environ 6 minutes avec une période initiale de manipulation de 9-12 minutes et le temps de prise final de 45 minutes. L’adjonction de Chlorure de calcium à l’eau du mélange est responsable de la diminution du temps de prise.
Les propriétés mécaniques de la Biodentine (résistance à la compression supérieure à 200 MPa), dureté 90 HVn, et module de élasticité 18,3 GPa) démontre un comportement similaire à la dentine naturelle.
Propriétés biologiques
La Biodentine est capable de stimuler la prolifération, la migration et l’adhésion de cellules souches du tissu pulpaire (DPSCs) (Loison-Robert et al .2018) mais également la biominéralisation (Zanini et al. 2012). Tous ces processus biologiques sont ceux impliqués dans le processus de réparation et cicatrisation pulpaire.
En associant les trois propriétés du matériau, à savoir étanchéité, stimulation biologiques et propriétés mécaniques proche de celles de la dent, la Biodentine permet à la fois une utilisation en coiffage pulpaire et pour la restauration de la dent en tant que substitut dentinaire.
La Biodentine se présente donc comme un matériau de choix pour les traitements de coiffage pulpaire indirect, coiffage pulpaire direct, pulpotomie partielle, pulpotomie camérale.
Pour d’autres raisons, ce matériau est particulièrement intéressant pour le traitement par apexification, le traitement des perforations et l’obturation a retro en chirurgie.
Les silicates tricalciques destinés à l’obturation canalaire
Les silicates de calcium destinés à l’obturation canalaire ont considérablement modifié la conception de l’obturation canalaire. Utilisés avec un cône de gutta percha, ces matériaux ne sont plus utilisés en tant que ciment de scellement, mais bien en tant que matériau d’obturation à part entière. Le canal est dorénavant rempli avec le matériau fluide, et un cône de gutta est placé en son centre en tant que tuteur.
Cette approche permet d’envisager l’idée d’obtenir une liaison chimique entre le matériau et les parois de dentine radiculaires aboutissant à une fermeture biologique de l’endodonte vers le parodonte sans le risque de dissolution du joint de ciment qui représente le talon d’Achille des techniques faisant appel à des ciments de la famille des eugénates.
Une variété de ciments à base de silicate tricalcique est disponible : BioRoot™ RCS (Septodont); Endosequence BC (Innovative Bioceramix,Inc) et Totalfill (Brasseler/FKG).
Intérêt clinique et pratique
Ce matériau doit être considéré comme un matériau d’obturation et non un simple ciment. Le cône de gutta percha est utilisé comme un tuteur, non pas pour constituer le corps de l’obturation, mais comme moyen de pousser le matériau en direction apicale d’une part, et pour rendre possible une éventuelle reprise de traitement d’autre part.
Les partisans de cette approche, soulignent trois avantages :
- le temps gagné avec cette technique par rapport à la technique de référence (compactage vertical à chaud),
- la biocompatibilité et bio-activité du matériau en contact avec les tissus péri-apicaux et sa résistance hydrique.
- La reproductibilité des résultats et la faible courbe d’apprentissage nécessaire pour la maitrise de la technique.
Les détracteurs quant à eux soulèvent le manque de recul clinique et scientifique permettant de valider le concept. Pour eux, la désobturation d’un canal avec ces matériaux pourraient s’avérer être problématique.
Cas clinique 1
Cette dent #47 présentant une pulpite irréversible (a) a été traitée par une pulpotomie camérale permanente.
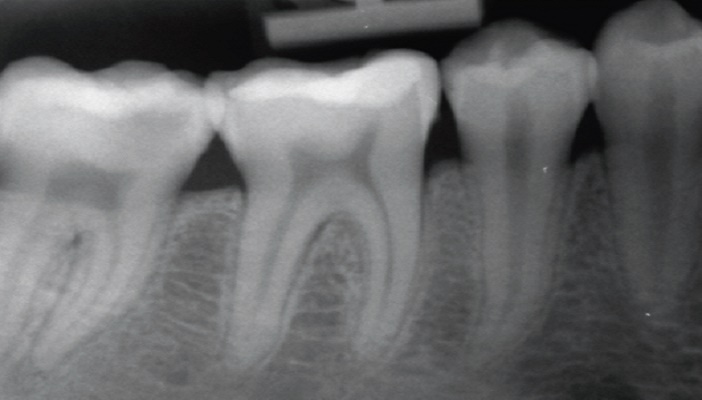
Après élimination de la pulpe dans la chambre pulpaire, la cavité a été désinfectée et obturée avec de la Biodentine (Septodont, Saint Maur des Fossés) (b). Les filets radiculaires ont ainsi été protégés par un coiffage pulpaire direct.
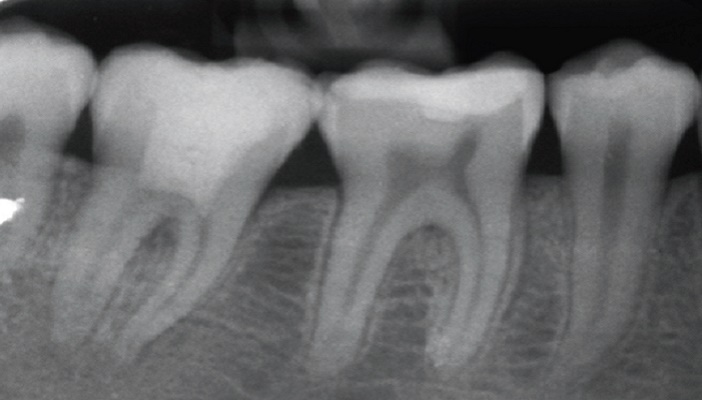
1 mois après le traitement endodontique partiel, une cavité a été réalisée dans l’épaisseur du matériau afin de placer un composite collé.
Cas clinique 2
Traitement d’une communication endo-parodontale non iatrogène liée à une résorption cervicale externe (Courtoisie Pr Stéphane Simon, CHU Rouen)
a – radiographie rétro alvéolaire de la dent #11
b – Coupe sagittale extraite d’un CBCT petit champ centré sur la dent. Noter la persistance de la prédentine qui est épargnée par le processus de destruction et qui apparaît comme une ligne blanche sur le cliché.
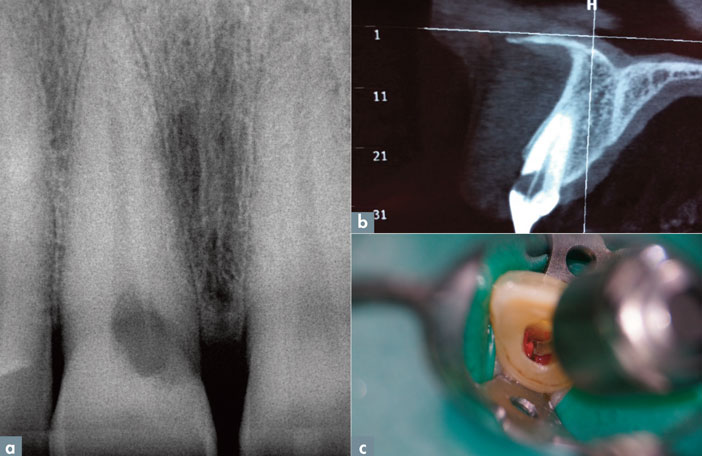
Ces images sont pathognomoniques d’une résorption externe.
c – Le traitement est fait en deux temps, dans une même séance. Une pulpotomie profonde est effectuée afin de se placer sous le niveau de la résorption. Le canal est obturé avec de la Biodentine.
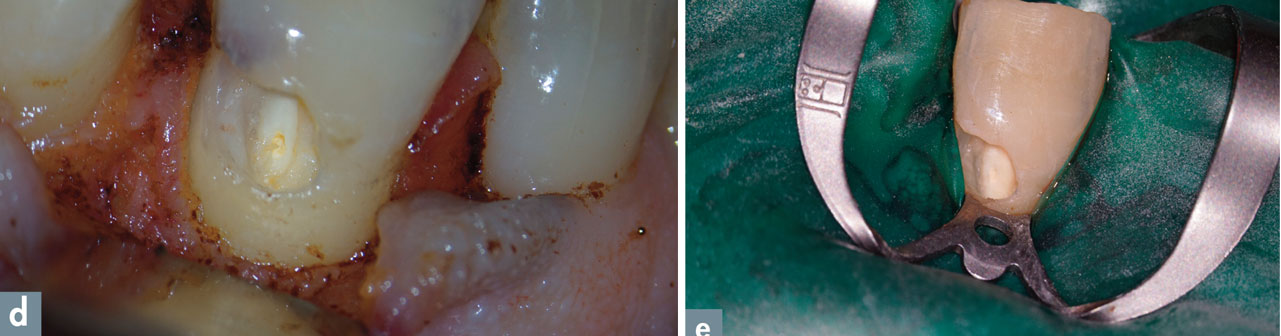
d et e – Dans un second temps, un abord chirurgical permet d’accéder à la lésion, d’éliminer l’ensemble du tissu résorbé et enfin d’obturer la cavité avec un composite collé.
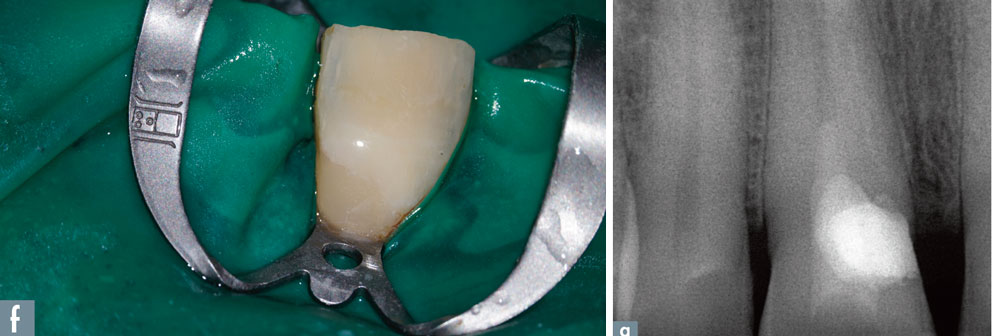
f et g – Vue clinique et radiographie post opératoire
Conclusion
En 1962, l’écrivain Thomas Kuhn a publié son livre de référence, « The Structure of scientifique révolutions (Kuhn 1962). Il a soutenu que la science n’est pas simplement une accumulation linéaire de données et de théories, un processus qu’il a appelé « science normale ». Au lieu de cela, il a proposé qu’il y ait de longues périodes de science normale interrompue par une révolution scientifique de la pensée qui conduit à un changement de paradigme suivi d’une autre période de science normale.
En transposant cette notion à l’odontologie (toute proportion gardée en ce qui concerne la notion de révolution), on réalise que ce qui est proposé par les industriels, comme étant une révolution, finit parfois par s’installer avec le temps dans la pratique quotidienne. Ceci se vérifie notamment avec l’implantologie, la numérisation, etc…
Faut-il pour autant se jeter sur tous les matériaux qui arrivent dans le marché ? Certes, les biocéramiques constituent une (r)évolution dans la dentisterie pour tous les motifs cités ci-dessus, mais ils ne sont pas magiques. En endodontie les principes biologiques et mécaniques dictés par le Pr Herbert Schilder en 1974 demeurent d’actualité, mais ne devrait pas entraver systématiquement la réflexion vers une évolution.
Bibliographie
1. Best, S. M., Porter, A. E., Thian, E. S., & Huang, J. (2008). Bioceramics: past, present and for the future. Journal of the European Ceramic Society, 28(7), 1319-1327.
2. Witte. The filling of a root canal with Portland cement. German Quarterly for Dentistry. J Cent Assoc German Dent. 1878;18:153–154.
3. Camilleri, J., Montesin, F. E., Brady, K., Sweeney, R., Curtis, R. V., & Ford, T. R. P. (2005). The constitution of mineral trioxide aggregate. Dental Materials, 21(4), 297-303.
4. Shie, M. Y., Huang, T. H., Kao, C. T., Huang, C. H., & Ding, S. J. (2009). The effect of a physiologic solution pH on properties of white mineral trioxide aggregate. Journal of endodontics, 35(1), 98-101.
5. Torabinejad, M., Watson, T. F., & Ford, T. P. (1993). Sealing ability of a mineral trioxide aggregate when used as a root end filling material. Journal of endodontics, 19(12), 591-595.
6. Torabinejad, M., Hong, C. U., Lee, S. J., Monsef, M., & Ford, T. R. P. (1995). Investigation of mineral trioxide aggregate for root-end filling in dogs. Journal of endodontics, 21(12), 603-608.
7. Parirokh, M., & Torabinejad, M. (2010). Mineral trioxide aggregate: a comprehensive literature review—part III: clinical applications, drawbacks, and mechanism of action. Journal of endodontics, 36(3), 400-413.
8. nair, P. n., Duncan, H. F., Pitt Ford, T. R., & Luder, H. U. (2008). Histological, ultrastructural and quantitative investigations on the response of healthy human pulps to experimental capping with mineral trioxide aggregate: a randomized controlled trial. Int Endod J, 41(2), 128–150.
9. Shabahang, S., & Torabinejad, M. (2000). Treatment of teeth with open apices using mineral trioxide aggregate. Practical Periodontics and Aesthetic Dentistry, 12(3), 315-320.
10. Ham, K. A., Witherspoon, D. E., gutmann, J. L., Ravindranath, S., gait, T. C., & Opperman, L. A. (2005).
11. Preliminary evaluation of BMP-2 expression and histological characteristics during apexification with calcium hydroxide and mineral trioxide aggregate. Journal of endodontics, 31(4), 275-279. Asgary, S., Parirokh, M., Eghbal, M. J., Stowe, S., & Brink, F. (2006). A qualitative X-ray analysis of white and grey mineral trioxide aggregate using compositional imaging. Journal of materials science: materials in medicine, 17(2), 187-191.
12. Loison-Robert, L. S., Tassin, M., Bonte, E., Berbar, T., Isaac, J., Berdal, A., … & Fournier, B. P. (2018). In vitro effects of two silicate-based materials, Biodentine and BioRoot RCS, on dental pulp stem cells in models of reactionary and reparative dentinogenesis. PloS one, 13(1), e0190014.
13. Zanini, M., Sautier, J. M., Berdal, A., & Simon, S. (2012). Biodentine induces immortalized murine pulp cell differentiation into odontoblast-like cells and stimulates biomineralization. Journal of endodontics, 38(9), 1220-1226.
14. Thomas, K. (1962). The structure of scientific revolutions.




