Les facteurs microbiens
Mombelli et Lang (1998), montrent qu’il existe essentiellement cinq faisceaux de preuves en faveur de l’étiologie bactérienne. Notons-en quelques-unes : les flores bactériennes associées à l’échec et au succès implantaires sont toujours différentes, tant du point de vue qualitatif que quantitatif. L’utilisation d’une thérapeutique antimicrobienne autour d’un implant atteint d’une péri-implantite entraîne une amélioration de son statut clinique. Le niveau de l’hygiène orale a un impact sur le succès à long terme de la thérapeutique implantaire.
Selon Renvert et al. (2007), la plupart des complications biologiques qui apparaissent autour des implants ostéointégrés sont associées à une colonisation bactérienne chez un sujet à risque.
Formation du biofilm primaire
La plaque péri-implantaire est organisée en biofilm. Cette pellicule permet l’adsorption des bactéries grâce aux constituants de leur paroi.
Cette première couche organique se dépose immédiatement après l’exposition de l’implant dans la cavité buccale. Dès les premières minutes qui suivent, des bactéries isolées viennent y adhérer. Ces dernières commencent alors leur processus de division et, en quelques heures, forment de larges agrégats bactériens.
Similitude avec les parodontites
Les colonisateurs primaires sont essentiellement des cocci à Gram positif. La formation du biofilm primaire a été étudiée sur des implants Straumann® en utilisant la technique d’hybridation ADN-ADN. Ces auteurs rapportent la présence d’une colonisation bactérienne du sulcus péri-implantaire dans les trente minutes qui suivent la pose de l’implant. Aussi, ils constatent que l’organisation des colonies bacté- riennes du biofilm primaire est différente de celle rencontrée à la surface de la dent naturelle. Ces résultats sont en accord avec ceux obtenus dans d’autres études.
Les facteurs de risques
Antécédent de parodontite
Avant tout traitement implantaire, la maladie parodontale doit être traitée puis stabilisée, car la pose d’implants dans un environnement parodontal inadéquat pourrait compromettre le succès implantaire.
En 2009, Renvert et al. ont réalisé une revue de littérature dans laquelle ils retiennent 3 études comparant la perte d’os au niveau des implants atteints d’une péri-implantite chez des patients avec et sans antécédents de parodontite, sur une période d’au moins 5 ans (Hardt et al. 2002, Karoussis et al. 2003, Mengel et al. 2007). L’étude de Hardt et al. (2002), montre que la perte osseuse autour des implants n’est pas significative entre les 2 groupes. Il suggère que le risque de perdre un implant chez les sujets avec un antécédent de parodontite est de 2 :1. Mais la nature rétrospective de cette étude ne permet pas l’évaluation des conditions cliniques. Dans l’étude de Karoussis et al. (2003), si l’échec est défini par une profondeur de poche ≥ 5 mm, un saignement au sondage et une perte osseuse de 0,2 mm par an, les taux de succès sont de 79,1 % pour les sujets sans antécédent de parodontite et de 52,4 % pour les sujets avec antécédents de parodontite.
Ces sujets ont plus souvent des complications au niveau des implants. Mengel et al. (2007), étudient les sujets présentant des antécédents de parodontite agressive et montrent une perte osseuse autour des implants après 1 an de 1,3 mm contre 0,3 mm chez les sujets sains.
En utilisant des stratégies différentes, il est devenu évident que les différences de conception des études, de diagnostic des parodontites, de suivi ainsi que les méthodes d’inclusion des sujets ne permettent pas d’en tirer une méta-analyse (Renvert et al. 2009).
Le problème de ces études reste le nombre réduit de l’échantillon, qui est inadéquat pour tirer de réelles conclusions. Karoussis et al. (2007) notent une absence de différence significative dans la survie des implants à court ou long terme entre des patients avec ou sans antécédents de parodontite, mais ceux avec antécédents de parodontite auraient une incidence plus élevée de péri-implantite.
Schou et al. (2006) concluent que la survie de la suprastructure et de l’implant ne dépendent pas du statut parodontal, bien que l’incidence de la péri-implantite pourrait significativement augmenter chez des patients avec une parodontite. Il semblerait que ces études laissent penser que la parodontite serait un facteur de risque à prendre en compte dans la survenue des péri-implantites.
Le diabète
Le diabète est une maladie systémique qui agit à plusieurs niveaux sur la capacité de cicatrisation, il augmente la susceptibilité des patients aux infections et le taux d’échec implantaire (Fiorellini et Nevins 2000).
Si plusieurs études ont recherché l’association entre le diabète et l’échec implantaire, (Kotsovilis et al. 2006, Mombelli et Cionca 2006), celles qui ont étudié l’association entre diabète et péri-implantites sont rares. Ferreira et al. (2006), avec un suivi de 6mois à 5 ans, notent que chez les sujets diabétiques, la prévalence de la périimplantite est de 8,9 %. La prévalence de la parodontite au niveau du même groupe est de 14,2 %.
La parodontite et le diabète ont également été associés avec un risque augmenté de péri-implantite, en particulier chez les sujets avec un mauvais contrôle de leur diabète (Ferreira et al. 2006).
Prédispositions génétiques
Les interleukines IL-1α, IL-1β et leurs inhibiteurs spécifiques IL-1 receptor antagonist (IL-1ra) jouent un rôle clé dans la régulation de la réponse inflammatoire. Plusieurs études ont recherché l’association entre un polymorphisme génétique des gènes IL-1α et IL-1β et la périimplantite. Mais les résultats semblent contradictoires (Heitz-Mayfield 2008).
Le tabac
Strietzel et al. (2007), rapportent un risque significativement plus élevé de développer une péri-implantite chez le patient tabagique. Gruica et al. (2004) et McDermott et al. (2003) rapportent que les patients fumeurs ont un risque significativement plus important de développer une péri-implantite. Pour Haas et al. (1996), le groupe fumeur présentait significativement plus de saignement au sondage, de perte d’attache, d’inflammation des tissus péri-implantaires et de perte osseuse à la radiographie.
D’autres études sur les indicateurs de risque des maladies péri-implantaires, rapportent une association significative du tabagisme avec la mucosite péri-implantaire, la perte osseuse marginale et la péri-implantite (Roos-Jansåker et al. 2006, Fransson et al. 2008).
L’hygiène bucco-dentaire
Lindquist et al. (1997) notent une association significative entre mauvaise hygiène buccale et perte osseuse péri-implantaire. Cette association est plus significative chez les patients fumeurs qui présentent trois fois plus de perte osseuse périimplantaire que les patients avec une mauvaise hygiène buccale non fumeurs. Une très mauvaise hygiène buccale (indice de plaque ≥ 2) est fortement associée à la présence de péri-implantite (Ferreira et al. 2006) (Fig. 1 et 2).
Serino et Ström (2009) abordent dans leur étude l’accès à l’hygiène au niveau des sites implantaires et considèrent ce facteur local comme fortement associé à la péri-implantite.
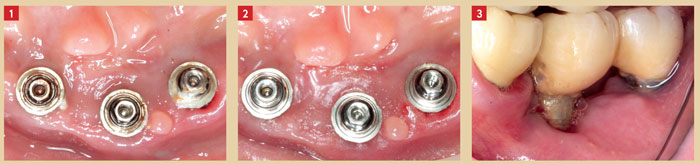
Fig. 1 : dépose du bridge implanto-porté, présence de plaque bactérienne au niveau des piliers Fig. 2 : vue clinique après débridement par aéropolisseur, irrigation à la bétadine et à l’eau oxygénée au niveau des piliers Fig. 3 : absence de gencive kératinisée autour des implants associée à une péri-implantite
Présence de tissu kératinisé
Les études expérimentales n’ont pas réussi à déterminer une hauteur adéquate de gencive kératinisée d’une dent naturelle. L’ensemble des travaux convergent sur la nécessité de la présence de muqueuse kératinisée autour des implants. Pour Roos-Jansåker et al. (2006), il n’existe aucune association entre l’absence de muqueuse kératinisée et la présence d’une maladie péri-implantaire (Fig. 3).
Lin et al. (2013) observent qu’un manque de tissu kératinisé autour des implants est lié à une accumulation de plaque, une inflammation tissulaire, une récession gingivale ainsi qu’une perte d’attache.
L’excès de ciment de scellement des prothèses scellées implanto-portées
Wilson (2009) a tenté, dans une étude prospective, d’établir le lien entre un excès de ciment de scellement et une augmentation du risque d’apparition d’une lésion péri-implantaire. Son étude regroupe 39 patients montrant des signes cliniques et/ou radiographiques d’inflammation péri-implantaire sur une période de 5 ans.
L’auteur a conclu que des excès de ciment sont associés à des signes d’affection péri-implantaire dans la majorité des cas (81 %). Après l’élimination des excès de ciment, aucun signe clinique et endoscopique d’affection péri-implantaire sur 74 % des implants tests n’était observé. Cette étude est en accord avec les conclusions d’autres auteurs dont Stephan Renvert (2009) qui considère que l’excès de ciment joue le même rôle qu’une ligature lorsque l’on veut provoquer une péri-implantite expérimentale (Fig. 4 à 6).
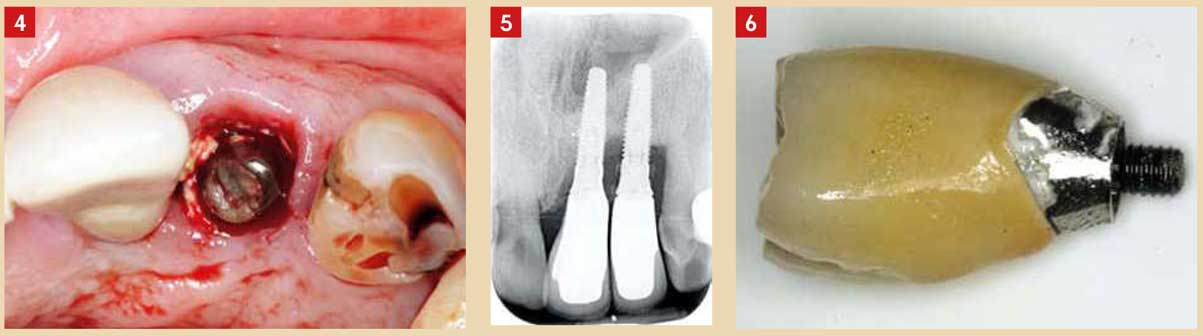
Fig. 4 : excès de ciment visible cliniquement Fig. 5 : péri-implantite associée à un excès de ciment visible radiographiquement Fig. 6 : excès de ciment autour d’un pilier en titane
Caractéristiques de l’état de surface implantaire
Les caractéristiques d’une surface implantaire dépendent du relief (irrégularité de surface), de la rugosité et de la composition chimique de cette dernière. La majorité des implants actuellement sur le marché présente des surfaces avec un indice de rugosité (Ra) modérée (Ra entre 1,0 et 2,0µ) avec une meilleure réponse osseuse que les implants à surface usinée ou fortement rugueuse (Albrektsson et Wennerberg 2004). Astrand et al. (2004) comparent différentes surfaces implantaires dans une étude clinique randomisée avec un suivi de 3 ans. Aucune différence statistiquement significative n’est trouvée entre les différents types d’implants (surface usinée ou rugueuse), à l’exception de la fréquence de la péri-implantite qui est plus élevée pour les implants à surface rugueuse. Des résultats semblables concernant la perte osseuse autour d’implants usinés (Ra +/- 0,5 µ) contre des implants modé- rément rugueux sont rapportés dans une étude prospective randomisée avec un suivi sur 5 ans de 51 sujets (Wennström et al. 2004).
Pour plus de détail, voir le prochain chapitre.
Le facteur occlusal
Van Stenberghe et al. (1999) ont rapporté une augmentation significative de la perte osseuse péri-implantaire, en rapport avec une surcharge occlusale. Cependant, ces études ne peuvent pas contrôler d’une façon appropriée la quantité et la durée de la surcharge mécanique, ce qui explique la grande variété des résultats.
Hurzeler et al. (1995) ne trouvent pas de perte significative de l’ostéointégration avec des surcharges occlusales expérimentales. Dans une autre étude d’Isidor (1997), les implants exposés à un traumatisme occlusal, durant dix-huit mois, montrent des signes de résorption progressive conduisant à une mobilité implantaire et à la perte de l’implant au bout de 4 à 5mois. Dans un cas de péri-implantite mandibulaire, Mattout et al. (2009) ont noté une surcharge occlusale associée à une charge bactérienne faible mais faisant intervenir des bactéries parodonto-pathogènes. La différence entre les observations faites par les auteurs est peut-être due à plusieurs paramètres, qui varient selon les études, tels que la forme de l’implant, la flexibilité des piliers, la présence et la durée d’une surcharge occlusale et son amplitude. Il a été observé que la destruction des tissus péri-implantaires commence à se produire avec 250 µm de hauteur occlusale excessive. Quand cette charge occlusale se transmet aux tissus péri-implantaires, elle entraîne une destruction osseuse plus importante que celle induite par la plaque bactérienne.
Mais selon Renvert, la surcharge occlusale ne peut pas être à l’origine d’une péri-implantite. Selon lui, le traumatisme occlusal entraînant systématiquement la fibrointégration de l’implant, l’étiologie de la péri-implantite reste exclusivement infectieuse.
Ce qu’il faut retenir
- L’étiologie principale de la péri-implantite reste microbienne. Les études sont encore trop controversées en ce qui concerne l’origine occlusale exlusive.
- Notons que quelques facteurs sont plus à risque dans le développement de la péri-implantite : les antécédents de parodontite, le tabac et le manque d’hygiène bucco-dentaire.
- Ne pas oublier les excès de ciment dans la prothèse implanto-portée scellée qui peuvent causer des dégâts importants.
Lectures conseillées
1. DE BOEVER A.L., DE BOEVER J.A. Early colonization of non-submerged dental implants in patients with an history of advanced aggressive periodontitis. Clin. oral implants res., 2006, 17 (Suppl. 1), p.8-17.
2. FÜRST M., SALVI G.E., LANG N.P., PERSSON G.R. Bacterial colonization immediately after installation on oral titanium implants. Clinical oral implants res., 2007, 18, p.501-508.
3. HÜRZELER M.B., QUIÑONES C.R., SCHÜPBACH P., VLASSIS J.M., STRUB J.R., CAFFESSE R.G. Influence of the suprastructure on the peri-implant tissues in beagle dogs. Clin. oral implants res., 1995, 6 (Suppl. 3), p.139-148.
4. ISIDOR F. Histological evaluation of peri-implant bone at implants subjected to occlusal overload or plaque accumulation. Clin. oral implants res., 1997, 8, p.1-9.
5. MATTOUT P., KETATA N., VAIDA C., LASCU L. Les maladies peri-implantaires : Prévalence, étiologie et abord thérapeutiques. J. parodontol. implantol orale., 2009, Vol 28 (Suppl. 3), p. 207-223.
6. MIYATA T., KOBAYASHI Y., ARAKI H., OHTO T., SHIN K. The influence of controlled occlusal overload on peri-implant tissue. Part 3: A histologic study in monkeys. Int. j. oral maxillofac. implants., 2000, 15 (Suppl. 3), p.425-431.
7. MOMBELLI A., LANG N.P. The diagnosis and treatment of peri-implantitis Periodontol. 2000., 1998, 17, p.63-76.
8. QUIRYNEN M., VOGELS R., PEETERS W., VAN STEENBERGHE D., NAERT I., HAFFAJEE A. Dynamics of initial subgingival colonization of pristine peri-implant pockets. Clin. oral implants res., 2006, 17, p. 25-37.
9. RENVERT S., PERSSON G.R. Periodontitis as a potential risk factor for periimplantitis. J. clin. periodontol., 2009, 36 (Suppl. 10), p. 9-14.
10. RENVERT S., ROOS-JANSÅKER A.M., LINDAHL C., RENVERT H., RUTGER-PERSSON G. Infection at titanium implants with or without a clinical diagnosis of inflammation. Clin. oral implants res., 2007, 18 (Suppl. 4), p.509-516.
11. VAN STEENBERGHE D., NAERT I., JACOBS R., QUIRYNEN M. Influence of inflammatory reactions vs occlusal loading on peri-implant marginal bone level. Adv. dent. res., 1999, 13, p.130-135.
12. WALKER J.T., BRADSHAW D.J., BENNETT A.M., FULFORD M.R., MARTIN M.V., MARSH P.D. Micobial biofilm formation and contamination of dental-unit water systems in general dental practice. App. Environ. microbiol., 2000, 66, p.3363-3367