L’usage des « vasoconstricteurs » dans les solutions anesthésiques utilisées en dentisterie est connu depuis le début du XXe siècle. Il est pratiquement systématique actuellement, mais les « vasoconstricteurs », s’ils présentent de nombreux avantages, ont aussi quelques inconvénients. Le but de notre étude était de déterminer s’il était possible de substituer aux « vasoconstricteurs » contenus dans les solutions anesthésiques une substance permettant de conserver les effets positifs de ceux-ci et d’en éliminer les inconvénients.
Rôle des « vasoconstricteurs » en anesthésie dentaire
L’appellation « vasoconstricteur » concernant l’adrénaline et la noradrénaline est en fait inappropriée et ne met en valeur qu’une facette de l’activité de ces deux produits. Ces deux molécules sont des catécholamines endogènes qui agissent sur le système nerveux autonome qui régit particulièrement le cœur et les vaisseaux.
Elles ont une action ambivalente, vasodilatatrice centrale et vasoconstrictrice périphérique, ceci à des niveaux différents. Ceci est un raccourci extrême de l’action sympathomimétique de ces deux produits.
On devrait donc les qualifier de « vasoactifs » pour ne pas oublier cette vasodilatation centrale prépondérante dans l’action de ces produits, particulièrement l’adrénaline.
L’adrénaline est utilisée en anesthésie dentaire depuis plus d’un siècle. Dès les débuts de l’« Anesthésie » on s’était rendu compte que l’adrénaline était indispensable, tout d’abord, pour sa fonction de vasoconstriction : « la fonction vasoconstrictive a pour corollaire la fonction hémostatique.
En effet, une hémorragie, même abondante, est presque toujours instantanément arrêtée par une application d’adrénaline » (1). Cette fonction hémostatique est particulièrement intéressante en chirurgie parodontale lorsque l’on intervient sur des territoires étendus, et devient indispensable dans la chirurgie des lésions apicales et dans les interventions de longue durée.
Les autres actions de l’adrénaline étaient déjà clairement énoncées il y a un siècle : « On peut donc conclure de l’observation des faits que l’adrénaline augmente le pouvoir anesthésique de la cocaïne et permet en tissus sains ou enflammés de diminuer en proportion marquée la dose de ce médicament. Elle rend l’anesthésie plus intense et plus prolongée. Enfin l’adrénaline posséderait encore la précieuse propriété d’empêcher l’action toxique de la cocaïne » (1).
Pour résumer, on peut dire que l’adrénaline, qui est le vasoactif de référence, renforce et prolonge l’anesthésie en permettant de diminuer les quantités injectées tout en améliorant le confort chirurgical du praticien. À cette époque, le principe de diffusion de l’anesthésique, qui a pour conséquence une dilution du principe actif, et donc une diminution de la puissance, n’était pas clairement exprimé.
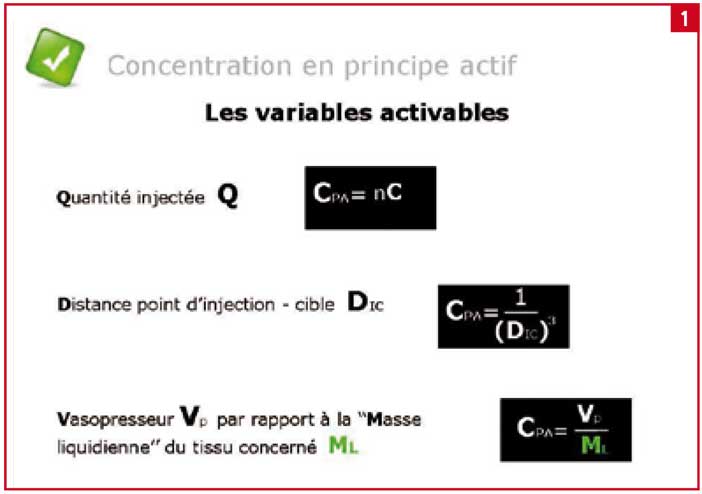
Cependant il était déjà suggéré dans cette réflexion du Dr Léon Granjon « je pense que si la cocaïne n’agit pas sur les tissus enflammés, c’est qu’elle est, à peine injectée, entraînée dans la circulation générale par les vaisseaux dilatés à l’excès » (1). Depuis le principe de dilution a été clairement explicité. On sait que, par exemple, la concentration de 4 % d’articaïne qui se trouve à la sortie de l’aiguille baisse de façon exponentielle en fonction de l’éloignement à partir de son extrémité. Cette baisse de concentration en principe actif est due à une dilution dans les liquides tissulaires. Cette dilution se fait dans toutes les directions et est fonction de la « charge en eau » du tissu. Chaque élément participant à cette dilution ou s’y opposant a été analysé (2) (Fig. 1 et 2).
Pour oublier le côté un peu abstrait de la formule mathématique et pour ne pas oublier que la dilution se fait dans les trois plans de l’espace et suit donc une courbe exponentielle, on pourrait uniquement se souvenir d’une formule plus imagée, en donnant la parole à l’anesthésique : « en m’éloignant un peu de l’aiguille, je perds énormément de ma puissance ».
Pour que l’anesthésie fonctionne, sur des tissus sains ou enflammés, il faut faire en sorte que la dilution inéluctable, due à la diffusion du produit, n’abaisse pas la concentration de celui-ci en dessous du seuil minimal actif.
D’où l’utilisation d’un « vasoconstricteur », qui diminuant le diamètre des capillaires au niveau et à la périphérie du point d’injection, ralentit et diminue la diffusion de l’anesthésique et donc la dilution de son principe actif.
La vasoconstriction locale du vasoactif :
- augmente la concentration du produit anesthésique sur place, donc le rend plus puissant ;
- est proportionnelle à sa concentration, pour sa puissance et sa durée.
C’est pourquoi, plus un tissu est inflammatoire (dent en pulpite, dent infectée), plus on devra augmenter la proportion du vasoconstricteur.
Dans ce cas de figure, se contenter d’une concentration minimale à 1/200 000e est purement symbolique et parfaitement inopérant.
Pourquoi vouloir supprimer les vasoconstricteurs ?
Nous venons de voir le volet positif de l’action des vasoactifs en anesthésie locale. Il est particulièrement intéressant, mais cette vasoconstriction tellement nécessaire a, hélas, une contrepartie, qui se situe à deux niveaux.
Au niveau local, une vasoconstriction puissante qui se prolonge dans le temps entraînera inéluctablement une souffrance tissulaire qui peut aboutir à une nécrose, préférentiellement dans les tissus denses, peu irrigués et (ou) en circulation terminale, c’est-à-dire la papille inter dentaire, le ligament, la fibro muqueuse palatine, enfin le sommet du septum osseux, plus dense que l’os trabéculaire sous-jacent.
Il faut ajouter à cette vasoconstriction chimique, une vasoconstriction « mécanique », jamais décrite dans les livres d’anesthésie. Certainement aussi nocive que la vasoconstriction chimique, elle consiste tout simplement dans le fait que l’injection d’un liquide dans un tissu indéformable – fibro muqueuse- se fait en chassant et en remplaçant les liquides physiologiques cellulaires et extracellulaires (le sang) présents, par une solution anesthésique ayant un pH compris entre 3,5 et 5,5.
On peut facilement comprendre que la vasoconstriction mécanique ajoutée à la vasoconstriction chimique, le tout couronné par un abaissement du pH tissulaire de 3 points environ, pourront avoir des conséquences néfastes sur les tissus concernés.
Cette mise en lumière des éléments pouvant être à l’origine des nécroses ne met pas en cause la réalisation d’une technique particulièrement. Elle suggère tout simplement une utilisation inappropriée, quant à la quantité et au lieu d’injection, d’un produit potentiellement dangereux.
Au niveau général, l’action du vasoactif, matérialisée par une action vasodilatatrice, hypotensive ou hypertensive et chronotrope, est perçue comme beaucoup plus floue, beaucoup moins précise, donc plus angoissante (Fig. 3).
Ceci est dû au fait que l’adrénaline et la noradrénaline agissent directement sur des récepteurs dont la concentration et la répartition sont très variables selon les patients, et varient dans le temps.
Ces catécholamines ont des effets physiologiques très divers. Les récepteurs adrénergiques sont de deux types, alpha et bêta, très différents quant à leur action. On obtient des effets cardiaques, vasculaires, pulmonaires, oculaires, métaboliques et périphériques.
Nous ne rentrerons pas dans les détails. La somme de toutes ces actions est étendue et complexe et inquiète la plupart du temps le dentiste qui n’est pas familier de ce genre d’action.
Ce qu’il faut retenir, c’est que la réceptivité vis-à-vis de l’adrénaline et de la noradrénaline est très différente d’un patient à l’autre. Ce qui ne permet pas de systématiser les effets, pour une même quantité injectée.
Un autre problème est posé lorsque nous avons affaire à des patients ayant des pathologies associées, pouvant contre-indiquer la présence d’un vasoactif ou nécessiter une utilisation mûrement réfléchie, où le principe de précaution doit toujours être présent à l’esprit. Notre propos n’est pas de donner un guide d’utilisation des vasoactifs.
Il se trouve dans tous les livres d’anesthésiologie. Le mode d’action de ces catécholamines étant local et général, divers et complexe, rend leur utilisation angoissante pour une majorité de praticiens.
D’autre part, la présence d’un vasoactif dans une solution, nécessite, obligatoirement, l’addition de conservateurs et d’antioxydants, qui abaissent le pH et sont susceptibles de générer des phénomènes allergiques non négligeables.
L’action de ces vasoactifs peut se manifester, de façon totalement imprévisible et variable selon le patient par :
- une sensation de jambes « molles ».
- une tachycardie
- une hypotension, suivie d’une hypertension
- une hyperpnée.
Tous ces effets sont la manifestation visible de l’action métabolique des catécholamines. Tous ces symptômes variables et inconstants, font que beaucoup de praticiens, bien souvent, se limitent dans la pratique de l’anesthésie ou dans l’utilisation des vasoactifs, ce qui rend les anesthésies stressantes pour le praticien et inopérantes pour le patient.
À travers l’angoisse résultant de l’utilisation des vasoactifs sur le plan général et les conséquences locales potentiellement néfastes, la suppression et le remplacement des vasoactifs seraient une bonne chose.
Comment et par quoi les remplacer ?
Si l’on veut remplacer les vasoactifs, c’est pour en garder le volet positif : renforcement et prolongation de l’anesthésie ; leur suppression vise à éliminer tous les côtés négatifs que les praticiens maîtrisent mal. Si l’on retient l’idée qu’il faut maintenir au maximum sur place la molécule anesthésique, on sait à quel niveau il faudra agir. Il existe une possibilité « mécanique » de ralentir la diffusion d’un liquide : un liquide visqueux s’écoule moins vite et se répand moins loin qu’une solution ayant la viscosité de l’eau.
Notre hypothèse de travail de départ est donc : « Est-ce que le remplacement du vasoactif par un gel rendant la solution plus visqueuse peut permettre de ralentir la diffusion et d’obtenir des résultats identiques à ceux obtenus avec les solutions contenant un vasoactif ? »
Nous avons donc enlevé, de la solution anesthésique classique, le vasoactif et ses collatéraux (conservateur et antioxydants) et nous les avons remplacés par un gel biologique, constituant principal de la matrice extracellulaire du tissu conjonctif. Il est métabolisé par les enzymes hépatiques et plasmatiques. Il est utilisé sous forme injectable en chirurgie oculaire, en rhumatologie et en dermatologie. Il est donc parfaitement biocompatible et anallergique.
Pour résumer : nous avons retiré d’une cartouche d’anesthésique tout ce qui pouvait poser problème et nous l’avons remplacé par un gélifiant, sans aucun autre adjuvant. Ce gel n’a qu’une action mécanique sans aucune activité biologique.
Pour que la solution anesthésique ainsi conçue soit utilisable dans toutes les techniques anesthésiques dentaires, il faut qu’elle réponde à certains critères ; il faut que :
- le gel soit totalement résorbable, dans des délais acceptables.
- la solution gélifiée ne crée ni douleur ni inflammation.
- le gel n’empêche pas le passage de la molécule anesthésique à travers la corticale osseuse.
- la durée d’action, à quantité égale, soit identique aux solutions classiques.
- les suites post anesthésiques soient confortables.
- l’injection ne soit pas douloureuse, quelle que soit la technique anesthésique utilisée.
Avertissement
Pour répondre à tous ces critères, nous avons d’abord réalisé des tests que l’on peut qualifier d’études préliminaires, pour vérifier qu’il n’y a pas d’impossibilité initiale majeure qui rendrait l’hypothèse caduque.
Autrement dit, chaque test, bien que partiel et incomplet, nous autorise à aller un peu plus loin pour nous permettre finalement « d’esquisser » un résultat.

Tests
Première partie
Vérification des points 1 et 2 cités plus haut.
Le premier test a été réalisé par l’injection, en sous-cutané, au niveau de l’avant-bras gauche, d’un quart de cartouche d’articaïne à 4 % gélifiée. La zone infiltrée par le gel était parfaitement visible, légèrement plus blanche (vasoconstriction mécanique) et en légère surélévation. La sensibilité existait à 2 mm autour de la zone infiltrée.
Deux heures après l’injection du gel, la zone n’était pas plus étendue. On a obtenu plus de 2h30 d’anesthésie. Le lendemain, la zone n’était pas sensible, était sans surélévation, simplement un tout petit peu plus rouge.
Les tests suivants ont consisté à injecter, sur quatre personnes, en sous-cutané, au niveau des avant-bras, d’un côté, un quart de cartouche d’une solution d’articaïne à 4 % et 1/200 000e d’adrénaline et de l’autre côté, un quart de cartouche d’articaïne à 4 % gélifiée.
Il n’a été relevé, pendant les injections, réalisées avec une aiguille (30/100 de mm de diamètre et 21 mm de long), en rétro traçant, aucune différence significative dans les perceptions.
Il apparaît globalement que :
- la diffusion de la solution gélifiée était moins étendue que celle obtenue avec la solution contenant le vasoactif, – la perception de gonflement dû au gel a disparu en même temps que l’anesthésie.
- l’anesthésie est partie un peu plus rapidement du côté où le gel a été injecté.
Pour l’ensemble des participants, les anesthésies ont duré au minimum quatre heures, avec une légère prolongation de l’anesthésie pour la solution d’articaïne à 1/200 000e d’adrénaline.
Les zones injectées n’étaient plus visibles cinq heures, environ, après injection.
À ce stade des premiers tests, on peut dire que :
- la solution gélifiée occupe, à quantité égale, une zone moins étendue.
- il n’y a pas de réaction immédiate douloureuse ou inflammatoire.
- la résorption du gel se fait assez rapidement, environ quatre heures.
- la durée de l’anesthésie est légèrement moindre avec la solution gélifiée.
Deuxième partie
Vérification des points 3, 4, 5.
La suite des tests a consisté à :
- enregistrer à l’aide d’un pulp-tester, avant injection, les niveaux de référence de sensibilité des dents concernées (en général, au niveau des prémolaires supérieures à droite et à gauche).
- réaliser ensuite deux injections para apicales, d’une solution gélifiée d’un côté et d’une solution classique* de l’autre côté.
Les injections ont été faites, légèrement au-dessus des apex (2 à 3 mm), au contact osseux, en utilisant des molécules différentes – articaïne, lidocaïne, mépivacaïne.
Immédiatement après l’injection, nous avons mesuré le temps d’installation de l’anesthésie qui est obtenue lorsque le pulp-tester monte à 80, sans aucune réaction du patient.
Enfin, par des mesures successives, nous avons appréhendé le moment de la disparition de l’anesthésie, dès que le patient percevait les impulsions électriques et que le pulptester indiquait une valeur légèrement inférieure à 80 et que cette valeur décroissait progressivement ensuite.
De ces tests réalisés sur cinq personnes et répétés plusieurs fois, on a pu, sans entrer dans les détails, tirer les observations suivantes :
- la solution gélifiée passe la barrière de la corticale osseuse dans des délais identiques à ceux obtenus avec les solutions classiques*, soit environ trois à quatre minutes.
- la perception d’anesthésie des tissus mous est nettement améliorée avec la solution gélifiée (presque une sensation de confort).
- on obtient une durée d’anesthésie supérieure d’environ un quart d’heure entre la solution gélifiée et les mêmes solutions sans vasoactif.
- on obtient une très grande distorsion, pour le moment imprévisible, dans les durées d’anesthésie, pour une même quantité injectée.
Informations complémentaires obtenues lors de ces tests
- il n’y a aucune perception de tachycardie, ou sensation de malaise avec la solution gélifiée.
- on ne peut pas dépasser une certaine viscosité, sous peine d’entraîner une persistance un peu accrue de la voussure due à la présence du gel, ce qui entraîne un inconfort pour le patient.
- il n’y a pas de suite post-anesthésique.
- le pH des solutions gélifiées est relevé de 2 points environ, par rapport aux solutions classiques, ce qui ne peut que diminuer la cytotoxicité de ces solutions.
Troisième partie
Vérification du point 6 cité plus haut.
Nous pensions au départ qu’un ligament – tissu dense, indéformable – aurait du mal à accepter, sans douleur, une viscosité « élevée », celle utilisée en injection para apicale et qui laisse une sensation inconfortable persistante de présence du gel pendant deux à trois heures.
Nous avons donc commencé des tests avec une viscosité inférieure, ce qui ne provoquait aucune douleur. Et nous avons augmenté progressivement la viscosité pour constater que les anesthésies intra ligamentaires et les anesthésies diploïques autorisaient l’utilisation d’une viscosité plus élevée que celle acceptée en anesthésie para apicale.
Nous avons pu constater, aussi, que la présence de gel dans les solutions injectées en intraligamentaire permettait de visualiser les fuites de la solution anesthésique, qui sont le facteur majeur d’échec des anesthésies intra ligamentaires : ces fuites semblent beaucoup plus fréquentes que nous ne le pensions, ce qui pourrait remettre en question les conclusions des études réalisées jusqu’à ce jour sur les anesthésies intraligamentaires.
Quatrième partie
Cette partie concerne les anesthésies tronculaires.
Nous avons réalisé 20 anesthésies tronculaires :
- 10 injections d’une demi-cartouche de solution avec gel d’un côté
- 10 injections d’une demi-cartouche d’une solution de mépivacaïne sans « vasoconstricteur », ou d’articaïne à 1/200 000e, de l’autre côté.
La durée d’installation et le temps de persistance de l’anesthésie ont été mesurés, comme pour les anesthésies para apicales, avec le pulp-tester sur les dents n°35 et 45.
Globalement on peut dire que :
- les temps de prise sont identiques, environ entre 5 et 10 minutes.
- en anesthésie tronculaire, on peut injecter une viscosité plus élevée qu’en anesthésie para apicale, sans générer d’inconfort.
- l’anesthésie tronculaire réalisée avec gel dure deux à trois fois plus longtemps (entre deux et trois heures) que celle réalisée sans vasoactif – mépivacaïne – ou celle réalisée avec l’articaïne adrénalinée à 1/200 000e (environ une heure).
Conclusion
Dans les limites de cette étude, telles qu’elles ont été précisées, il nous semble possible de maintenir l’hypothèse formulée, et qu’on puisse remplacer les substances vasoactives contenues dans les solutions anesthésiques d’usage dentaire, par un gel biocompatible et résorbable.
On obtient, si on ne dépasse pas une certaine viscosité, une injection indolore, sans suite postopératoire, dont le délai d’installation et la durée d’action sont similaires, voire améliorés.
Une fois ces critères de base acquis et validés, nous avons programmé des études en « bouche partagée » (split mouth) et en double aveugle, pour comparer l’action des produits gélifiés avec les mêmes molécules anesthésiques avec ou sans « vasoconstricteur » : notre but est de détailler les protocoles d’utilisation, obtenir des conclusions précises, objectives, permettant de placer exactement les solutions gélifiées par rapport aux solutions actuellement utilisées.
* à 1/100000e et 1/200000e d’adrénaline, d’articaïne et de lidocaïne
Je tiens à remercier ma femme, mon assistante, mon fils, mes confrères et amis sans qui ce travail n’aurait pas vu le jour.
Bibliographie
1. Gaillard et Nogué « Anesthésie », traité de stomatologie, J.B. Baillères et fils 1912
2. Villette A. « Y a-t-il des fondamentaux en anesthésie ? » , Anesthésie : évolution et perspectives. 2010 : Le fil dentaire n° 43.