La couleur naturelle d’une dent, déterminée essentiellement par les propriétés optiques de la dentine (1), peut être modifiée par des dyschromies intrinsèques et/ou extrinsèques (2, 3). En fonction de l’étiologie de ces dyschromies, leur traitement esthétique peut faire appel aux techniques d’éclaircissement. Qu’elles soient réalisées sur dents vitales ou dévitalisées, ces techniques sont toutes basées sur l’utilisation du peroxyde d’hydrogène. En effet, le peroxyde de carbamide (utilisé sous forme de gel pour l’éclaircissement des dents vitales) ou le perborate de sodium (utilisé pour l’éclaircissement des dents non vitales) ne sont que des précurseurs du peroxyde d’hydrogène (4). L’efficacité du peroxyde d’hydrogène dans le processus d’éclaircissement repose sur ses propriétés physico- chimiques et sur son mécanisme d’action.
Mécanismes d’action et propriétés physicochimiques du peroxyde d’hydrogène
Dans de nombreux cas, les dyschromies intrinsèques et/ou extrinsèques sont liées à la présence de composés organiques appelés chromophores ou pigments et possédent plusieurs doubles liaisons. C’est par exemple le cas de l’hémoglobine qui, suite à une hémorragie pulpaire, se loge dans les tubulis dentinaires et entraîne une dyschromie intrinsèque. La décoloration de ces chromophores (pigments) est possible par la destruction d’une ou plusieurs de leurs doubles liaisons.
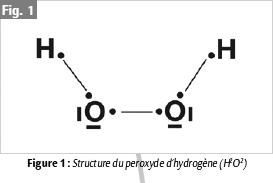
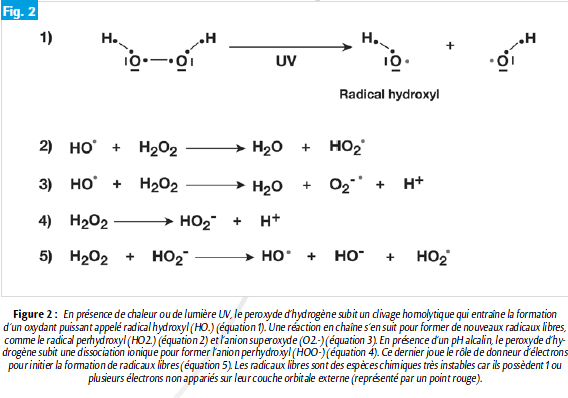
Du fait de ses propriétés physico-chimiques, le peroxyde d’hydrogène (H2O2) vulgairement appelé eau oxygénée est la molécule qui est utilisée lors des éclaircissements dentaires, ceci même si son mécanisme d’action exact est encore mal défini (Figure 1). Plusieurs réactions impliquant le peroxyde d’hydrogène peuvent avoir lieu en fonction des conditions locales comme le pH, la température et la présence d’UV ou de certains ions (5). Dans tous les cas, il semble cependant que l’efficacité du peroxyde d’hydrogène dans le processus d’éclaircissement soit basée sur sa capacité à générer des radicaux libres qui vont diffuser à travers les tissus durs de la dent. En présence d’UV ou de chaleur, les radicaux libres sont générés directement à partir du peroxyde d’hydrogène (6, 7) alors qu’en pH alcalin, il semble qu’il y ait une étape supplémentaire correspondant à la production de l’anion perhydroxyl (figure 2).
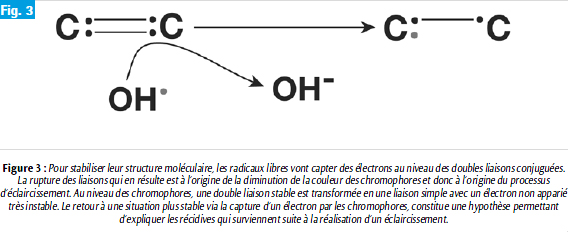
Les radicaux libres sont des espèces chimiques extrêmement instables qui pour se stabiliser vont avoir tendance à capter des électrons à partir de molécules adjacentes. Ce sont par conséquent, des agents oxydants très puissants. Leur cible principale correspond aux sites donneurs d’électrons que représentent les doubles liaisons conjuguées. La capture, par les radicaux libres, d’électrons localisés au niveau des doubles liaisons des chromophores va entraîner une rupture de ces liaisons et donc une modification des propriétés d’absorption de la lumière et une diminution de la couleur de ces molécules (8). Le processus d’éclaircissement est par conséquent lié à l’oxydation des composés organiques colorés localisés dans l’émail et la dentine (Figure 3).
Conclusion
Bien que le peroxyde d’hydrogène soit utilisé avec succès depuis de nombreuses années en dentisterie, son mécanisme d’action dans le processus d’éclaircissement a été très peu étudié et est par conséquent mal compris. En effet, même s’il semble que l’efficacité de cette molécule repose sur sa capacité à générer des radicaux libres qui vont diffuser dans l’émail et la dentine pour oxyder les chromophores organiques, de nombreuses questions restent en suspend. Les points qui restent à déterminer sont notamment :
1) quelle est la nature moléculaire des chromophores en fonction de l’étiologie des dyschromies,
2) quel est le degré d’oxydation de ces chromophores en fonction des conditions d’éclaircissement (c’est-à-dire, présence d’un catalyseur (UV ou chaleur), concentration en peroxyde d’hydrogène et temps d’exposition), et surtout 3) y a-t-il une réversibilité de ces réactions d’oxydation qui pourrait expliquer les récidives observées suite à la réalisation d’un éclaircissement.
Références bibliographiques
1. Ten Bosch JJ, Coops JC. Tooth color and reflectance as related to light scattering and enamel hardness. J Dent Res 1995;74:374-80.
2. Hattab FN, Qudeimat MA, al-Rimawi HS. Dental discoloration: an overview. J Esthet Dent 1999;11:291-310.
3. Watts A, Addy M. Tooth discolouration and staining: a review of the literature. Br Dent J 2001;190:309-16.
4. Dahl JE, Pallesen U. Tooth bleaching–a critical review of the biological aspects. Crit Rev Oral Biol Med 2003;14:292- 304.
5. Joiner A. The bleaching of teeth: a review of the literature. J Dent 2006;34:412-9.
6. Kashima-Tanaka M, Tsujimoto Y, Kawamoto K, Senda N, Ito K, Yamazaki M. Generation of free radicals and/or active oxygen by light or laser irradiation of hydrogen peroxide or sodium hypochlorite. J Endod 2003;29:141-3.
7. Poole AJ. Treatment of biorefractory organic compounds in wool scour effluent by hydroxyl radical oxidation. Water Res 2004;38:3458-64.
8. Seghi RR, Denry I. Effects of external bleaching on indentation and abrasion characteristics of human enamel in vitro. J Dent Res 1992;71:1340-4.