Après un précédent article portant sur la radiologie conventionnelle et le scanner en implantologie, voici un aperçu des autres techniques de radiologie tridimensionnelle que sont la Tomographie à Faisceau Conique (cone beam) et l’Implantologie Assistée par Ordinateur (logiciels de simulation implantaire et navigation robotique).
La tomographie à faisceau conique : le « Cone Beam » (8,21)
Depuis l’apparition du Cone Beam, les indications du scanner traditionnel (tomodensitométrie) ont été remises en question en ce qui concerne l’exploration du massif facial (8). Certains ont préconisé l’abandon pur et simple de la tomodensitométrie en pathologie maxillo-faciale (9), tandis que d’autres ont préféré rester fidèles au scanner, optimisant son utilisation en diminuant la dose émise (10, 11, 17), qui s’avère acceptable dans des conditions particulières (scanner 64 barrettes, tension, temps de pose et intensité minima). Le scanner, qui reste incontournable dans certaines indications et le Cone Beam s’imposant dans d’autres cas comme aussi performant voire supérieur, peuvent donc être considérés comme complémentaires.
Principe du Cone Beam (Fig. 1)
Le faisceau de rayons X, de forme conique, traverse l’objet à explorer avant d’être analysé après atténuation par un système de détection. Le tube et le système de détection tournant autour du sujet (192 à 360° selon les constructeurs), plusieurs centaines d’analyses (prises de vues) sont réalisées dans les différents plans de l’espace, permettant après transmission des données à un ordinateur, la reconstruction volumique contenant l’objet (ici, les maxillaires). Le volume étudié est composé de voxels dont le côté est de la taille d’un pixel, mesuré en μm.
Le système de détection et de transmission des données diffère selon les machines. Le premier système utilisé comprend essentiellement un amplificateur de brillance (Newtom3GTM, GalileosTM Sirona). Le second type de système utilisé est le capteur plan (Newtom VGTM, AccuitomoTM Morita, IcatTM). La comparaison des deux systèmes suggère un chemin plus court et plus simple du signal pour le système à capteur plan, qui pourrait pour certains expliquer en partie la meilleure résolution observée avec les machines employant ce type de capteur.
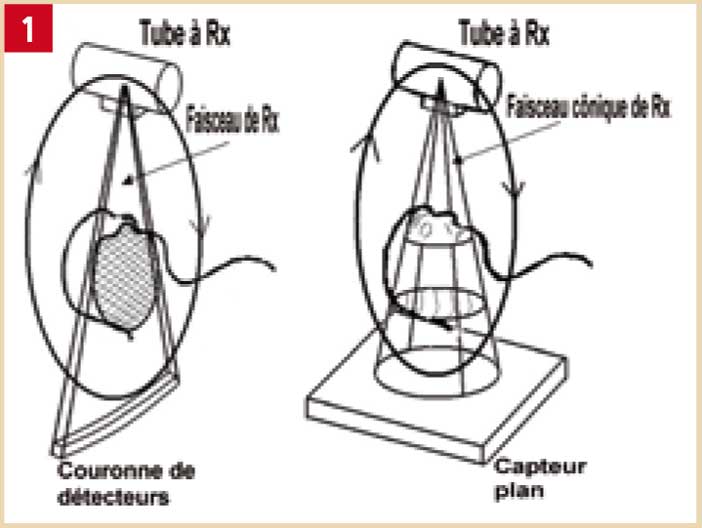
Fig. 1 : Principes comparés du scanner et du Cone Beam.
Avantages du Cone Beam
Théoriquement, le Cone Beam présente, par rapport au scanner, l’intérêt d’une moindre irradiation. En pratique, ceci dépend d’une part de l’appareil considéré, et d’autre part du protocole voire du type de scanner. Certains appareils Cone Beam s’avèrent en effet plus irradiants qu’un scanner réalisé dans les conditions optimales.
Dose efficace en Cone Beam : L’irradiation par un faisceau conique s’accompagnant d’un rayonnement diffusé plus important qu’au scanner, le calcul de la dose efficace repose sur l’utilisation d’un protocole plus complexe (8,14,15,19), fondé sur l’utilisation d’un « fantôme » comportant des dosimètres thermoluminescents positionnés à l’emplacement exact des organes irradiés (thyroïde, glandes salivaires, cristallins…), par le dosage de la dose efficace dans chacun des organes irradiés (par mesure, après irradiation, des doses dans les différents dosimètres) et la somme de chaque dose efficace par organe pour obtenir la dose efficace totale. En conséquence, la dosimétrie du Cone Beam devrait être exprimée en microSieverts (μSv) pour tenir compte du rayonnement diffusé.
Optimisation de la dosimétrie en Cone Beam : Elle comporte, comme au scanner :
- une justification (20) : tout examen devrait être réalisé après avoir été justifié pour chaque patient, afin de tenter de s’assurer que les avantages de l’examen l’emportent sur les risques ;
- une dose limitée à la plus petite nécessaire et suffisante pour le diagnostic recherché (principe ALARA). On veillera donc à l’emploi d’un appareil permettant une dose limitée (21).
Artéfacts et limites du Cone Beam (21)
Artéfacts
- cinétiques (Fig. 2) : Ils sont plus fréquents qu’au scanner du fait des temps de pose plus longs (jusqu’à 36 secondes pour le Newtom 3GTM et 30 secondes pour le Morita Accuitomo F17TM). Une contention fiable est donc indispensable en Cone Beam ;
- métalliques (Fig.3) : Ils seraient moins importants sur certains Cone Beam bien calibrés alors que certains capteurs, surtout s’ils sont mal calibrés, peuvent donner des artéfacts encore plus importants et plus gênants qu’au scanner.
Limites
- en résolution spatiale : surtout en cas de pixel supérieur ou égal à 300 μm. Par contre, l’utilisation de voxels isotropiques de petite taille (125 voire 80 μm) dans les trois plans de l’espace permet une résolution spatiale meilleure qu’en scanner (NewtomVGTM, Morita AccuitomoTM…) ;
- en résolution en densité : d’où l’étude médiocre des parties molles et l’incapacité à mesurer des densités.
Conclusion sur le Cone Beam
Le scanner et la tomographie Cone Beam apparaissent donc comme des techniques assez équivalentes en implantologie (Fig. 4).
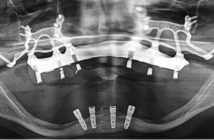
Le Cone Beam suffit souvent en exploration courante, notamment chez l’enfant, l’adolescent ou l’adulte jeune (à condition que l’appareil utilisé irradie nettement moins que le scanner) et apparaît supérieur en cas d’artéfacts métalliques importants ou prévisibles (Fig. 5) (tenons ou vis radiculaires, inlay-cores, à condition que le Cone Beam employé soit moins sujet aux artéfacts métalliques que la tomodensitométrie).
Le scanner reste cependant incontournable dans les contrôles de greffe, l’exploration des parties molles et dans tous les cas où une mesure de densité est nécessaire, ainsi qu’en pathologie tumorale et kystique suspecte et dans les traumatismes complexes.
Enfin, la multiplication des appareils Cone Beam dans les cabinets dentaires devrait être soumise à une maîtrise codifiée de son usage afin d’éviter les abus de l’auto-prescription qui pourrait se traduire par une augmentation significative de l’irradiation de la population en pratique médicale.
Les logiciels de simulation implantaire (22-25)
Ces logiciels représentent une application déjà éprouvée de la tomodensitométrie (citons SimplantTM, NobelguideTM, CadimplantTM…) et peuvent aussi s’appliquer à certaines explorations Cone Beam (Newtom VGTM, Accuitomo MoritaTM, IcatTM…).
Principe (22)
Nous détaillerons le logiciel SimplantTM, pionnier de la simulation implantaire. Le scanner est transmis au praticien sous forme comprimée, par Compact Disc (CD) ou bien par messagerie électronique (email ou FTP). Après transfert des données sur son disque dur, le praticien peut étudier le scanner sur son ordinateur (Fig. 6) et pratiquer une simulation pré-implantaire, archivable sur disque ou papier, facilement consultable par la suite. Sur l’écran, les coupes axiales et les reconstructions bidimensionnelles ou 3D sont interactives et l’on peut naviguer à l’envi dans le maxillaire étudié en cliquant simplement sur une zone quelconque, qui sera automatiquement affichée dans les trois dimensions de l’espace. La simulation implantaire consiste à déplacer une « icône-implant » et la positionner sur les reconstructions concernant le site implantaire choisi. L’implant est immédiatement visualisé dans les trois plans de l’espace.
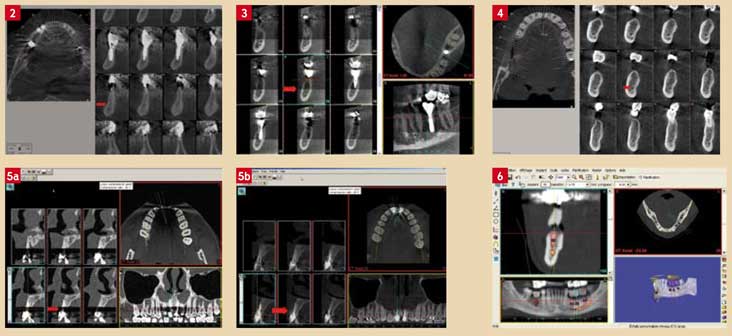
Fig. 2 : Artéfact cinétique en Cone Beam. Fig. 3 : Artéfact métallique en Cone Beam (Scanora 3DTM mal calibré). Fig. 4 : Bilan implantaire mandibulaire (Newtom VGTM). Fig. 5a : Artéfact métallique en scanner. Barre noire due à deux tenons. Fig. 5b : Même patient en Cone Beam. Peu d’artéfacts dus aux tenons. Fig. 6 : Présentation d’un scanner sur écran.
Les apports de la simulation implantaire
Ils concernent le volume et la qualité de l’os.
Le volume osseux disponible dépend de l’épaisseur et de la hauteur d’os jusqu’au premier obstacle anatomique.
La simulation autorise son exploitation idéale en permettant de faire varier pour chaque implant ses dimensions et ses inclinaisons dans les plans vestibulo lingual et mésio distal ; c’est la seule méthode permettant de visualiser simultanément la double obliquité d’un implant (Fig. 6). Cependant, certaines règles sont toujours à respecter, à savoir :
- espace de sécurité entre obstacle anatomique et implant ainsi qu’entre piliers (dents ou implants), classiquement 2 mm au minimum ;
- inclinaison implantaire inférieure à 30° par rapport à l’axe prothétique.
La mesure d’un volume est aussi possible, ainsi que la colorisation du canal mandibulaire.
L’utilisation d’un guide chirurgical permet de reporter en bouche du patient les constatations issues du bilan scanographique.
Plusieurs types principaux de guide peuvent être retenus, en fonction de la forme des repères :
- billes en titane aidant au choix du point de forage (émergence) ;
- repères à type d’axe : cônes de gutta percha, tenons ou tubes guide en titane, donnant en outre une indication sur l’orientation idéale de l’implant ;
- guide en forme de prothèse provisoire : dents du commerce ou provisoire en résine, recouverte d’une couche de baryte (radio opaque) permettant en plus une approche biomécanique.
Récemment, l’application de la stéréolithographie (25) permettant la reproduction robotisée de volumes en résine, a permis la réalisation de guides chirurgicaux de haute précision. Après simulation implantaire, les données du bilan pré-opératoire sont adressées sur CD-Rom ou par Internet à une société spécialisée qui fournit au praticien un guide chirurgical idéal (SurgiguideTM) reproduisant parfaitement en bouche du patient les données de la simulation implantaire (Fig. 7).
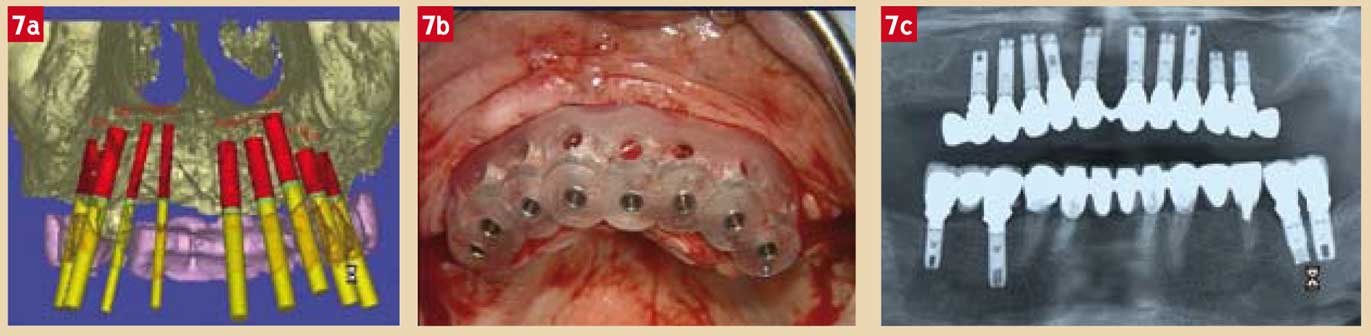
Fig. 7a : Reconstruction 3D d’une simulation SimplantTM. Fig. 7b : SurgiguideTM reproduisant en bouche la simulation. Fig. 7c : Panoramique post-opératoire.
La qualité de l’os
La qualité de l’os disponible peut être mesurée. L’os spongieux étant de densité très variable chez un même patient, l’idéal est d’apprécier la qualité de l’os dans le site implantaire et au mieux dans la zone d’ostéo intégration. C’est ce qui est permis par le logiciel qui permet de calculer, pour un implant donné, la densité moyenne de l’os peri-implantaire, exprimée en Unités Hounsfield (UH) (Fig. 8).
Une analogie a été décrite avec la classification de Brånemark (23) :
- densité moyenne inférieure à +400 UH, en cas d’os déminéralisé (classe IV de Brånemark) ; dans ce cas, la recherche d’un appui bicortical peut être utile pour assurer une stabilité primaire à l’implant ;
- de +400 à +800 UH, on est en présence d’os de type mixte-spongieux (classe III) ;
- de +800 à +1200 UH, c’est un os de type mixte-cortical (classe II) ;
- et au delà de +1200 UH, il s’agit d’os cortical (classe I).
Bilan et suivi des greffes pré-implantaires (22,24)
Pour la chirurgie reconstructrice pré-implantaire, deux temps sont à distinguer, avant et après la greffe.
Avant la greffe
Avant la greffe, le logiciel SimplantTM permet l’étude rigoureuse du volume osseux nécessaire à un comblement sous-sinusien (Fig. 9a) (22) ou une greffe d’apposition.
Il permet aussi de mesurer le volume et la qualité d’os dans les régions symphysaire et angulaires (ramiques) de la mandibule, ainsi qu’au niveau de la voûte crânienne par la technique du CranioscanTM(24).
Après la greffe
Le contrôle à 6 mois du greffon (Fig. 9b) permet de vérifier la présence des critères de réussite que sont :
- Le volume d’os greffé qui doit être suffisant, compte tenu des inévitables phénomènes de remodelage voire de résorption ;
- Les contours du greffon qui doivent être nets et réguliers ;
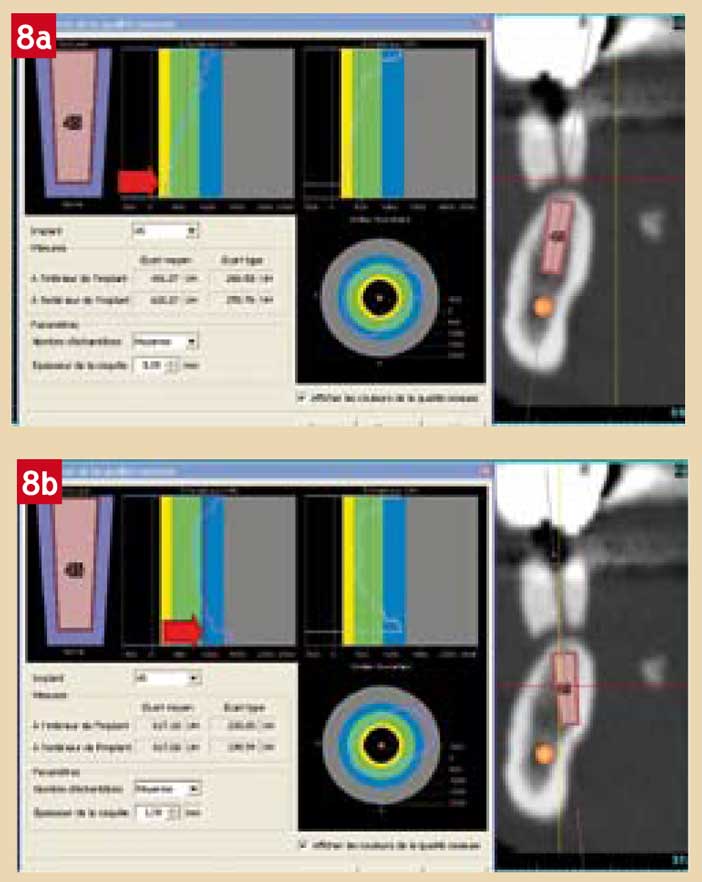
Fig. 8a : Densité 8b péri-implantaire. Type IV en apical dans l’axe du procès alvéolaire. Fig. 8b : Densité péri-implantaire. Appui bicortical dans l’axe du guide.