L’objectif de cet article est de repréciser les mécanismes d’intégration et de remodelage des greffes autologues, et de définir le cadre général de leurs indications.
Selon la disposition en blocs ou en particules, les mécanismes d’intégration sont similaires dans l’ensemble, mais la cinétique du remodelage est différente. La libération des facteurs de croissance (ostéoinduction) et la pénétration vasculaire (angiogenèse) se feront plus ou moins rapidement et de façon plus ou moins étendue selon différents facteurs. La porosité relative des matériaux est sous la dépendance de la proportion d’os spongieux, de la densité de la corticale, de son épaisseur et des espaces granulaires (pour l’os particulé). Cette porosité conditionne la rapidité de l’angiogenèse alors que la densité freine la résorption nécessaire au remodelage (Verna C 1999).
Histologie et histomorphométrie des greffes par blocs
En histologie, on note la présence d’os vital (OV) et non vital (ONV) sur des périodes d’observations de plus de 2 ans. L’os non vital est principalement d’architecture lamellaire alors que l’os vital est structuré en lamellaire et trabéculaire.
L’os vital et l’os non vital sont en contact intime et la jonction entre les deux coïncide avec un changement de l’orientation des lamelles ; l’os non vital est remplacé par l’os vital par un processus de cicatrisation rampante (creeping substitution) communément connu par ostéoconduction.
En histomorphométrie, l’os greffé par blocs contient une grande partie d’os non vivant avec des lacunes ostéocytaires vides, variant de 1 % à 34 % du volume osseux pour une greffe mentonnière (Zerbo et coll. 2003) et de 34,3 % à 80,5 % pour une greffe ramique (Acocella et coll. 2009). Le volume osseux de l’os vital varie de 27 à 57 % avec une moyenne de 41 % (Zerbo et coll. 2003). Néanmoins, la quantité d’ONV se réduit significativement avec le temps de cicatrisation associée à une perte volumétrique variable.
Les données histologiques indiquent que la majorité des ostéocytes du greffon ne survivent pas après la greffe (Zerbo et coll. 2003, Acocella et coll. 2009).
Selon Ham (1952), les ostéocytes nécessitent une proximité de 0,1 mm d’un vaisseau sanguin pour survivre ; l’interruption de l’apport vasculaire entraîne une nécrose ischémique (Cruess, 1986).
Pour Ellegaard et coll. 1975, la rupture des vaisseaux osseux lors du prélèvement, provoque « l’enterrement » complet de plusieurs ostéocytes qui ne survivent pas après la re-localisation et cela par dépôt d’os minéralisé.
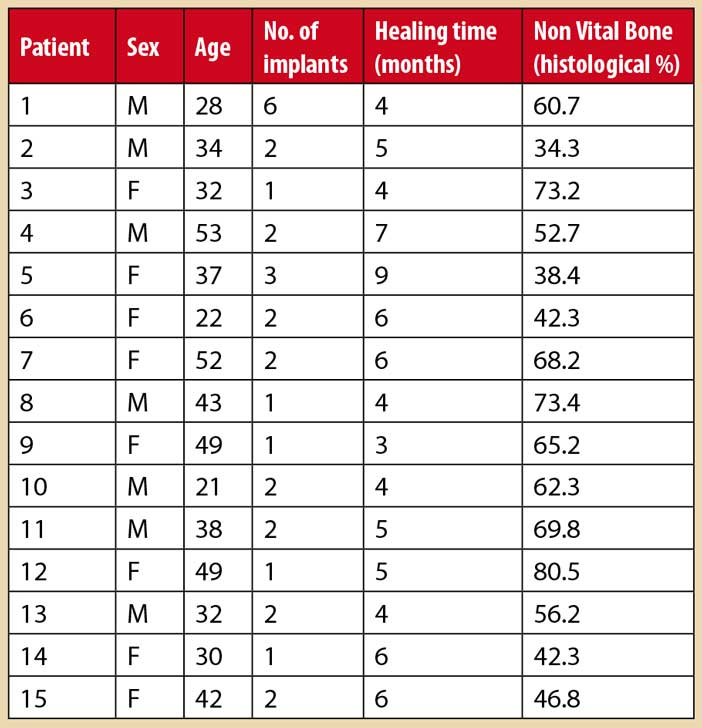
Tableau résumant les pourcentages d’os vital et non vital après greffe par prélèvement retro-molaire par blocs (Acocella A et coll. 2010).
Facteurs influençant la réussite d’une greffe et l’étendue du remodelage
Les facteurs locaux sont de première importance dans la réussite d’une greffe. Ainsi la présence d’une muqueuse fine ou sclérotique (cas de site polyopéré ou suite à une complication préalable du même site) est un des facteurs importants d’exposition primaire de la greffe. La réparation des tissus mous par technique soustractive (frenectomie et désinsertion préalable) ou additive (greffe de conjonctif enfoui ou épithélio-conjonctive) est nécessaire (Thafeed AlGhamdi 2008).
Un temps de maturation de 8 à 12 semaines sera accordé préalablement à la greffe des tissus durs. La suppression des foyers infectieux à proximité immédiate tels que les kystes apicaux et les parodontites non stabilisées des dents voisines devra être réalisée. Dans le cas de traitement conservateur des dents voisines à risques, une réévaluation variable de 3 à 6 mois est indispensable avant toute mise en route du traitement d’augmentation.
Les dents sans contact direct avec la zone de greffe devront être soigneusement évaluées quant à leur risque de dissémination et à un éventuel réveil infectieux durant la phase de cicatrisation et de maturation de la greffe. Ceci est théoriquement mis en œuvre avant même tout concept de restauration (implantaire ou prothétique conventionnel). Cette prise en charge des lésions et leur stabilisation rentrent dans le cadre plus général de la thérapeutique globale.
Les facteurs généraux (hors contre-indications formelles) plus ou moins facilement évaluables interviennent dans le risque associé de complication des greffes. Les plus connus tels que le diabète, les cirrhoses, doivent être évalués et diagnostiqués lors de l’anamnèse médicale ou du bilan biologique de première ou de deuxième intention. Le bilan primaire devra au moins comporter une numération de formule sanguine (NFS), un bilan d’hémostase, un bilan phosphocalcique et dans le cas d’un doute hépatique un dosage des transaminases.
Il est hors sujet de développer l’ensemble de ces bilans et affections à risque et pour résumer, les candidats aux traitements seront des patients ASA 1 (sains sans pathologie à risque) ou ASA 2 (à pathologie stabilisée ne représentant pas de risque vital pour le patient) tels que définis par la classification d’anesthésiologie.
Les facteurs intrinsèques propres à l’individu représentent ce qui est communément appelé « patient performance status » et résument la prédisposition individuelle (liée à l’âge et à l’état systémique du patient), de revasculariser un site de greffe et cela quelle que soit la nature de la greffe dans et hors de la cavité buccale (Gallo et coll. 2008).
Indications des greffes autologues
L’évolution des indications dans notre pratique nous amène à considérer les greffes dès lors que les pertes de substance ne sont pas compensables par des techniques alternatives.
Dans le cas d’édentements limités, intercalaires d’une ou plusieurs dents, la présence des septa osseux adjacents fixe le niveau maximal pouvant être obtenu après augmentation. Si la perte osseuse ne concerne que le sens transversal « horizontal », la greffe s’indique dès lors que l’expansion osseuse (Khoury G et coll. 2010) ne peut être réalisée : proximités radiculaires, axe osseux résiduel oblique non conforme à l’axe implantaire et soudure des corticales. La greffe massive par bloc n’est envisageable que dans la mesure ou un apport spongieux est associé. Cela écarte les sites de prélèvement retro-molaires, à composante majoritairement (voire exclusivement) corticale. Le prélèvement mentonnier reste une indication plausible dès lors que cette médullaire est indiquée. La greffe par os particulé, « boxing », est le bon choix pour ces édentements de petite et moyenne étendues. Cela réintroduit l’intérêt de l’os retro-molaire, du fait de la compensation d’absence d’os médullaire par la réduction de l’épaisseur de la corticale et du broyage de l’os résiduel. Les espaces inter-granulaires jouent le rôle de cette porosité nécessaire à l’angiogenèse (Springer IN 2004).
Cas clinique 1 (Fig. 1 à 10)
L’os allogénique et les régénérations osseuses guidées (ROG) sont des alternatives qui pourraient voir leurs indications progresser au détriment des greffes autologues.
Des publications récentes remettent en selle les ROG. L’absence d’études multicentriques concordantes soulève quelques questions quant à la reproductibilité des résultats (Khoury G et coll. 2010). Si la perte osseuse concerne le niveau axial associé ou non au sens transversal, les critères de choix deviennent plus complexes et les alternatives multiples. Il faut garder à l’esprit et en vue ce niveau des septas adjacents des dents bordantes et cela quel que soit le choix de la technique.
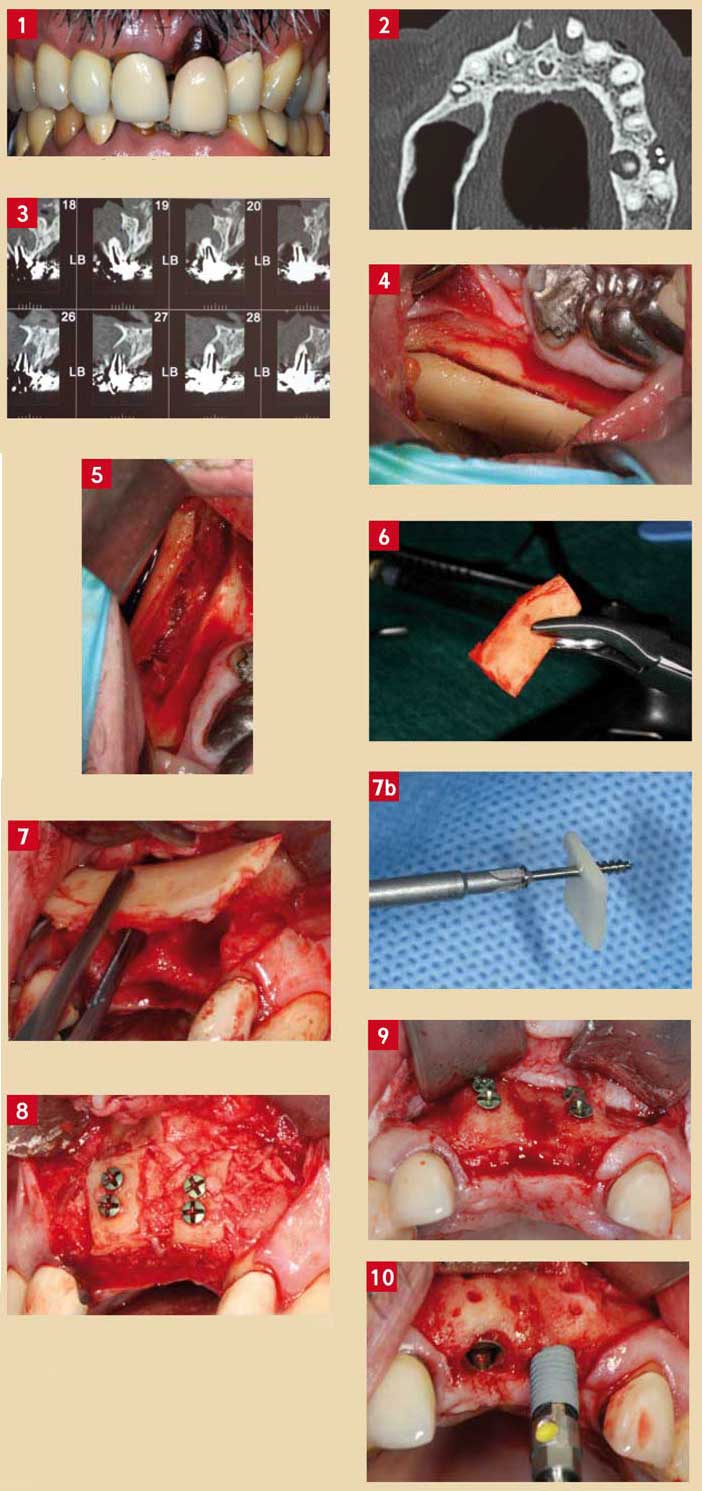
Fig. 1 : vue clinique de la perte des tissus mous sur 21 Fig. 2 : coupe axiale objectivant la perte osseuse en 11 et 21 autour des racines résiduelles Fig. 3 : perte osseuse objectivée en pré-opératoire Fig. 4 : prélèvement retro-molaire par ostéotomie au piézzotome (mectron) Fig. 5 : prélèvement cortico-spongieux rarement objectivé en retro-molaire Fig. 6 : greffon prélevé, noter la forte corticalité imposant son affinement et la réduction des fragments résiduels en granules Fig. 7 : évaluation du besoin d’adaptation du greffon selon le site Fig. 7b : vis DELTEX de type «LAG» permettant une liberté de la greffe affinée dans son positionnement à distance de la paroi osseuse résiduelle Fig. 8 : positionnement de murs corticaux vestibulaires en regard des alvéoles et comblement des espaces par des particules d’os autologue Fig. 9 : intégration de la greffe à 4 mois et remodelage des process alvéolaires selon la position des greffons initiaux, évoquant les alvéoles naturelles Fig. 10 : pose des implants dans un volume adéquat, Dr Matarazzo, à noter la faible vascularisation ainsi que la résorption moindre des murs corticaux
Cas clinique 2 (Fig. 11 à 20)
Pour les pertes étendues libres distales, le choix s’orientera vers la distraction alvéolaire (Khoury E. et coll. 2010), l’ostéotomie segmentaire ou les greffes autologues.
Le critère de choix intègrera le risque de morbidité du site de prélèvement, de complication de la technique choisie et de ses conséquences. La qualité des tissus mous du site résorbé et leur disponibilité à recouvrir l’augmentation sont de première importance.
Ainsi pour les greffes (autologues ou allogéniques), la technique de gestion des tissus mous par tunnellisation développée par Kent et Tatum est l’abord idéal mandibulaire en terme de préservation et de potentialisation de la vascularisation. Elle permet un maintien de la vascularisation crestale et s’affranchit de la traction tissulaire issue de la fonction linguale et cela quelle que soit la passivité de la relaxation vestibulaire.
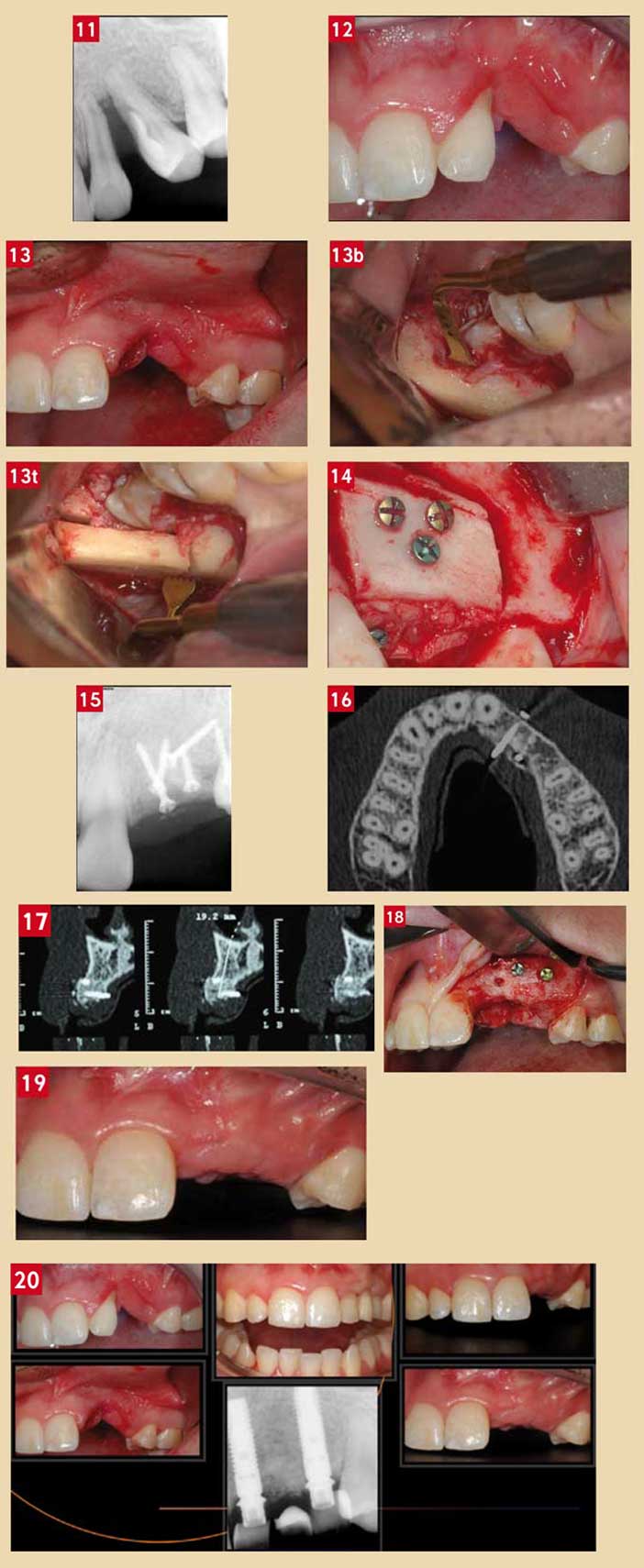
Fig. 11 : perte de substances axiale et transversale après avulsion de 23, le pronostic de 22 et 24 est également condamné Fig. 12 : situation clinique associant la perte des tissus durs et mous et imposant une correction globale Fig. 13 : situation post-extractionnelle de 22 objectivant l’insuffisance des tissus mous qui seront préalablement corrigés par greffe de conjonctif enfoui Fig. 13b : insert de Piezzotome Mectron pour l’ostéotomie axiale Fig. 13t : insert Mectron pour l’ostéotomie latérale ; à noter l’inocuité des inserts au contact des tissus mous, il faut néanmoins bien s’assurer de l’écoulement de l’irrigation lors de l’ostéotomie. La dent de sagesse sera avulsée lors du prélèvement Fig. 14 : reconstitution des parois vestibulaire et palatine par plaquettes autologues d’origine retro-molaire et comblement de l’espace de boxing par des copeaux autologues Fig. 15 : vue radiologique de la stabilisation tridimensionnelle des greffons Fig. 16 : tomodensitométrie de contrôle à 4 mois, à noter le mur osseux palatin rajouté de forme plat Fig. 17 : reconstruction tridimensionnelle du site et intégration de la greffe à 4 mois Fig. 18 : ré-entrée chirurgicale et aspect de la crête augmentée, à noter la faible vascularisation des corticales vouées à se remodeler et disparaître Fig. 19 : aspect final des tissus mous après pose des implants, noter le niveau tissulaire obtenu, aligné sur la papille médiane Fig. 20 : vue globale du cas clinique et de la maturation des tissus mous guidés par la prothèse transitoire (courtoisie du dr. Guez)
Cas clinique 3 (Fig. 21 à 30)
En conclusion, la greffe autologue est une technique de choix dans les pertes de substances axiales et transversales associées. Les mécanismes de remodelage imposent l’usage de greffons cortico-spongieux lors d’apposition par blocs. Dès lors que la spongieuse est absente ou réduite, la réduction de la corticale et le broyage de l’os résiduel disponible amènent à la mise en application d’une augmentation par « boxing » au détriment d’un bloc cortical massif.
À chaque fois que les techniques alternatives sont possibles et offrent une augmentation sécurisée, elles doivent être proposées aux patients en expliquant les avantages et inconvénients associés. Le risque de complication inhérent à chaque technique pose la question de la reprise chirurgicale et doit être abordé avec le patient afin de prévenir dans la mesure du possible, l’improbable.
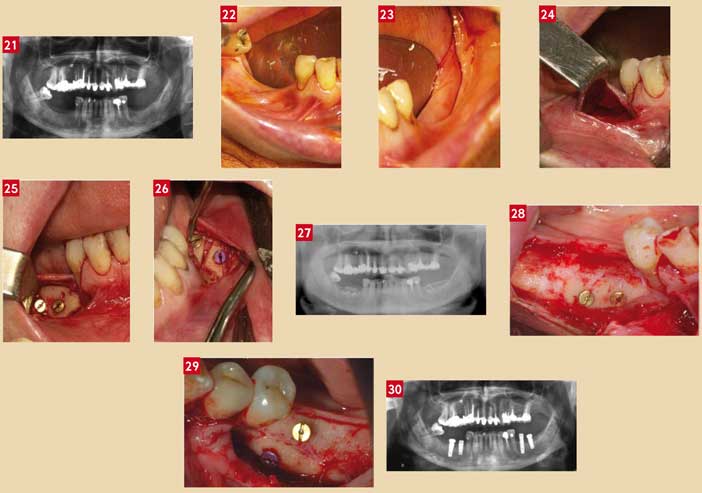
Fig. 21 : atrophie mandibulaire postérieure d’un patient traité en 2005 Fig. 22 : situation clinique des tissus mous du secteur droit Fig. 23 : situation clinique des tissus mous du secteur gauche plus fortement atrophié Fig. 24 : accès disponible par tunnellisation, suffisant pour la réalisation de la greffe Fig. 25 : greffe axiale et transversale d’os pariétal par tunnellisation du secteur droit sans aucune incision crestale Fig. 26 : greffe axiale et transversale d’os pariétal par tunnellisation du secteur gauche sans aucune incision crestale Fig. 27 : aspect radiologique de l’augmentation osseuse tridimensionnelle Fig. 28 : ré-entrée chirurgicale à 4 mois du secteur droit, lors de la pose des implants (courtoisie du Dr Drouhet) Fig. 29 : ré-entrée chirurgicale à 4 mois du secteur gauche, lors de la pose des implants (courtoisie du Dr Drouhet), à noter l’intégration de la greffe malgré un remodelage non achevé Fig. 30 : aspect radiologique de la pose des implants dans les volumes augmentés (courtoisie du Dr Drouhet)
Bibliographie
1. Acocella A.; Bertolai R.; Colafranceschi M; Sacco R Clinical, histological and histomorphometric evaluation of the healing of mandibular ramus bone block grafts for alveolar ridge augmentation before implant placement. J Cranio-Maxillo-Faciall Surg (2010) 38, 222-230.
2. Alley James 1971 (Wishita, Kansas): 60 cases of Preprosthetic ridges augmentation (Ilium, Ribs…).
3. O. Hilt Tatum localized areas related to implants 1990 (St Petersburg, Florida) 1995 Consensus on Implant treatment (St Petersburg, Florida).
4. Cruess RL: Osteonecrosis of bone. Current concepts as to etiology and pathogenesis. Clin Orthop 208: 30-39, 1986 Jul.
5. Ellegaard B, Karring T, Loe H: The fate of vital and devitalized bone grafts in the healing of interradicular lesions. J Periodontal Res 10: 88-97, 1975.
6. Gallo J, Raska M, Mrázek F, Petrek M.: Bone remodeling, particle disease and individual susceptibility to periprosthetic osteolysis. Physiol Res. 2008; 57(3): 339-49.
7. Ham AW: Some histophysiological problems peculiar to calcified tissues. J Bone Joint Surg Am 24-A-3: 701-728, 1952 Jul.
8. Khoury E, Khoury G. La distraction osseuse alvéolaire. Le Fil Dentaire juin 2010, pages 50-54.
9. Khoury G, Khoury E, Fülop O. Les techniques d’expansion alvéolaire transversale. Le Fil Dentaire juin 2010, pages 46-49.
10. Khoury G, Khoury E, Riahi H. Ostéotomies segmentaires d’augmentation verticale des crêtes alvéolaires atrophiées. Le Fil Dentaire juin 2010, pages 56-59.
11. Khoury G, Khoury E, Meziane S. Reconstitution de maxillaire complet atrophié par blocs allogéniques et mise en charge immédiate sur implants transitoires, Le Fil Dentaire, Juin 2010, pages 40-44.
12. Springer IN, Terheyden H, Geiss S, Härle F, Hedderich J, Açil Y. Clin Oral Implants Res. 2004 Apr; 15(2): 205-12. Particulated bone grafts—effectiveness of bone cell supply.
13. Tessier P. – Autogenous bone grafts taken from the calvarium for facial and cranial applications. Clinics in Plastic Surgery. 1982; 4; 531–538.
14. Thafeed AlGhamdi Ali Saad, Robert J. Buhite (2008) A New Tunnel Technique With Acellular Dermal Matrix for Soft Tissue Preparation Prior to Symphyseal : Block Graft—A Description of Technique and Case Report. Journal of Oral Implantology: Vol. 34, No. 5, pp. 274-281.
15. Verna C. Differences in static cortical bone remodeling parameters in human mandible and iliac crest. Bone, 1999 Volume 25, Issue 5, Pages 577- 583.
16. Zerbo IR, de Lange GL, Joldersma M, Bronckers ALJJ, Burger EH: Fate of monocortical bone blocks grafted in the human maxilla: a histological and histomorphometric study. Clin Oral Impl Res 14: 759-766, 2003.