Nous vivons une époque où l’ostéointégration d’un implant dentaire n’est plus considérée comme un miracle. Les patients considèrent comme une évidence qu’un implant s’ostéointègre mais ce qui compte le plus pour eux, c’est que la réhabilitation prothétique soit esthétique. Or nous savons à quel point la mise en place d’implants est conditionnée par la présence d’un volume osseux et d’un tissu gingival suffisants. La perte de dents entraîne systématiquement une fonte du volume osseux dont la conséquence sera soit l’impossibilité de mettre un implant, soit la difficulté pour le praticien d’obtenir que la réhabilitation implanto-portée soit esthétique.
L’évolution des techniques chirurgicales et prothétiques en implantologie orale est telle que la mise en place d’implants post-extractionnelle est aujourd’hui réalisée de manière routinière par bon nombre de praticiens.
Quel que soit le cas clinique qui se présente et si le praticien veut offrir le meilleur résultat possible à son patient, il lui faudra dans bon nombre de situations, faire appel à des techniques de reconstruction osseuse.
Cet article a pour but de développer la technique dite de Régénération Osseuse Guidée qui a l’avantage de proposer une solution simple et accessible de reconstruction osseuse comme complément ou alternative aux autres techniques existantes.
Les principes biologiques de la Régénération Osseuse guidée
La Régénération Osseuse Guidée découle des principes de la Régénération Tissulaire Guidée. Dans le domaine de la parodontologie, la RTG désigne toute technique chirurgicale susceptible de stimuler le repeuplement cellulaire sélectif de la surface radiculaire nettoyée à partir de fibroblastes et d’autres cellules génitrices provenant du ligament parodontal adjacent à la plaie, permettant ainsi l’obtention d’une nouvelle attache dans une néoformation osseuse et cémentaire.
Nyman et coll. (1980, 1982), ont étudié le type de cicatrisation que l’on peut obtenir lorsque seules les cellules du desmodonte interviennent.
C’est Murray et coll. 1957, qui ont mis en évidence pour la première fois le principe de régénération osseuse guidée, en isolant mécaniquement, à l’aide d’une cage en plastique un défaut osseux créé dans un os iliaque de chien. Après cicatrisation, l’intérieur de la cage a été comblé par un os néoformé.
Plus tard, Dahlin et coll. 1989, ont montré qu’il était également possible de régénérer de l’os autour d’implants mis en place dans des tibias de lapins et recouverts par une membrane en PTFE-e (Polytétrafluoroéthylène expansé).
Le concept de régénération osseuse guidée repose sur les principes suivants (Buser et coll. 1993, Fugazzotto et coll. 2003) (Fig. 1, 2 et 3) :
- maintien de l’espace nécessaire à la régénération osseuse
- cet espace sera favorable à l’angiogenèse et à la formation osseuse
- maintien et protection du caillot sanguin, source même de la régénération osseuse
- mise en place d’une barrière contre l’invasion cellulaire du tissu conjonctif et épithélial gingival, empêchant ainsi la compétition cellulaire, défavorable à la minéralisation osseuse, d’avoir lieu
- sutures gingivales obtenues et maintenues avec une bonne gestion des forces postopératoires sousjacentes.
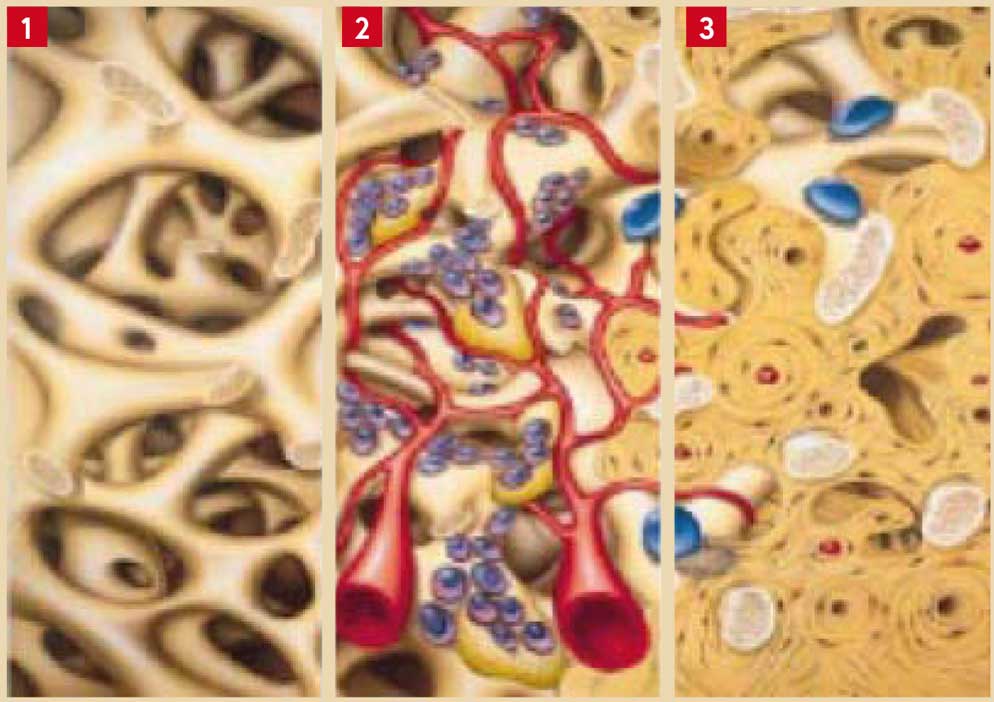
Fig. 1 : mise en place du biomatériau qui va soutenir le caillot sanguin avant d’être recouvert par une membrane de ROG Fig. 2 : vascularisation du site à régénérer et début de croissance d’un os fibrillaire, immature entre les espaces laissés libres par le biomatériau Fig. 3 : dernière étape avec présence d’os lamellaire et début de minéralisation osseuse
Les indications de la régénération osseuse guidée (Buser et coll. 1993)
- Présence de déhiscences et fenestration péri-implantaires.
- Les défauts résiduels intra-osseux péri-implantaires.
- Gestion d’un site d’implantation postextractionnel.
- Augmentation localisée de la crête osseuse.
- Gestion de défauts osseux au niveau de futurs sites d’implantation empêchant soit la mise en place d’un implant, soit sa mise en place dans un axe convenable pour l’esthétique et la fonction de la prothèse à venir.
Réflexions sur les matériaux utilisés en ROG
Lorsqu’un défaut osseux doit être régénéré, il suffit, si l’on se réfère aux études de Nyman 1982 ou à celles de Dahlin 1989, de couvrir ce défaut par une membrane de protection du caillot sanguin.
D’autres auteurs, tels que Rasmusson et coll. 1997, préfèrent introduire sous la membrane un matériau ostéoconducteur comme des biomatériaux d’origine bovine, humaine ou synthétique ou un matériau ostéoinducteur comme de l’os autogène.
Queyroz et coll. 2006, essaient quant à eux toutes les associations possibles (biomatériau seul, membrane de ROG seule ou association d’une membrane de ROG avec un biomatériau de comblement).
Ils en montrent que la régénération osseuse peut certaines fois fonctionner avec une membrane seule ou avec le biomatériau utilisé seul, mais que les résultats ne sont pas réguliers ni reproductibles.
Ils en concluent que l’idéal semble être une combinaison entre un biomatériau de comblement et une membrane de ROG.
Les membranes de ROG
En régénération osseuse guidée, il est important de recouvrir le biomatériau sensé nous aider à recréer de l’os par une membrane (Friedmann et coll. 2001).
Cette membrane a pour fonction de protéger le caillot sanguin qui s’est formé autour et entre les particules de biomatériau afin que l’angiogenèse puis la minéralisation osseuse puissent se faire.
Elle va agir également comme un mainteneur d’espace nécessaire à la recomposition du volume osseux à recréer.
Enfin, la membrane de ROG va servir à lutter contre l’invasion cellulaire du caillot sanguin par les cellules conjonctives et épithéliales issues de la gencive. Ces membranes peuvent être soit non résorbables, soit résorbables.
Les auteurs rapportent qu’il n’y a pas de différence significative en terme d’efficacité entre les unes et les autres (Moses et coll. 2005).
Les membranes non résorbables
Ces premières membranes ont été les premières à être utilisées en ROG. Elles sont faites en ePTFE ou polytétrafluoroéthylène expansé.
Avantages
Ce sont des membranes qui ont l’avantage de se manipuler aisément, de pouvoir être fixées à l’aide de clous ou de vis spécifiques, sans se détériorer.
Elles peuvent être également renforcées par une armature en titane, leur conférant des propriétés mécaniques supérieures, empêchant ainsi un affaissement du caillot sanguin que cette membrane doit protéger.
Inconvénients
Ces membranes en ePTFE sont rapidement colonisées par les bactéries lorsqu’elles sont en contact avec la cavité buccale en cas d’operculisation (Moses et coll. 2005).
Il est donc recommandé de surveiller fréquemment son patient car toute exposition de la membrane aux bactéries de la cavité buccale risque fort d’entraîner une infection du site régénéré.
Les membranes résorbables
Elles sont soit synthétiques, soit en collagène.
Avantages
Étant résorbables, il n’est pas utile de soulever un lambeau afin de les retirer du site de régénération.
Les membranes synthétiques
Elles sont à base de copolymères d’acide polylactique et polyglycolique. Elles se résorbent par hydrolyse. Leur vitesse de résorption dépend du pH et de la composition chimique du site implanté. Schliephake et coll. 2000, remarquent toutefois que les produits de dégradation de ces membranes synthétiques induisent une réaction inflammatoire des tissus environnants aux effets négatifs sur la régénération osseuse.
Les membranes en collagène
Utilisées déjà depuis 1996 (Miller et coll.), elles sont fabriquées à partir de collagène bovin, porcin ou équin et leurs fibres peuvent être réticulées ou non.
Elles sont très biocompatibles et supportent bien les operculisations et les contacts avec le milieu de la cavité buccale (Rothamel et coll. 2004).
L’idéal pour une membrane est qu’elle ne se résorbe pas avant un délai minimum de 4 à 6 mois, mais Von Arx et coll. 2005, semblent montrer qu’elles ne réagissent pas toutes de la même manière avec des temps de résorption pouvant aller de quelques semaines à quelques mois selon les membranes.
Les membranes résorbables dont les fibres sont réticulées (Rothamel et coll. 2004) se résorbent plus lentement que celles dont les fibres ne le sont pas.
Par contre, il semble que plus les membranes sont réticulées, plus elles sont fragiles dans leur manipulation. Les membranes résorbables sont en général plus difficiles à fixer ou à suturer que les non résorbables (Fig. 4, 5).
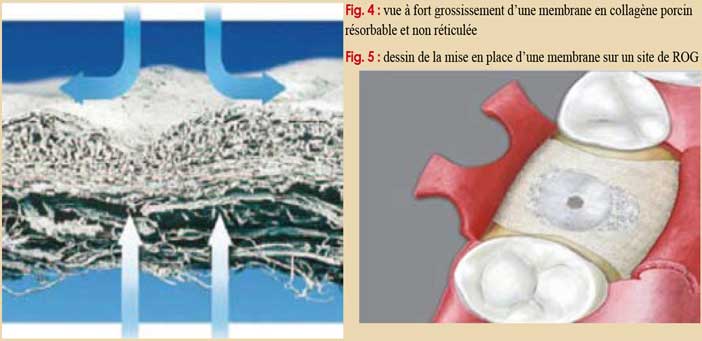
Les biomatériaux de comblement osseux
Les matériaux utilisés en régénération osseuse guidée ont généralement vocation à aider le maintien de l’espace nécessaire à la régénération osseuse.
Ils ont une action ostéoconductrice pour la plupart d’entre eux et ostéoinductrice pour ce qui est de l’os autogène.
En ce qui concerne l’os autogène comme biomatériau de régénération osseuse, Schenk et coll. 1994, montrent que toutes les cellules d’os autogène qui se trouvent à plus d’un millimètre d’une source vasculaire ne pourront pas survivre. Les matériaux rencontrés fréquemment sont les biomatériaux allogéniques (d’origine humaine, minéralisés ou déminéralisés) (Feuille et coll. 2003, Mellonig 2006), d’origine animale (xénogreffes) (Hallmann et coll. 2002) ou synthétiques (Bêta Phosphate Tricalcique ou Hydroxyapatite) (Beyen et coll. 2006) (Fig. 6, 7, 8, 9 et 10).
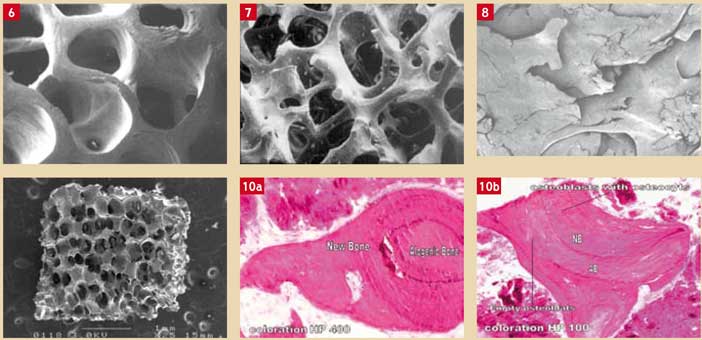
Fig. 6 : os humain Fig. 7 : os allogénique Fig. 8 : os allogénique déminéralisé Fig. 9 : bêta TCP synthétique Fig. 10 : images histologiques de la régénération osseuses guidée : ces deux images montrent qu’autour de chaque grain de biomatériau (ici du biomatériau allogénique) il y a de l’os nouveau, vital (présence d’ostéoblastes avec ostéocytes) qui se crée
Technique chirurgicale
Phase pré-chirurgicale
Avant de se lancer dans la phase chirurgicale à proprement parler, le praticien doit évaluer la difficulté de l’intervention et les risques de succès en fonction de chaque patient. Il faut observer la gencive et définir s’il s’agit d’un biotype plutôt fin ou épais.
Il faut observer également les insertions musculaires et les freins qui risqueraient d’influencer négativement le maintien des sutures primaires.
Il s’agit aussi d’évaluer la quantité de volume osseux à régénérer afin d’estimer la possibilité de re-fermeture gingivale en fin d’intervention.
On prescrira au patient une antibiothérapie prophylactique à base de pénicilline, à raison de deux grammes par jour à prendre le matin et le soir pendant 8 jours. Il devra commencer cette antibiothérapie deux jours avant la chirurgie. Le patient fera un rinçage au bain de bouche avant de commencer l’intervention.
Phase chirurgicale
L’anesthésie sera réalisée classiquement par des injections péri-apicales. Les incisions doivent se faire à distance du site à régénérer et un lambeau de pleine épaisseur sera soulevé.
Il faut réaliser un débridement complet du tissu de granulation et voire même décorticaliser l’os sur lequel le biomatériau sera mis en place car cela est considéré comme une stimulation endostée et libère des facteurs de croissance favorables à la cicatrisation.
Le biomatériau sera mis en place afin de recréer le volume osseux à régénérer. Il sera recouvert en totalité par la membrane de ROG choisie. Celle-ci sera découpée sans angle coupant pour la gencive et adaptée avec rigueur sur le biomatériau. Elle sera fixée par des petites vis ou des clous et suturée aux gencives si cela est possible.
Le biomatériau doit être correctement stabilisé par la membrane. Les fibres gingivales seront relâchées au bistouri au niveau de la muqueuse libre afin de pouvoir suturer hermétiquement le lambeau sans qu’il y ait de surtensions excessives.
Phase postopératoire
Demander au patient d’éviter les mouvements de bouche importants comme les grands sourires, les éternuements, les bains de bouche trop énergiques ou la mastication d’aliments difficiles à broyer, pendant la première semaine.
Lui demander de faire des bains de bouche réguliers mais pas trop énergiques pendant 8 jours. Revoir le patient régulièrement au fauteuil à 3 jours, puis à une semaine et enfin à 2 et 3 semaines. Ne pas hésiter à suturer de nouveau les gencives si certaines sutures fils n’ont pas résisté aux tensions gingivales. Les fils de suture seront retirés au bout de 3 semaines si la cicatrisation gingivale est suffisante.
Réouverture du site
Il faudra attendre entre 4 et 6 mois pour obtenir une minéralisation osseuse suffisante sur le site de régénération osseuse guidée.
Un examen radiologique de type scanner préopératoire sera nécessaire pour évaluer le degré de minéralisation et la quantité d’os régénéré avant d’envisager la mise en place d’un implant sur ce site régénéré.
Présentation d’un cas clinique
Madame F. âgée de 70 ans, en bon état de santé général est adressée par son praticien pour savoir s’il est possible de remplacer son bridge allant de la dent N° 21 à la dent N° 25 car elle souffre depuis plusieurs années d’infection péri-apicales récidivantes.
Deux chirurgies de résection apicale ont déjà été réalisées par le passé mais les infections sont récidivantes. Après une étude clinique et radiologique complète et compte tenu du peu d’épaisseur osseuse présente sur ce site, il a été choisi de mettre en œuvre le plan de traitement suivant :
- extraction des dents N° 21 et 24 supports du bridge
- mise en oeuvre d’une technique de régénération osseuse guidée à l’aide de biomatériau allogénique recouvert de membranes résorbables en collagène réticulé
- temporisation pendant 5 mois par le port d’une prothèse amovible
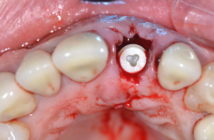
- réouverture du site à 6 mois post-opératoires avec mise en place de 3 implants au niveau des dents N° 21, 22, 24
- à ce stade la dent N° 25 ayant montré des signes d’infection péri-apicale, il a été décidé de l’extraire et de mettre en place dans le même temps opératoire un 4ème implant avec un comblement osseux péri-implantaire
- réalisation d’un bridge provisoire mis en sous occlusion et transvissé sur les implants le lendemain de l’intervention
- réalisation d’un bridge définitif, céramo-métallique, fixé sur quatre piliers eux-mêmes vissés sur les implants.
Conclusion
La technique de régénération osseuse guidée, telle qu’elle a été présentée dans cet article est simple, fiable et reproductible.
Il faut également se documenter et utiliser des biomatériaux qui ont scientifiquement fait leurs preuves dans de multiples parutions.
C’est une technique qui a l’avantage de rassurer les patients car elle ne fait pas appel de manière systématique à des prélèvements d’os autogène. Toutefois, il faut prendre le temps d’acquérir une certaine expérience et accepter une courbe d’apprentissage nécessaire.
Bibliographie
1. Beyen I, Kasten P, Vogel J, Niemeyer P, Luginbühl R, Richter W (2006): Porosity influences osteogenic differentiation in vivo and proliferation of mesenchymal stem cells in vitro on beta-tricalcium phosphate solid body scaffolds, but not osteogenic differentiation in vitro
2. Buser et al. Localized ridge augmentation using guided bone regeneration. Surgical procedure in the Maxilla. Int J Periodontics Restorative Dent 1993; 13: 29-45
3. Dahlin C., Lindhe A., Sennerby L., LEKHOLM U., Nyman S., Generation of new bone around titanium implants using a membrane technique : an experimental study in rabbits. Int. J. Oral Maxillofac. Implants. 1898 ; 4 : 19-25
4. Feuille F,Knapp CI, Brunsvold MA,Mellonig JT.Evaluations clinique et histologique des greffes osseuses de comblement pour le comblement des défauts crestaux localisés.
5. Première partie: allogreffe d’os minéralisé lyophilisé. PDR 2003;23:29-35
6. Friedman et al.Observations on a New Collagen Barrier Membranein 16 onsecutively Treated Patients.Clinical and Histological Findings.J.Periodontol 2001;72:1616-1623
7. Fugazzotto Paul A. Régénération Osseuse Guidée avec matrice osseuse bovine et membranes résorbables et non résorbables.PDR 2003, N°6; Vol 23. 599:605
8. Hallman M., Sennerby L., Lundgren S., A Clinical and Histologic Evaluation of Implant Integration in the Posterior Maxilla After Sinus Floor Augmentation with Autogenous Bone, Bovine Hydroxyapatite, or a 20:80 Mixture. International Journal of Oral & Maxillofacial Implants 2002, Volume 17, Pages 635-643
9. Mellonig James T, Histologic and clinical evaluation of an allogeneic bone matrix for the treatment of periodontal osseous defects. The International journal of periodontics & restorative dentistry 2006;26(6):561-9
10. Miller N et al.Resorption rates of 2 commercially available bioresorbable membranes. A histomorphometric study in a rabbit model.J Clin Periodontol 1996;23:1051-1059
11. MURRAY G, HOLDEN R, ROACHLAU W. Experimental and clinical study of new growth of bone in a cavity. Ann J Surg 1957 95: 385-387
12. Moses et al. Healing of dehiscence-type defects in implantsPlaced together with different Barrier Membranes.A Comparative Clinical Study.Clin Oral Impl Res. 2005; 16: 210-219
13. NYMAN S, KARRING T, LINDHE J, PLANTEN S. Healing following implantation of periodontitis affected roots into gingival connective tissue. J Clin Periodontol 1980 7: 394401
14. NYMAN S, GOTTLOW J, KARRING T, LINDHE J. The regenerative potential of the periodontal ligament. An experimental study in the monkey. J Clin Periodontol 1982a 9: 257-265
15. NYMAN S, LINDHE J, KARRING T, RYLANDER H. New attachment following surgical treatment of human periodontal disease. J Clin Periodontol. 1982b 9: 290-296
16. Queiroz et al. Use of Bovine Bone Graft and Bone Membrane in Defects Surgically Created in the Cranial Vault of Rabbits. Histologic comparative analysis. Int J Oral Maxil Implants 2006. 21;29-35
17. Rasmusson L; Sennerby L; Lundgren D; Nyman S. Morphological and dimensional changes after barrier removal in bone formed beyond the skeletal borders at titanium implants. A kinetic study in the rabbit tibia. Clinical oral implants research 1997;8(2):103-16
18. Rothamel et al. Biodegradation of Differently Cross LinkedCollagen Membranes: An Experimental Study in the rat.Clin Oral Impl Res 2004. 10;1-9
19. Schliephake H et al.A guided bone regeneration around endosseous implants using a resorbable membrane vs a PTFE membrane.Clin Oral Implants Res 2000;11:230-241
20. Von Arx T. et al. Membrane Durability and Tissue Response ofDifferent Bioresorbable Barrier Membranes: A Histologic Study in the Rabbit Calvarium.Int J Oral Maxillofac Implants 2005;20: 843-853
21. Zitzmann et al. Resorbable Versus Non Resorbable Membranes in Combination With Bio-Oss for Guided Bone Regeneration.Int J Oral Maxillofac Implants.1997; vol 12; N°6:844-852
Cas clinique
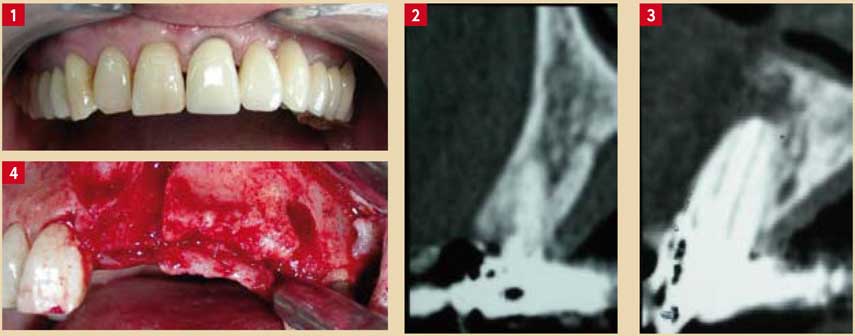
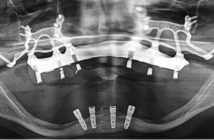
Fig. 1 : vue des dents au maxillaire avant intervention Fig. 2 et 3 : coupes scanner montrant les lésions apicales au niveau des dents N° 21 et 24 Fig. 4 : déhiscences osseuses au niveau des sites d’extraction des dents N° 21 et 24
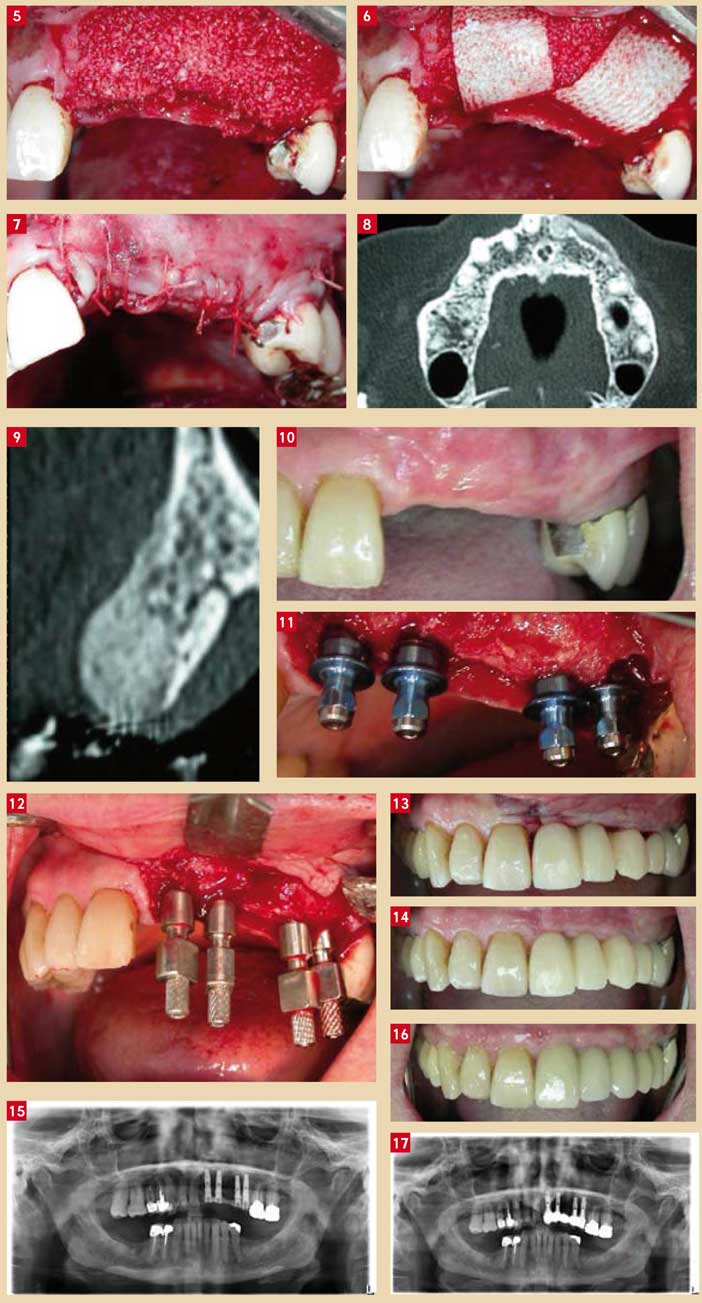
Fig. 5 : comblement à l’aide de biomatériau allogénique minéralisé en vue de régénérer de l’os en épaisseur au niveau de ces sites futurs d’implantation Fig. 6 : mise en place de membranes résorbables en collagène bovin réticulé Fig. 7 : sutures hermétiques primaires Fig. 8 et 9 : scanners de contrôle à 5 mois postopératoires sur lesquels il est possible de mesurer le volume osseux régénéré, permettant une mise en place d’implants dans de bonnes conditions Fig. 10 : vue du secteur d’implantation avant la chirurgie Fig. 11 : mise en place de 3 implants au niveau des dents absentes N° 21, 22, 24, extraction de la dent N° 25 et mise en place d’un quatrième implant Fig. 12 : mise en place de 4 transferts d’empreinte et prise d’empreinte en fin d’intervention Fig. 13 : mise en place d’un bridge provisoire en résine, transvissé, en sous occlusion, le lendemain de l’intervention Fig. 14 : cicatrisation gingivale autour du bridge provisoire après 4 semaines Fig. 15 : radiographie panoramique, bridge provisoire en place Fig. 16 : bridge céramométallique définitif Fig. 17 : radiographie panoramique finale