La nécrose pulpaire des dents permanentes immatures (DPI) stoppe le processus d’édification radiculaire, et par conséquent la fermeture apicale et l’épaississement des parois dentinaires.
Ce type de configuration rend le traitement endodontique difficile et aléatoire. Ce dernier présente essentiellement deux difficultés : la détermination précise de la limite apicale et l’obtention de l’étanchéité apicale lors de la procédure d’obturation.
Le traitement non chirurgical de ces cas permet l’édification d’une barrière apicale propice à une obturation canalaire définitive à la gutta-percha. Plusieurs techniques sont possibles.
La thérapeutique classique consiste en des stimulations répétées à l’aide d’hydroxyde de calcium, jusqu’à la formation d’une barrière calcifiée. Plus récemment, l’utilisation du Mineral Trioxyde Aggregate (MTA®) constitue une alternative intéressante.
Introduction
La dent permanente immature (DPI) est caractérisée par des tissus de recouvrement vulnérables (immaturité tissulaire), des racines inachevées à apex ouvert et des parois radiculaires fines et divergentes (1).
Ces caractéristiques physiologiques la rendent plus susceptible à subir des traumatismes et à développer des lésions carieuses, pathologies qui peuvent rapidement conduire à la nécrose de la pulpe.
Celle-ci peut stopper le processus d’édification radiculaire et donc la fermeture apicale, et provoquer l’arrêt de l’épaississement des parois dentinaires, majorant ainsi le risque de fracture radiculaire et compliquant le traitement endodontique. En effet, le parage canalaire est souvent difficile à réaliser, et l’obtention de l’assèchement du canal et de l’étanchéité de l’obturation peuvent également poser problème en raison de l’absence de la barrière apicale.
Aussi, des techniques d’apexification sont indispensables pour atteindre les objectifs du traitement endodontique et permettre la conservation de la dent sur l’arcade.
Les particularités du traitement endodontique de la DPI nécrosée
Le traitement des DPI à pulpe nécrosée repose plus généralement sur les principes thérapeutiques de tout traitement endodontique. Cependant, ses particularités anatomophysiologiques imposent certains ajustements.
La désinfection canalaire
Dans la majorité des cas, la pulpe nécrosée est infectée, c’est pourquoi la première phase du traitement s’atèle à désinfecter le système canalaire pour permettre la guérison périapicale. (2)
A cause de la finesse des parois radiculaires, le traitement endodontique canalaire sera moins instrumental. Le parage canalaire sera obtenu essentiellement par une irrigation canalaire abondante et fréquemment renouvelée. (3,4)
L’hypochlorite de sodium (NaOCl) reste la solution de référence, et vu le risque accru de sa propulsion au-delà de l’apex ouvert, nous avons préféré l’utiliser à une concentration de 0,5% beaucoup moins toxique vis-à-vis des tissus périapicaux (2). Cette diminution de concentration sera compensée par l’augmentation du volume de la solution associée à l’emploi d’ultrasons. (5)
La médication intermédiaire jouera un rôle tant de désinfection profonde que de prévention des résorptions. Ainsi, une obturation canalaire transitoire à l’hydroxyde de calcium reste d’actualité. (6-10)
C’est la combinaison entre la désinfection chimique et l’obtention d’une barrière apicale qui permettra de mener à bien le traitement. C’est pourquoi, le deuxième temps du traitement fera appel aux techniques d’apexification.
L’apexification
L’apexification est définie par l’American Association of Endodontics comme étant «l’induction de la fermeture et/ou de la reprise du développement d’une dent immature dont la pulpe n’est plus vivante». (7)
Il s’agit d’une thérapeutique endodontique effectuée sur une racine à apex ouvert, visant à induire la fermeture apicale ou la reprise du développement d’une dent immature dont la pulpe n’est plus vivante, par la formation d’un ostéocément ou d’un tissu comparable.(7)
Le matériau destiné à servir de bouchon apical doit d’une part, constituer une barrière permettant la condensation de gutta-percha et d’autre part, être étanche, non résorbable, non cytotoxique et biocompatible, permettant ainsi une cicatrisation périapicale normale.
La thérapeutique classique d’apexification consiste en des stimulations répétées à l’apex de la dent à l’aide d’hydroxyde de calcium (Ca(OH)2), jusqu’à la formation d’une barrière calcifiée primordiale pour permettre l’obturation définitive du réseau canalaire.
En effet, l’hydroxyde de calcium, pâte à pH basique, est un matériau bien connu pour ses propriétés biologiques de stimulation de l’élaboration des tissus calcifiés, ainsi que pour ses propriétés antiseptiques et hémostatiques. (2, 6)
Une fois la barrière apicale obtenue, l’obturation canalaire complète pourra être réalisée secondairement à la gutta percha.
Si cette technique d’apexification semble couronnée de succès dans 74 à 100 % des cas (11-13), elle présente, toutefois, plusieurs inconvénients :
- Il s’agit d’une technique relativement longue. En effet, l’hydroxyde de calcium étant résorbable, son renouvellement est nécessaire à intervalles réguliers, sur une période relativement longue avant d’obtenir cette fermeture apicale (de 6 à 18 mois en fonction du degré d’immaturité de la dent).
- Elle implique de ce fait une forte compliance du patient, qui doit se soumettre à des séances de contrôle régulières avant la fin du traitement.
- En plus, il existe des risques de réinfection du réseau canalaire du fait du manque d’étanchéité, lié à la mise en place d’une obturation provisoire prolongée.
- Sans oublier la fragilité de la barrière apicale obtenue, qui rend les procédures ultérieures, à savoir le nettoyage des parois radiculaires et l’obturation du système canalaire, très délicates.
- Enfin, un risque accru de fracture radiculaire a été attribué au matériau (14), sans oublier la part imputée aux nombreuses réinterventions.
De nombreux matériaux ont été proposés pour former un bouchon apical au niveau des dents à apex ouvert : le phosphate tricalcique (Harbert H), les gels de collagène (Grespi P), la poudre de dentine avec du true bone ceramic (Yashida T) et l’osteogenic protein (Tucker M)… Bien que ces matériaux soient connus pour être biocompatibles, ils n’offrent par contre, aucune adaptation aux parois dentinaires et n’assurent donc aucune étanchéité. (15)
Le Mineral Trioxide Aggregate MTA®a été proposé par Torabinejad et son équipe en 1993, et a subi une série d’expérimentations ayant montré son efficacité et son innocuité autant qu’agent de scellement potentiel des voies de communication entre le système canalaire et la surface externe de la dent.
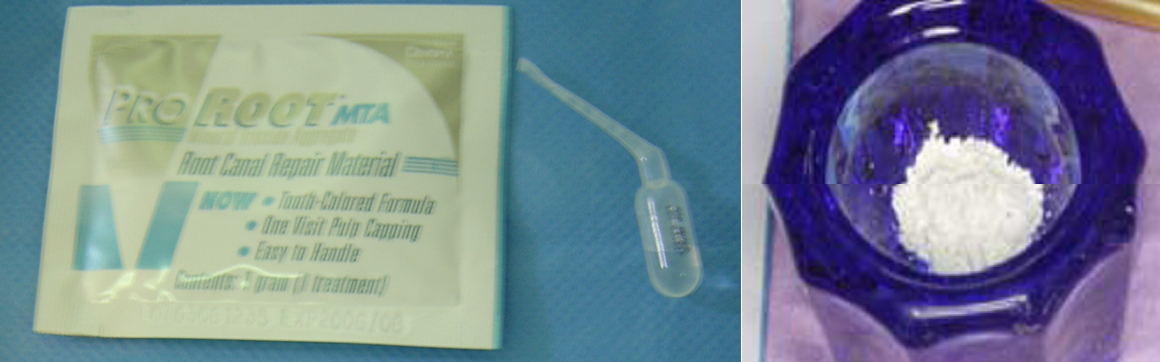
Fig.1 : présentation commerciale du MTA® (ProRoot MTA®, Dentsply) Il s’agit d’une poudre de fines particules hydrophiles d’oxydes minéraux (des silicates tricalciques, des aluminates tricalciques, des oxydes tricalciques et des oxydes silicates).
Qu’est-ce que le MTA®?
Le MTA® (ProRoot MTA®, Dentsply) (Fig.1) est un ciment à pH basique sous forme d’un gel colloïdal obtenu par l’hydratation d’un agrégat de fines particules hydrophiles d’oxydes minéraux (des silicates tricalciques, des aluminates tricalciques, des oxydes tricalciques et des oxydes silicates), qui se solidifie en milieu humide, 4 à 6 heures après. (2,6,16,17)
Grâce à ses propriétés de biocompatibilité, de radio-opacité, ce matériau non résorbable, étanche en milieu humide, représente un matériau de choix pour l’apexification et l’obturation des dents permanentes immatures.
Comme pour le Ca(OH)2, on lui attribue l’induction de formation de tissus durs. Ceci est objectivé par l’apposition de cément et de tissu osseux et la formation de pont dentinaire à son contact. D’autres études chez l’animal ont démontré la présence de néoformation cémentaire avec régénération du ligament alvéolo-dentaire. (17-19)
Shabahang et coll. en 1999 ont montré que le pourcentage de fermeture apicale était supérieur au niveau des racines traitées au MTA® qu’avec l’hydroxyde de calcium. Le mécanisme exact impliqué dans la formation de cette barrière de tissu calcifié demeure encore inconnu. Cependant, on sait que celle-ci provient de la migration de cellules, à partir des tissus péri-radiculaires sains vers l’apex, qui sont capables de se différencier sous l’influence d’un signal spécifique en cellules sécrétant la matrice organique du cément, ostéo-cément ou ostéo-dentine. Des facteurs de croissance pourraient être impliqués dans ce mécanisme. (7,20,21)
En pratique, l’obturation du tiers apical va être réalisée en mettant en place un bouchon de MTA®, qui va fermer l’apex, et jouer un rôle inducteur dans les processus de minéralisation.
Par la création d’une barrière apicale artificielle, ce matériau va permettre de réduire le nombre de séances par rapport à une technique d’apexification classique à l’hydroxyde de calcium, et contribuer ainsi au succès du traitement en limitant les délais sous obturation provisoire.
Après la mise en place de ce bouchon apical de MTA®, il est nécessaire de pérenniser le résultat d’apexification par l’obturation la plus étanche possible de façon à s’opposer de manière durable à la pénétration bactérienne, et à obtenir le scellement étanche du système canalaire. Pour ce faire, plusieurs techniques d’obturation canalaire par compactage de gutta percha adaptées à l’anatomie endodontique de la dent permanente immature ont été proposées.
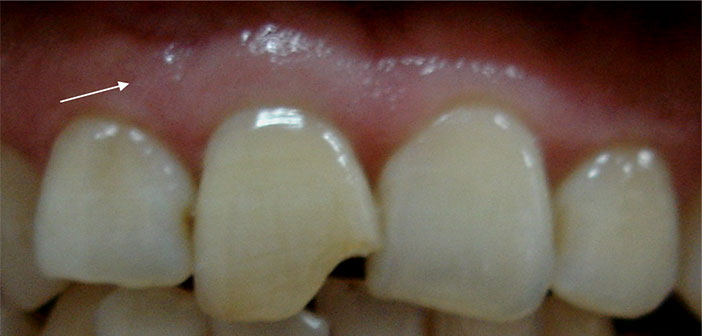
Fig.2 : situation initiale. Dyschromie, fracture amélo-dentinaire de l’angle mésial de la 11, et ostium en regard de la 11 (flèche blanche).
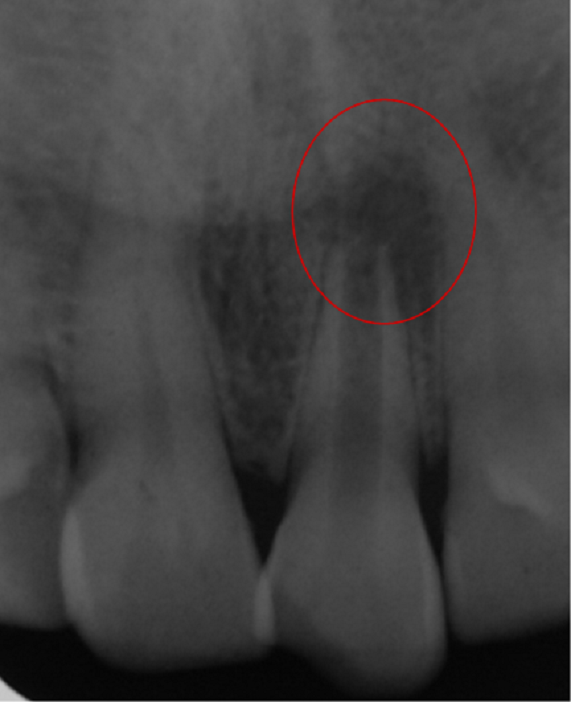
Fig.3: Radiographie Révélant La Présence D’une Lésion Périapicale au niveau de la 11 immature (stade 9 de Nolla).
Protocole opératoire d’apéxification avec le MTA
À travers une situation clinique, nous allons détailler les différentes étapes de la mise en place du bouchon apical de MTA®, pour le traitement d’une DPI nécrosée.
Situation clinique initiale
La consultation de Ilham, 27 ans, est motivée par une doléance esthétique.
Elle est gênée par une dyschromie et une fracture amélo-dentinaire de l’angle mésial de la première incisive supérieure. (Fig.2)
L’interrogatoire ne révèle aucun problème de santé général, et la patiente rapporte un ancien traumatisme, des antécédents de douleur et de tuméfaction.
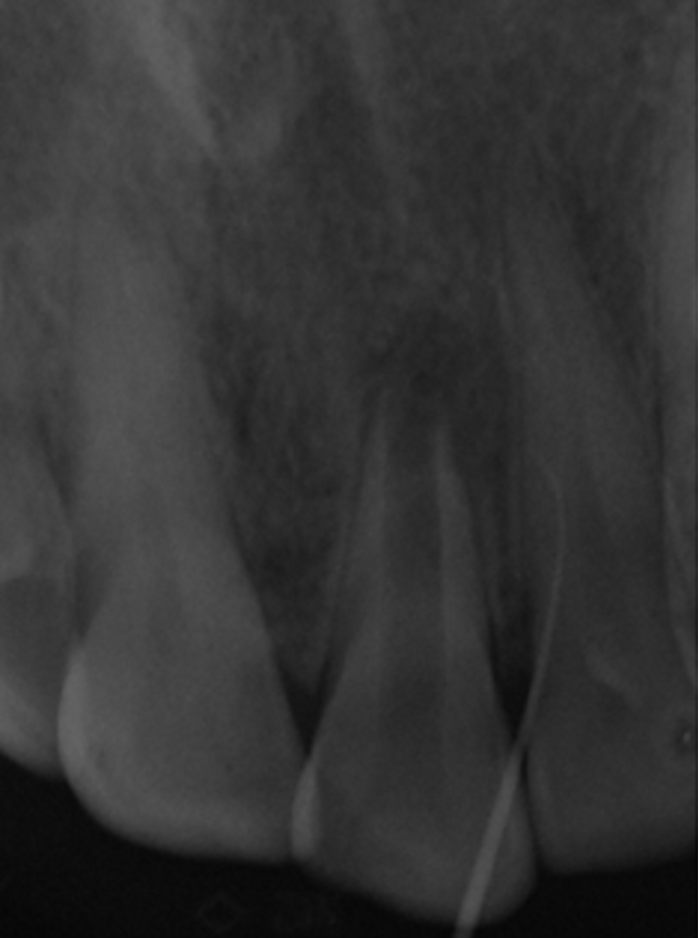
Fig.4: radiographie cône en place permet d’objectiver le trajet fistuleux.
L’examen clinique révèle en plus, la présence d’une fistule en regard de la 11. (Fig.2)
Les tests de sensibilité pulpaire sont négatifs. Les tests de percussion et de palpation sont positifs.
À l’examen radiographique, on note la présence d’une lésion périapicale au niveau de la 11 à apex ouvert et qui semble avoir arrêté son édification radiculaire au stade 9 de Nolla. (Fig.3)
Une radiographie cône en place permet de rattacher la fistule muqueuse à la lésion apicale sur la 11. (Fig.4)
Les éléments recueillis permettent de poser le diagnostic d’une parodontite apicale chronique fistulisée sur la 11 immature.
Un traitement d’apexification par mise en place d’un bouchon de MTA® est entrepris.
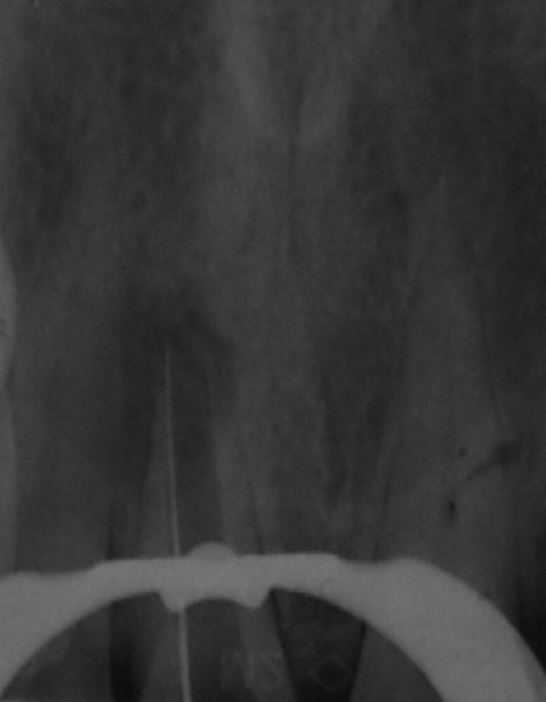
Fig.5 : radiographie lime en place pour déterminer la longueur de travail en se référant à la paroi la plus courte.
La désinfection du système canalaire
Après la pose d’un champ opératoire étanche, la 11 est trépanée en veillant à éliminer tous les surplombs, ensuite la longueur de travail est déterminée en se référant à la paroi radiculaire la plus courte. (Fig.5)
Le parage canalaire est réalisé sous irrigation abondante à l’hypochlorite de sodium à une concentration de 0.5 %, en veillant à ne pas fragiliser les parois canalaires par une instrumentation excessive.
Le canal est ensuite séché par des pointes en papier stériles à gros diamètre, et une médication intracanalaire à base d’hydroxyde de calcium est mise en place afin d’assurer une bonne désinfection du système endodontique (Fig.6).
La réintervention est programmée une semaine plus tard. (10)
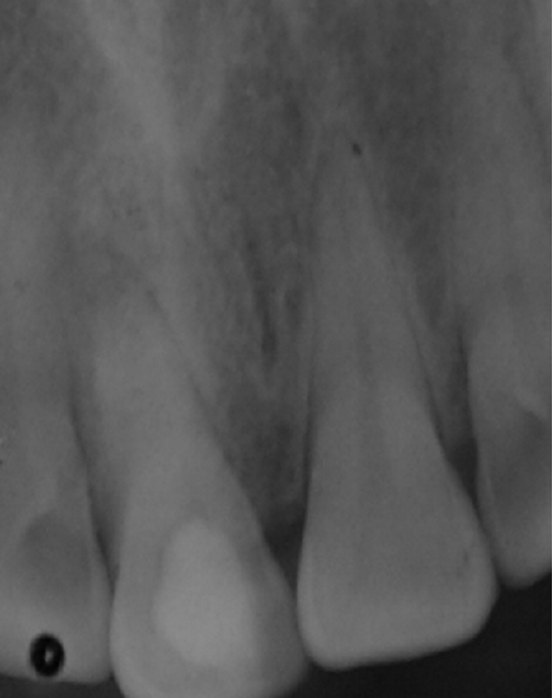
Fig.6 : contrôle de la mise en place de Ca (OH)2 dense dans le canal, par absence de la lumière canalaire, le Ca (OH)2 ayant la même radio opacité que la dentine.
Mise en place du MTA
En l’absence de complications, un bouchon apical de MTA est mis en place par voie coronaire afin de réduire le temps d’apexification.
Au préalable, on procède au choix du fouloir vertical qui va servir à le compacter dans le canal en direction apical.
Celui-ci doit pouvoir arriver à la longueur de travail moins 3 à 4mm, sans frottement avec les parois canalaires. (22)
Une radiographique fouloir en place permet de vérifier la présence d’une hauteur suffisante pour mettre le bouchon de MTA®. (Fig.7)
La poudre est mélangée avec de l’eau stérile dans un rapport 1/3, sur un support de verre avec une spatule plastique ou métallique. (2,6,16,17)

Fig.7 : un contrôle radiographique avec le fouloir en place, permet de vérifier la présence d’une hauteur suffisante pour mettre le bouchon apical de MTA®.
En attendant sa mise en place dans le canal, le ciment peut être protégé par une compresse humidifiée pour éviter son desséchement.
Par la suite, une carotte du ciment est prélevée, à l’aide d’un MTA carrier (MTA Gun® de Dentsply) qui nécessite certes un investissement supplémentaire, mais est très pratique.
Le cas échéant, on peut utiliser un porte-amalgame à petite tête en plastique (Fig.8).
La carotte de MTA prélevée est placée à l’entrée du canal sec, puis compactée en direction apicale.
Par la suite, une radiographie de contrôle est prise pour contrôler que le bouchon apical est bien étanche et qu’il reste contenu dans l’espace endodontique(Fig.9).
Tout dépassement de matériau est non résorbable. Ceci n’est pas dramatique en soit, compte tenu de la biocompatibilité du MTA, mais demeure non souhaitable. L’utilisation du microscope opératoire permet de mieux maîtriser chaque phase du traitement.

Fig.8 : la poudre est mélangée avec de l’eau stérile dans un rapport 1/3, sur un support en verre avec une spatule plastique ou métallique, et une carotte est prélevée avec un porte-amalgame à petite tête pour le mettre en place dans le canal.
Une boulette en coton humidifiée est mise en place pour assurer la prise du MTA®. Ceci nécessite 4 à 6 heures en tout. Une restauration coronaire étanche est évidemment mise en place afin d’éviter la recolonisation bactérienne.
Si le contrôle radiologique montre un manque d’étanchéité ou un dépassement du MTA®, il suffit de bien rincer et recommencer, tant que le ciment n’a pas durcit.
Une technique classique d’obturation à la gutta percha vient parachever la préparation canalaire. On contrôle radiographiquement, l’obturation du reste du canal radiculaire, réalisée dans ce cas par la technique de condensation verticale a chaud. (Fig.10)
Pour finir, une restauration coronaire étanche est nécessaire pour rétablir la fonction et l’esthétique, tout en assurant une bonne étanchéité coronaire.
Chez cette patiente, nous avons répondu à la doléance esthétique par un éclaircissement interne (Fig.11), suivie d’une restauration directe aux composites par technique de stratification. (Fig.12)
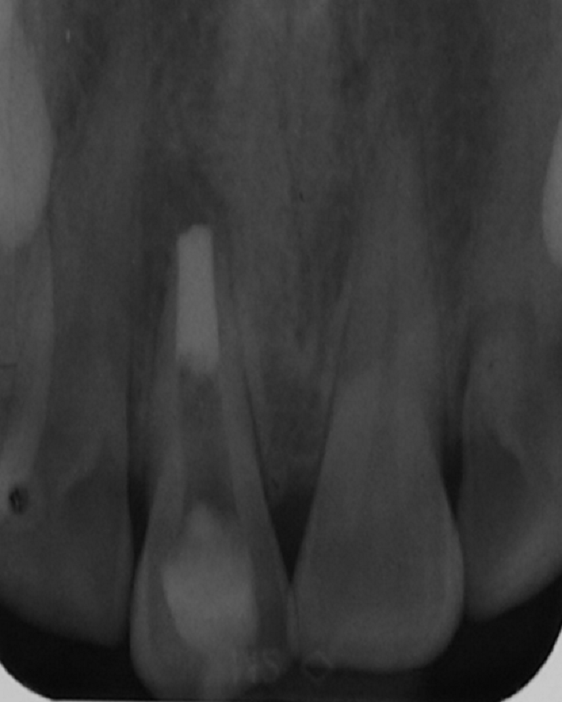
Fig.9 : radiographie de contrôle prise après mise en place du MTA®.
Conclusion
Pendant de nombreuses années, le traitement endodontique des dents permanentes immatures était difficile, fastidieux et long : de nombreuses séances d’hydroxyde de calcium s’étalaient sur de longs mois pour obtenir la formation d’une fragile barrière apicale.
Depuis quelques années, le MTA® permet de simplifier la procédure d’apexification. En effet, ses caractéristiques permettent de réaliser artificiellement l’apexification en 2 ou 3 rendez-vous peu espacés, permettant un gain de temps considérable. La réalisation de l’obturation canalaire et coronaire dans des délais brefs (24 heures à une semaine), diminue ainsi, le risque de fracture d’une dent déjà fragilisée. (15,23)
Cependant, en dépit de la fermeture apicale, les parois radiculaires resteront fines, augmentant le risque de fracture radiculaire dans le temps, aux conséquences souvent irréversibles.
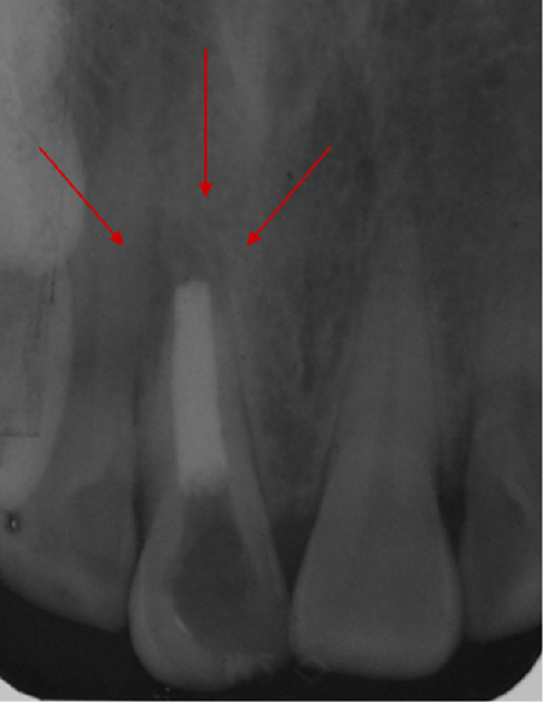
Fig.10 : après un délai de 24 h à une semaine, l’obturation à la gutta-percha est réalisée classiquement par condensation verticale au contact du bouchon apical solidifié de MTA®. Notons la régression de la lésion apicale (flèches), 1mois après le début du traitement.
Récemment, des approches alternatives ont été explorées pour palier à cet inconvénient. Leur objectif est de stimuler, en dépit de la nécrose pulpaire, une régénération tissulaire similaire à celle obtenue par le traitement d’apexogénèse ; à savoir la possibilité de réactiver le développement radiculaire tridimensionnel aussi bien en terme de longueur que d’épaisseur. (24)
Ces techniques de régénération pulpaire semblent être possibles aujourd’hui grâce au recrutement de cellules souches de la papille apicale. Cependant, cette hypothèse reste à démontrer. (25)
Concrètement, la procédure consiste, après désinfection de l’espace canalaire (hydroxyde de calcium, pâte antibiotique), de remplir le canal concerné avec un caillot sanguin issu d’un saignement péri-apical. Puis le canal est obturé de manière étanche dans sa portion coronaire (MTA ou CVI) et un suivi est instauré. (26)
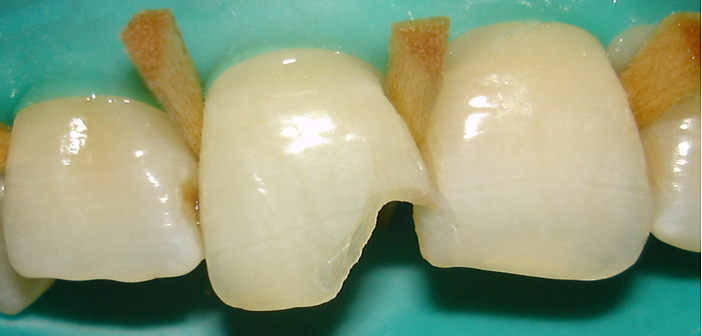
Fig.11 : situation après éclaircissement interne au perborate de Sodium, pose de la digue sectorielle et réalisation du biseau esthétique.
Pour l’instant, les différentes publications sont essentiellement des séries de cas (27-31), qui montrent, avec un recul de 1 à 5 ans, des taux de succès élevés avec édification apicale de la racine, fermeture de l’apex et formation pseudo-dentinaire-cémentaire intracanalaire (rétrécissement du diamètre canalaire).
La reproductibilité et la fiabilité de ces techniques ainsi que la nature des tissus qui se forment lors de la fermeture des racines sont toujours en cours d’étude. (25)
Il parait évident qu’avec le développement de telles approches, le recours à l’apexification devienne obsolète dans le future proche. Néanmoins, d’autres données cliniques devront être recueillies pour confirmer la prévisibilité de ce traitement.
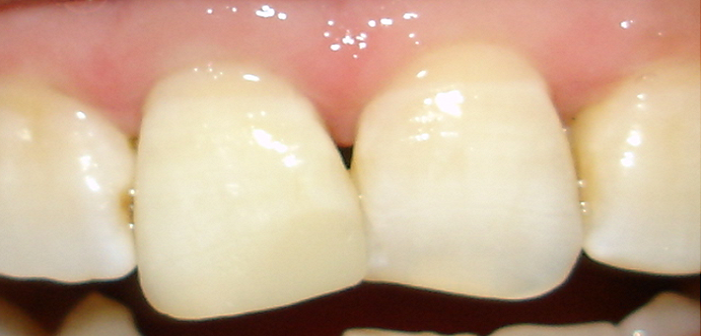
Fig.12 : situation finale, après éclaircissement interne, suivi d’une restauration esthétique par stratification des composites.
Bibliographie
1. CLERGEAU-GUERITHAUT S. La dent permanente immature. Réalités cliniques.Vol.3 n° 4/ 1992. pp : 453-460.
2. TROPE M..Treatment of immature teeth with non-vital pulps and apical periodontitis. Endodontic Topics 2006, 14, 51–59.
3. CVEK M, NORD CE, HOLLENDER L. Antimicrobial effect of root canal debridement in teeth with immature roots. A clinical and microbiologic study. Odontol Rev 1976: 27: 1–10.
4. SPÅNGBERG L, RUTBERG M, RYDINGE E. Biologic effects of endodontic antimicrobial agents. J Endod 1979: 5:166–175.
5. CARVER K, NUSSTEIN J, READER A, BECK M. In vivo antibacterial efficacy of ultrasound after hand and rotary instrumentation in human mandibular molars. J Endod 2007: 33: 1038–1043.
6. CLAISSE-CRINQUETTE A., CLAISSE D. Hydroxyde de calcium ou MTA en traumatologie. Réalités cliniques, 2002, 13(1) : 53-73
7. RAFTER M. Apexification: a review. Dent Traumatol, 2005,21: 1-8
8. CVEK M., HOLLENDER L. et NORD C.E. Treatment of non-vital permanent incisors with calcium hydroxide. VI. A. Clinical, microbiological and radiological evaluation of treatment in one sitting of teeth with mature or immature root. Odontol Rev 27 : 93-108, 1976.
9. BYSTROM A, CLAESSON R, SUNDQVIST G. The antibacterial effect of camphorated paramonochlorophenol, camphorated phenol and calcium hydroxide in the treatment of infected root canals. Endod Dent Traumatol 1985: 1: 170–175.
10. SJOGREN U., FIGDOR D., SPANGBERG L., SUNDQVIST G. The antibacterial effect of calcium hydroxide as a short-terin intracanal dressing. Int Endod J 24 : 119-125, 1991.
11. BREILLAT J. Anatomo-pathologie de l’apexogenèse et de l’apexification. Endodontie clinique, éd. CDP, paris, 1986
12. KEREKES K, HEIDE S, JACOBSEN I. Follow-up examination of endodontic treatment in traumatized juvenile incisors. J Endod 1980: 6: 744–748.
13. FRANK AL. Therapy for the divergent pulpless tooth by continued apical formation. J Am Dent Assoc 1966: 72: 87–92.
14. ANDREASEN JO, FARIK B, MUNKSGAARD EC. Long-term calcium hydroxide as root canal dressing may increase risk of root fracture. Dent Traumatol 2002;18:134–7.
15. TARDIEU C., BACOUCHE Z., CHAFAIE A., PERLOT WJ. MTA ; un nouveau matériau pour l’obturation des apex ouverts. Clinic 2000; 21(6) : 375-383.
16. BESLOT A., LASFARGUES J-J. Mineral trioxide aggregate MTA : matériau d’apexification? Information dentaire, 2004, 35: 2263-2273
17. TORABINEJAD M., COCHET J.Y. Le MTA : un nouveau matériau pour de nombreuses applications cliniques. Information Dentaire, 1999 ; (21) : 1503-1511.
18. ESRTELA C., BAMMANN L.L, ESTRELA C.R. et coll. “Antimicrobial and chemical study of MTA, portland cement, calcium hydroxide paste, sealapex and dycal.” Braz Dent J, 2000, 11(1): 3-9
19. BACK S-H., PLENK H., KIM S. Peiapical tissue responses and cementum regeneration with amalgam, super EBA, and MTA as root end filling materials. J Endod, 2005, 31(6): 444-449
20. HAM K.A. ; WITHERSPOON D.E. ; GUTMANN J.L. et coll. “ Preliminary evaluation of BMP-2 expression and histological characteristics during apexification with calcium hydroxide and mineral trioxide aggregate.” J Endod, 2005, 31(4): 275- 279
21. HOLLAND R, DE SOUZ AV, MURATA S.S. “Healing process of dog dental pulp, after pulpotomy and pulp capping with MTA or Portland cement.” Braz Dent J 2001 : 109-113
22. SHABAHANG S. et TORABINEJAD M. Treatment of teeth with open apices using mineral trioxide aggregate. Pract Peridont Aesthest Dent 3 : 315-319, 2000.
23. GUILLANI V., BQCETTI T., PACE R., PACAVINO G. the use of MTA in teeth with necrotic pulps and open apices. Dent traumatol, 2002,18 :2117-2221.
24. HUANG G.T.-J. Apexification: the beginning of its end. International Endodontic Journal, 2009,42 : 855–866.
25. SIMON S. Régénération en endodontie. Régénération ou réparation ?. L’INFORMATION DENTAIRE 2013, 43 : 16-19.
26. AAE – Regenerative endodontics. Available from : http://www.aae.org/publicationsand- research/research/regenerative-database.aspx
27. IWAYA SI, IKAWA M, KUBOTA M. Revascularization of an immature permanent tooth with apical periodontitis and sinus tract. Dental Traumatology, 2001, 17:185–7.
28. BANCHS F., TROPE M. Revascularization of immature permanent teeth with apical periodontitis: new treatment protocol? Journal of Endodontics, 2004, 30 : 196–200.
29. CHUEH L-H, HUANG GTJ. Immature teeth with periradicular periodontitis or abscess undergoing apexogenesis: a paradigm shift. Journal of Endodontics, 2006, 32:1205–13.
30. THIBOBEAU B, TEIXEIRA F, YAMAUCHI M, CAPLAN DJ, TROPE M. Pulp revascularization of immature dog teeth with apical periodontitis. Journal of Endodontics, 2007, 33: 680–9.
31. THIBOBEAU B, TROPE M. Pulp revascularization of a necrotic infected immature permanent tooth: case report and review of the literature. Pediatric Dentistry, 2007, 29: 47–50.




