La mandibule est sans doute la région anatomique présentant le plus de risques de lésions anatomiques irréversibles lors d’une chirurgie en odontologie : les cas de lésions du nerf alvéolaire inférieur par exemple sont fréquemment décrits, que ce soit en endodontie, extractions des 3èmes molaires, chirurgie orthognatique ou en implantologie. Nous allons développer ici les risques hémorragiques et neurologiques lors de la chirurgie implantaire.
Rappels sur les structures et zones anatomiques a risque a la mandibule
Les principales structures anatomiques à éviter sont :
- le nerf alvéolaire inférieur
- les artères sub-mandibulaire et sub-linguale
Le nerf alvéolaire inférieur
Le canal mandibulaire
Le nerf alvéolaire inférieur (NaI) est une branche du nerfmandibulaire V3, et est uniquement sensitif. [1, 2] Issu du tronc postérieur du nerf mandibulaire, il se dirige en bas et en avant, jouxtant d’abord le nerf lingual, et pénètre ensuite dans la branche de la mandibule par l’orifice postérieur du canal mandibulaire, accompagné des artères et veines alvéolaires inférieures. Initialement, le NaI possède trois branches, chacune innervant les différents groupes de dents mandibulaires : molaire, prémolaire et incisif. [1] dans sa partie intra mandibulaire, le nerf est généralement en dedans et au-dessus des vaisseaux. Le canal mandibulaire n’est pas un cylindre d’os cortical. Il est dessiné par une trabéculation dense avec de nombreuses fenestrations. Sans insertions musculaires et périoste, cela ne peut être une structure corticalisée. [2] Le canal mandibulaire peut présenter des variations anatomiques, et être bifide : chaque canal possède un plexus neuro-vasculaire. Ces branches fusionnent ensuite. Une fusion incomplète peut entraîner un foramen mentonnier bifide ou trifide. [3] En arrivant au niveau du foramen mentonnier, le NaI se divise en 2 branches, mentonnière et incisive. Le nerf mentonnier émerge du foramen mentonnier. Il se sépare en trois branches : une innervant la peau au niveau du menton, et les autres pour la peau de la lèvre inférieure, la muqueuse et la gencive en avant de la 2ème prémolaire. [4]
Le nerf incisif continue jusque dans la partie antérieure à l’intérieur de la mandibule, et innerve la canine et les incisives, ainsi que la gencive.
Le foramen mentonnier
Le canal mentonnier, canal osseux constituant une ramification du canal mandibulaire, se termine par le foramen mentonnier. Il est situé sur le côté extérieur du corps de la mandibule, dans la zone des prémolaires. Le foramen mentonnier s’ouvre à l’intérieur de la corticale vestibulaire vers le haut et vers l’arrière. [5]
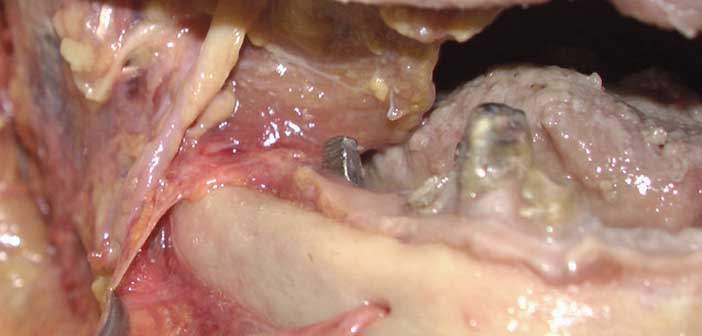
Fig 1 : Foramen mentonnier et branche mentonnière du NAI (Pr B. Ella).
Dans le sens vertical, le trou mentonnier est situé environ à mi-hauteur de la mandibule chez l’adulte denté, dans le tiers inférieur chez l’enfant, et dans le tiers supérieur chez l’adulte édenté. Chez le patient édenté depuis de nombreuses années, le trou mentonnier peut se trouver directement sur le corps de la mandibule, suite à la résorption complète en hauteur de la crête alvéolaire. [5] dans le plan horizontal, le canal peut se diriger vers l’avant, ou se présente sous forme d’une « boucle » car revient en arrière (86,7 % chez le caucasien). Il peut aussi effectuer un angle droit vers l’extérieur depuis le canal mandibulaire. (45,8 % dans les populations mélaniques). [6]
L’anatomie en boucle antérieure peut représenter un risque en implantologie : d’autant plus que son extension peut atteindre jusqu’à 7 mm…[7]
Le foramen est le plus souvent situé sous l’apex de la seconde prémolaire dans 73,8 % des cas. Le 2ème cas le plus fréquent entre la 1ère et 2ème. [8]
Il existe des variations anatomiques du foramen avec parfois un foramen mentonnier lingual. Il peut également dans de rares cas être absent. [9]
Il existe aussi des foramens bifides (1,4 à 12,5 % des cas) ou trifides( 0,4 à 1,2 %). [10]
La fréquence variable des foramina mentonniers accessoires semble correspondre à des différences ethniques [9]. Ces foramens sont dits accessoires quand ils ont un diamètre inférieur à 1mm. [11]
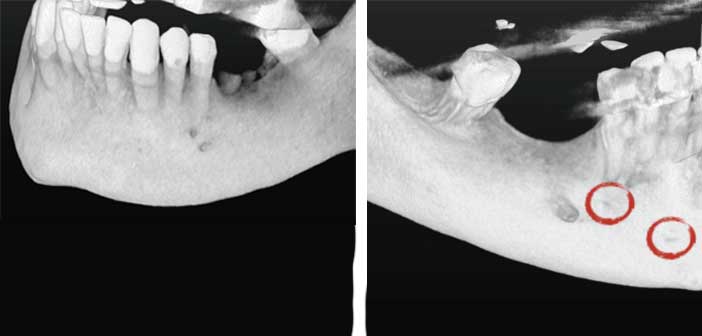
Fig 2 : exemple de foramen mentonnier bifide. / Fig. 3 : foramina vestibulaires accessoires.
Le nerf incisif
L’obstacle anatomique principal de la zone mentonnière est le nerf incisif.
Généralement à distance dans la symphyse, il peut être la cause de sensibilités lors de la chirurgie implantaire, car n’étant pas anesthésié lors d’une injection para-apicale. Il peut être la source de sensibilités suite à de la chirurgie. Il sera identifiable dans 98,5 % des cas dès son origine, 74 % au niveau canin et 28 % au niveau de l’incisive latérale. donc dans sa partie initiale, il devra être géré de la même façon que le canal mandibulaire. [12]
Des cas de complications neurologiques ont été rapportés dans la littérature au niveau canin. [13]
Il n’y a pas de consensus sur la gestion du canal incisif dans les zones antérieures. Mais les risques de suites opératoires neurologiques incitent à prendre des précautions : il peut survenir de 5,2 % à 34 % de troubles de la sensibilité́ après la pose d’implants dans la zone antérieure mandibulaire, pouvant atteindre jusqu’à 11,8 % de troubles permanents. [14, 15]
Les arteres de la region sub-mandibulaire
L’artère submentale
L’artère submentale est une branche volumineuse de l’artère faciale longeant la face interne du corps de la mandibule, sous le muscle mylo-hyoïdien. Elle fournit de rameaux à la glande submandibulaire, aux muscles mylohyoïdien et digastrique, et aux parties molles du menton où elle s’anastomose avec les rameaux mentonniers de l’artère alvéolaire inférieure.
Certaines de ses branches terminales pénètrent également dans la mandibule par les foramina linguaux.
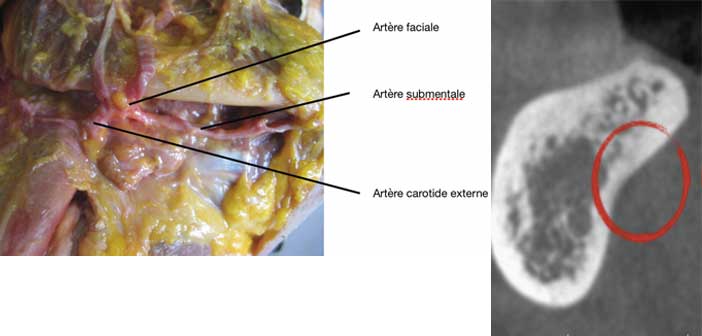
Fig 4 : naissance et distribution de l’artère sub-mentale (Pr B. Ella) / Fig 5 : zone de circulation de l’artère sub-mentale.
L’artère submentale chemine le long de la face interne de la mandibule dans la zone molaire.
L’artère sublinguale
L’artère sublinguale est une branche terminale inférieure de l’artère linguale. Elle se distribue à la glande sublinguale et se termine par un rameau maxillaire et un rameau mentonnier.
Certaines branches peuvent pénétrer dans la mandibule, à l’image de l’artère submentale, par des foramina linguaux.
Les plus fréquents sont les canaux linguaux médians [16]. Ils peuvent être longs, et donc à risque en chirurgie : d’une longueur moyenne de 6,2 mm, ils peuvent atteindre 12 mm. [17]
Moins connus, il existe également fréquemment des canaux linguaux latéraux : 74,6 % dans la région incisivecanine, 19,7 % dans la région prémolaire et 5,7 % en molaire.
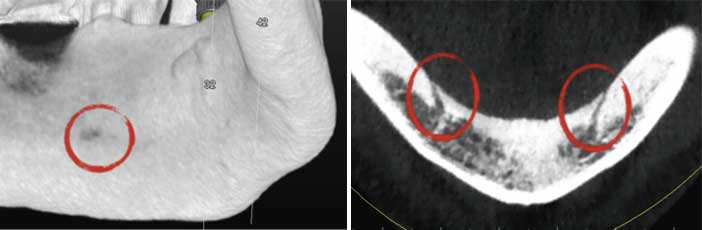
Fig 6 : exemple de canaux linguaux latéraux, ici en position prémolaire.
Étiologies des complications chirurgicales a la mandibule
Lors de la pose d’implants à la mandibule, elles seront principalement de deux ordres : hémorragiques et/ou nerveuses.
Nous nous limiterons ici aux complications directement liées à la pose des implants.
Les complications hemorragiques
C’est souvent à la mandibule que des cas de lésions hémorragiques potentiellement mortelles ont été rapportés dans la littérature lors de chirurgies implantaires. [18]
Dubois et coll. [19] ont rapporté 18 cas : 8 ont nécessité une intubation, 7 une trachéotomie et 3 une surveillance seule. dans la majorité des cas, ces complications interviennent lors de chirurgie dans la région antérieure, entre les canines, à cause d’une perforation de la corticale linguale. Elle entraîne une lésion des branches terminales de l’artère sublinguale ou submentale [20, 21]. Le risque de perforation est plus important si la fosse linguale est très marquée, et est augmenté dans les cas de chirurgie sans lambeau. dans la région postérieure, les perforations de la corticale linguale sont moins dangereuses : à part la glande submandibulaire et les noeuds lymphatiques, il n’y a pas de risque de lésion de « structures vitales ». Une perforation peut malgré tout léser le nerf lingual.
Les lesions nerveuses
Les étiologies des lésions traumatiques du NaI ou du nerf lingual NL peuvent être multiples. Elles ont depuis longtemps été décrites en endodontie ou lors de l’avulsion des 3èmes molaires. Le nerf alvéolaire inférieur est le plus souvent touché (64,4 %), suivi du nerf lingual (28,8 %). La différence est que les lésions du NaI par rapport au NLsont très souvent iatrogéniques, et ne se résolvent souvent pas dans les 8 semaines suivant la chirurgie.
En chirurgie implantaire, plusieurs études montrent une prévalence variant de 0 à 13 % [22], et même 44 % de lésions du NaI [23].
Alors que dans les autres types de chirurgies, les lésions sont souvent transitoires (80 % environ), en chirurgie implantaire, elles sont principalement permanentes (dans 75 % des cas). [24]
Les conséquences nerveuses peuvent être de différents types : allodynie, hypoesthésie, paresthésie, anesthésie ou dysesthésie.
Classification des lésions nerveuses
En 1943, Seddon[25] et Sunderland[26] ont décrit chacun une classification des lésions nerveuses traumatiques. Seddon distingue 3 catégories : les neuropraxie, axonotmesis et neurotmesis, alors que Sunderland les classe en 5 degrés. Ces classifications se basent sur la durée et la récupération complète ou non de la sensibilité.
– La neuropraxie (ou degré 1) : il y a blocage de l’influx nerveux lié à un étirement, une manipulation ou une compression légère. Les conséquences sensorielles ou motrices sont transitoires, liées à un oedème intrafasciculaire. La résolution sensorielle ou motrice a lieu dans les 1 ou 2 jours suivant la disparition de l’oedème, c’est à dire dans la semaine suivant la lésion traumatique. Une compression peut aussi entraîner une démyélinisation locale, ou une rupture de la gaine de myéline. La résolution des signes est alors plus longue, dans les 1 à 2 mois. C’est la paresthésie.
– L’axonotmesis (degré 2) : un écrasement ou une section peuvent provoquer une ischémie sévère, un œdème intrafasciculaire, ou une démyélinisation. La partie distale à la lésion (c’est à dire la portion de l’axone séparée du corps cellulaire) va dégénérer (dégénérescence wallérienne). Mais les gaines de Schwann persistant, il y a une repousse des fibres nerveuses ( Beirowski 2005).
La récupération peut intervenir dans les 2 à 4 mois, mais cela peut prendre jusqu’à 1 an ou plus. Il faut savoir que même s’il y a des signes partiels d’améliorations dans les quelques mois, cela va continuer à s’améliorer. Les signes sont donc d’abord une anesthésie, qui se transforme en paresthésie au fur et à mesure de l’amélioration. (LaBanc 92)
– Le Neurotmesis (degré 3 à 5) correspond à la rupture des différentes structures du tronc nerveux, avec une récupération sensitive et motrice compromise.
- degré 3 : les gaines de Schwann sont rompues. La régénération complète de l’axone est empêchée. Cela entraîne un déficit permanent.
- degré 4 : en plus de la section, il y a formation de fibrose, cicatrice ou neurome qui entrave la régénération.
- degré 5 : section complète des différentes structures nerveuses. Cela entraine une anesthésie complète, avec possibilité de douleurs neuropathiques. La régénération est peu probable.
En odontologie en général, les lésions nerveuses le plus retrouvées sont une compression ou un étirement nerveux (neuropraxie ou degré 1), qui présentera des conséquences transitoires à résolution « rapide ». En implantologie, les lésions sont souvent plus graves :
- Section partielle ou totale causée par un foret et/ou l’implant. Il en résulte une lésion de degré 2 à 5 de Sunderland. Sans surpréparation, il est peu probable que l’implant seul pénètre dans le canal et vienne comprimer le paquet vasculo-nerveux. Cela peut éventuellement arriver en cas d’os peu dense. [27]
- Compression nerveuse par l’implant ou par un hématome. La compression par un implant peut entraîner une paralysie. de plus, la sténose du plexus vasculaire peut entrainer une complication ischémique à distance avec démyélinisation nerveuse, perte de la conduction et possibilité d’apparition de douleurs neuropathiques.
Etiologies
Elles peuvent être d’étiologies multiples, directes ou indirectes, per ou post-opératoire :
- lésion par les forets implantaires
Basa et dilek [28] ont étudié les risques de perforation du canal mandibulaire par les forets implantaires en fonction de la densité et de de l’épaisseur. Ils ont conclu que les densité et épaisseur osseuses autour du canal mandibulaire ne sont pas suffisantes pour résister au forage. Les risques de lésion du NaI peuvent être évités en évaluant la densité autour du canal sur une radiographie, et en évitant toute pression excessive sur le foret à son approche.
- lésion chimique
Une complication opératoire possible peut être le traumatisme chimique direct par le liquide d’irrigation. C’est pourquoi il est fortement déconseillé d’utiliser de l’hypochlorite de sodium. [29]
- lésions thermiques
L’échauffement osseux au forage peut entraîner une nécrose de l’os péri-implantaire et des lésions nerveuses secondaires du NaI. Les tissus nerveux sont plus sensibles à la chaleur que l’os. Une augmentation de la température par une vitesse excessive de forage peut entraîner nécrose, fibrose, ostéolyseet augmentation de l’activité ostéoclasique. L’épaisseur dela zonenécrosée est directement proportionnelle à l’élévationde la température lors de la chirurgie. [30]
« Lors de la pose d’implants à la mandibule, les complications seront principalement de deux ordres : hémorragiqueset/ou nerveuses. »
Eriksson et albrektsson ont défini 47°C comme la température limite avant apparition de nécrose. de plus, l’échauffement osseux à 47°C pendant cinq minutes peutproduire jusqu’à 20 % de résorption. [31] L’importance de l’irrigation est, elle, controversée. Il n’y aurait pas de différence d’efficacité entre une irrigation interne et externe [32]. Et elles ne seraient plus efficaces au-delà de 12 mm de profondeur de forage. [33]
- lésion par l’implant
Elle peut se faire de façon mécanique directement, mais aussi de façon indirecte par une ischémie secondaire (complication traitée dans le chapitre des hémorragies) ou infection implantaire. [34]
La densité osseuse change en fonction des zones mandibulaires. Elle sera moins dense et moins trabéculée en zone postérieure qu’antérieure (Lekholm et Zarb 1985). Si un os est particulièrement peu dense, un implant peut être alors placé plus profondément que prévu. [27] L’implant pourra alors comprimer, déchirer, ou sectionnerle NaI.
Si l’implant est placé dans le canal mandibulaire, la terminaison nerveuse va dégénérer de façon rétrograde dans la plupart des cas, en raison de son faible diamètre. [35] Sammartino et coll. [36] suggèrent une distance de sécuritéde 1,5 mm entre l’apex implantaire et le canal mandibulairepour éviter les contraintes biomécaniques entrainées par les surcharges occlusales.
Un implant placé de façon trop proche du canal mandibulaire peut également envoyer des débris osseux dans le canal mandibulaire, qui pourront créer également une compression un hématome. [29]
Enfin, une infection péri-implantaire post-opératoire peut entrainer des signes neurologiques au niveau du NaI. [37]
Diagnostic et conduite à tenir
Complications hemorragiques
En cas de saignements abondants au niveau de l’alvéole de forage, pouvant indiquer une lésion d’une artériole ou veine alvéolaire inférieure, il est recommandé de ne pas placer l’implant, et d’attendre deux ou trois jours pour être sûr qu’il n’y ait pas de lésion nerveuse. Il est ensuite possible de placer l’implant dans le tissu de granulation. Il n’existe malgré tout pas d’évidence scientifique confirmant cette approche [29]. Cela permettrait malgré tout de limiter les risques de compression nerveuse par l’hématome, et donc les ischémies secondaires.de telles complications sont souvent attribuées à deslésions directes par le forage ou l’implant. Elles sont en fait indirectes, par l’hématome qui se crée au forage. [29] En casde complications hémorragiques plus importantes, extra-osseuses, la conduite à tenir consiste en un contrôle des saignements et la protection des voies aériennes. [18]dans la phase précoce, le saignement est visible dans le plancher. Il faut alors comprimer si possible le site où l’on suspecte la perforation, de façon bi-manuelle, et contrôler la tension du patient.L’injection d’un anesthésique avec vasoconstricteur au niveau de la perforation peut aider. En cas de doute sur le contrôle du saignement, les voies aériennes doivent être sécurisées rapidement, par une prise en charge dans un service d’urgences hospitalières. Une fois le patient intubé, la source hémorragique pourra être localisée.
Si l’hémorragie est sévère, et qu’il est impossible de visualiser la zone lésée, une ligature de l’artère est extrêmement difficile, voire impossible à mettre en place. Si une intervention chirurgicale est nécessaire, l’abord sera extraoral pour effectuer la ligature.
Les artères faciale et sub mentale sont plus faciles d’accès et ligaturées en premier. Mais une telle approche est rarement nécessaire, le patient devant malgré tout rester intubé plusieurs jours.
un traitement antibiotique est nécessaire en cas d’hématome extensif pour éviter une infection, en particulier en cas de communication intra-orale, et une prescription de corticoïdes peut limiter l’oedème. [38] Ces complications restent malgré tout assez rares.
Il faut être aussi informé de la possibilité d’hématomes retardés au niveau du plancher. Les signes seront une protrusion linguale, une hémorragie et/ou une détresse respiratoire.
C’est pour cela qu’il est fortement conseillé d’effectuer un appel post-opératoire après une chirurgie, afin de dépister toute complication à distance de l’intervention. [29]
Lésions nerveuses
En cas de suspicion de lésion nerveuse, le praticien doit être en mesure de la dépister au plus vite, et de diagnostiquer la cause, le type, ainsi que son importance.
Chronologie d’apparition des symptômes
- Pendant la phase opératoire
Une douleur vive ou de type « choc électrique » peut indiquer une perforation du canal mandibulaire par le forage ou l’implant, ou une lésion directe du NaI. [35]Mais ce signe sera masqué en cas d’anesthésie loco-régionale.
- Pendant la phase post-opératoire
Le NaI est contenu dans un canal osseux, ce qui peut entraîner une compression et des complications de type ischémique.
La persistance de signes nerveux périphériques va dépendre de l’intensité de la blessure, et peuvent être de différents types :
« En cas de suspicion de lésion nerveuse, le praticien doit être en mesure de la dépister au plus vite, et de diagnostiquer la cause, le type, ainsi que son importance. »
– une hyperesthésie est souvent associée à une lésion légère. Elles peuvent ne pas être douloureuses au début, mais peuvent se transformer en neuropathies chroniques.
– une lésion plus importante peut entraîner une paresthésie, voire une anesthéise complète, un engourdissement et/ou des douleurs dans la région cutanée du menton, de la lèvre inférieure, des muqueuses, et de la gencive jusqu’enarrière de la deuxième prémolaire. Il peut y avoir aussi une gêne de la parole, en s’alimentant. [39] Le temps écoulé depuis la chirurgie et la proximité de l’atteinte par rapport au corps cellulaire sont des facteurs de mauvais pronostic. [35]
Dépistage
Il est tout d’abord conseillé de contacter le patient après disparition complète de l’anesthésie, en particulier dans les cas mandibulaires postérieurs. Un appel téléphonique 6 heures post-opératoire permet d’être sûr de l’absence de symptomatologie nerveuse. [29]
En cas de suspicion de lésion nerveuse lors de la chirurgie ou du contrôle radiologique : il est conseillé d’administrer du phentolamine (Oraverse®), qui aura pour effet de réduire considérablement la durée d’engourdissement des tissus mous à quelques dizaines de minutes (l’anesthésie de la lèvre et de la langue, et les déficits fonctionnels associés, comme la difficulté à boire ou parler normalement). Cela permettra un diagnostic plus rapide. [40]
Si des signes existent, le praticien repèrera la zone affectée, et pourra la photographier afin de comparer l’évolution dans le temps. Il notera l’intensité et la qualité des sensations neurologiques, afin de déterminer si un chirurgie neuro-reconstructrice est nécessaire [35] : par des tests mécaniques (comme toucher légèrement la zone, le patient ayant les yeux fermés par exemple) ou nociceptifs (thermique, à l’aide d’une aiguille ou d’appareils spécifiques) afin de tester l’intégrité des différentes fibres nerveuses. [41]
Conduite à tenir
La première prise en charge consiste en un traitement anti-inflammatoire (corticoïdes ou anti-inflammatoires non stéroïdiens) afin de diminuer l’inflammation neurale, ainsi que des conseils pour rassurer le patient. [42]
La formation d’un hématome au niveau apical peut aussi entrainer des lésions nerveuses transitoires. Si des signes apparaissent suite à la pose de l’implant, et que l’examen radiologique montre un canal intact ou un apex implantaire
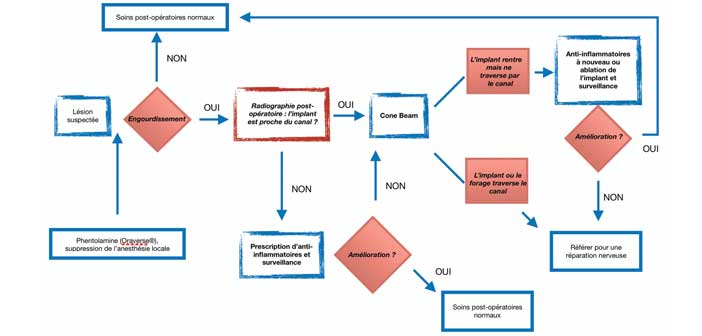
en contact intime avec le bord supérieur, il est recommandé de dévisser légèrement l’implant ou de le retirer, afin de décomprimer le paquet vasculo-nerveux. renton et Yilmaz [43] indiquent que si l’implant n’est pas retiré dans les 30 heures, les lésions sont irréversibles. En cas de section complète, certains auteurs proposent l’injection d’anticorps BdNF (Brain-derived Neurotrophic Factor) ou d’anticorps Sema3a pour faciliter la régénération nerveuse. [44, 45]
Pour le NaI ou le nerf lingual, la microchirurgie peut être une solution : une chirurgie serait conseillée dans les 3 à 6 mois suivant la lésion, et permettrait une résolution des symptômes dans les 2 ans. [46]
De nombreuses autres études confirment ces délais : plus l’intervention est rapide, et plus l’efficacité est importante. Passé 9 mois, il y a une baisse significative du taux de succès. [47]
Certains auteurs proposent également le laser comme traitement (Low Level Laser therapy). Mais les résultats sont encore controversés. [48, 49]
En résumé, Steinberg [40] propose un arbre décisionnel en cas de suspicion de lésion nerveuse.
Bibliographie
- Chavez-Lomeli, M.E., et al., the human mandibular canal arises from three separate canals innervating different tooth groups. J dent res, 1996. 75(8): p. 1540-4.
- Chappard, D., et al., Microcomputed tomography (microCt) and histology of the mandibular canal in human and laboratory animals. Morphologie, 2018. 102(339): p. 263275.
- Costa, E.D., et al., double mandibular canal and triple mental foramina: detection of multiple anatomical variations in a single patient. Gen dent, 2019. 67(5): p. 46-49.
- Ziccardi, v.B. and L.A. Assael, Mechanisms of trigeminal nerve injuries. atlas Oral Maxillofac Surg Clin North am, 2001. 9(2): p. 1-11.
- von Arx, T., [the mental foramen or “the crossroads of the mandible.” an anatomic and clinical observation]. Schweiz Monatsschr Zahnmed, 2013. 123(3): p. 205-25.
- Kieser, J., et al., Patterns of emergence of the human mental nerve. arch Oral Biol, 2002. 47(10): p. 743-7.
- Arzouman, M.J., et al., Observations of the anterior loop of the inferior alveolar canal. Int J Oral Maxillofac Implants, 1993. 8(3): p. 295-300.
- Guo, J.L., et al., Location of mental foramen based on soft- and hard-tissue landmarks in a chinese population. J Craniofac Surg, 2009. 20(6): p. 2235-7.
- Claeys, v. and G. Wackens, Bifid mandibular canal: literature review and case report. dentomaxillofac radiol, 2005. 34(1): p. 55-8.
- Naitoh, M., et al., Observation of bifid mandibular canal using cone-beam computerized tomography. Int J Oral Maxillofac Implants, 2009. 24(1): p. 155-9.
- Haas, L.F., et al., anatomical variations of mandibular canal detected by panoramic radiography and Ct: a systematic review and meta-analysis. Dentomaxillofac radiol, 2016. 45(2): p. 20150310.
- Thomas, A., R. Felizardo, and P. Carpentier, Le canal incisif mandibulaire : risque anatomique ? Étude tomodensitométrique et applications cliniques. Revue d’Odonto Stomatologie, 2012. 41: p. 139-152.
- Romanos, G.E. and G. Greenstein, the incisive canal. Considerations during implant placement: case report and literature review. Int J Oral Maxillofac Implants, 2009. 24(4): p. 740-5.
- Ellies, L.G., altered sensation following mandibular implant surgery: a retrospective study. J Prosthet dent, 1992. 68(4): p. 664-71.
- Wismeijer, D., et al., Patients’ perception of sensory disturbances of the mental nerve before and after implant surgery: a prospective study of 110 patients. Br J Oral Maxillofac Surg, 1997. 35(4): p. 254-9
- Wang,Y.M.,etal.,Evaluationoflocationanddimensionsofmandibularlingualcanals:aconebeamcomputedtomographystudy.IntJOralMaxillofacSurg,2015.44(9):p.1197-2003.
- Ella,B.,etal.,Leprélèvementosseuxsymphysaireetseslimitesanatomiquesvasculaires:lescanauxvasculairesintra-osseux.ActualitésOdonto-Stomatologiques,2010(252):p.385-392.
- Camargo,I.B.andJ.E.VanSickels,Surgicalcomplicationsafterimplantplacement.DentClinNorthAm,2015.59(1):p.57-72
- Dubois,L.,etal.,Excessivebleedinginthefloorofthemouthafterendosseusimplantplacement:areportoftwocases.IntJOralMaxillofacSurg,2010.39(4):p.412-5.
- Woo,B.M.,S.Al-Bustani,andB.A.Ueeck,Floorofmouthhaemorrhageandlife-threateningairwayobstructionduringimmediateimplantplacementintheanteriormandible.IntJOralMaxillofacSurg,2006.35(10):p.961-4.
- Tarakji,B.andM.Z.Nassani,Factorsassociatedwithhematomaofthefloorofthemouthafterplacementofdentalimplants.SaudiDentJ,2012.24(1):p.11-5.
- Burstein,J.,C.Mastin,andB.Le,Avoidinginjurytotheinferioralveolarnervebyroutineuseofintraoperativeradiographsduringimplantplacement.JOralImplantol,2008.34(1):p.34-8
- Kiyak,H.A.,etal.,Psychologicalimpactofosseointegrateddentalimplants.IntJOralMaxillofacImplants,1990.5(1):p.61-9.
- Libersa,P.,M.Savignat,andA.Tonnel,Neurosensorydisturbancesoftheinferioralveolarnerve:aretrospectivestudyofcomplaintsina10-yearperiod.JOralMaxillofacSurg,2007.65(8):p.1486-9.
- Seddon,H.J.,PeripheralNerveInjuries.GlasgowMedJ,1943.139(3):p.61-75.
- Sunderland,S.,Aclassificationofperipheralnerveinjuriesproducinglossoffunction.Brain,1951.74(4):p.491-516.
- Schwarz,M.S.,etal.,Computedtomography:PartI.Preoperativeassessmentofthemandibleforendosseousimplantsurgery.IntJOralMaxillofacImplants,1987.2(3):p.137-41.
- Basa,O.andO.C.Dilek,Assessmentoftheriskofperforationofthemandibularcanalbyimplantdrillusingdensityandthicknessparameters.Gerodontology,2011.28(3):p.213-20.
- Khawaja,N.andT.Renton,Casestudiesonimplantremovalinfluencingtheresolutionofinferioralveolarnerveinjury.BrDentJ,2009.206(7):p.365-70.
- Tehemar,S.H.,Factorsaffectingheatgenerationduringimplantsitepreparation:areviewofbiologicobservationsandfutureconsiderations.IntJOralMaxillofacImplants,1999.14(1):p.127-36.
- Eriksson,A.R.andT.Albrektsson,Temperaturethresholdlevelsforheat-inducedbonetissueinjury:avital-microscopicstudyintherabbit.JProsthetDent,1983.50(1):p.101-7.
- Benington,I.C.,etal.,Thermalchangesobservedatimplantsitesduringinternalandexternalirrigation.ClinOralImplantsRes,2002.13(3):p.293-7.
- Harder,S.,etal.,Influenceofthedrillmaterialandmethodofcoolingonthedevelopmentofintrabonytemperatureduringpreparationofthesiteofanimplant.BrJOralMaxillofacSurg,2013.51(1):p.74-8.
- Nazarian,Y.,E.Eliav,andO.Nahlieli,[Nerveinjuryfollowingimplantplacement:prevention,diagnosisandtreatmentmodalities].RefuatHapehVehashinayim(1993),2003.20(3):p.44-50,101.
- Juodzbalys,G.,H.L.Wang,andG.Sabalys,InjuryoftheInferiorAlveolarNerveduringImplantPlacement:aLiteratureReview.JOralMaxillofacRes,2011.2(1):p.e1.
- Sammartino,G.,etal.,Analysisoftheocclusalstresstransmittedtotheinferioralveolarnervebyanosseointegratedthreadedfixture.JPeriodontol,2008.79(9):p.1735-44.
- Elian,N.,etal.,Unexpectedreturnofsensationfollowing4.5yearsofparesthesia:casereport.ImplantDent,2005.14(4):p.364-7.
- Niamtu,J.,3rd,Near-fatalairwayobstructionafterroutineimplantplacement.OralSurgOralMedOralPatholOralRadiolEndod,2001.92(6):p.597-600.
- Roy,T.S.,A.K.Sarkar,andH.K.Panicker,Variationintheoriginoftheinferioralveolarnerve.ClinAnat,2002.15(2):p.143-7.
- Steinberg,M.J.andP.D.Kelly,Implant-relatednerveinjuries.DentClinNorthAm,2015.59(2):p.357-73.
- Ylikontiola,L.,J.Vesala,andK.Oikarinen,Repeatabilityof5clinicalneurosensorytestsusedinorthognathicsurgery.IntJAdultOrthodonOrthognathSurg,2001.16(1):p.36-46.
- Renton,T.,Oralsurgery:part4.Minimisingandmanagingnerveinjuriesandothercomplications.BrDentJ,2013.215(8):p.393-9.
- Renton,T.andZ.Yilmaz,Managingiatrogenictrigeminalnerveinjury:acaseseriesandreviewoftheliterature.IntJOralMaxillofacSurg,2012.41(5):p.629-37.
- Yoshikawa,H.,etal.,PeripheralBrain-DerivedNeurotrophicFactorModulatesRegenerationFollowingInferiorAlveolarNerveInjuryinRats.JOralFacialPainHeadache,2016.30(4):p.346-354.
- Kanemaru,H.,etal.,Semaphorin3AInhibitsNerveRegenerationDuringEarlyStageafterInferiorAlveolarNerveTransection.SciRep,2019.9(1):p.4245.
- Coulthard,P.,etal.,Interventionsforiatrogenicinferioralveolarandlingualnerveinjury.CochraneDatabaseSystRev,2014(4):p.CD005293.
- Kushnerev,E.andJ.M.Yates,Evidence-basedoutcomesfollowinginferioralveolarandlingualnerveinjuryandrepair:asystematicreview.JOralRehabil,2015.42(10):p.786-802.
- Pol,R.,etal.,EffectsofSuperpulsed,Low-LevelLaserTherapyonNeurosensoryRecoveryoftheInferiorAlveolarNerve.JCraniofacSurg,2016.27(5):p.1215-9.
- Miloro,M.andT.R.Criddle,DoesLow-LevelLaserTherapyAffectRecoveryofLingualandInferiorAlveolarNerveInjuries?JOralMaxillofacSurg,2018.76(12):p.2669-2675.