Au cours de leur pratique quotidienne, les praticiens doivent quelquefois prendre en charge des lésions dont l’étiologie est complexe. C’est le cas lorsque les destructions tissulaires sont dues à la fois à une infection parodontale et pulpaire. Le but de ce court article est de passer en revue les situations cliniques les plus courantes et de décrire les moyens de diagnostic ainsi que les traitements qui en découlent.
Les agents princeps de la très grande majorité des maladies parodontales sont d’origine bactérienne ou peut-être même virale (Socransky et al., 1998) (Contreras et Slots, 2000). Cependant, la nature de la réponse immunitaire à cette infection (i.e. une réaction inflammatoire contrôlée ou chronique) détermine la survenue ou l’absence des pertes d’attache, plus ou moins sévères et plus ou moins généralisées (Genco, 2008) (Dujardin, Charon et Joachim, 2010).
Quel que soit le motif de consultation, un patient peut présenter différents états parodontaux : la santé parodontale, une gingivite à faible ou à haut risque qui peut se transformer en parodontite, une gingivite ulcéro-nécrotique1, une parodontite chronique de l’adulte ou une parodontite agressive (localisée ou généralisée) (Armitage, 1999).
À l’exception des connexions vasculaires et nerveuses entre le tissu pulpaire et le desmodonte à travers le foramen et les canaux latéraux, les tissus parodontaux et pulpaires sains ne sont normalement pas en relation anatomique l’un avec l’autre puisque la présence du cément à la surface de la racine « isole » et « protège » l’endodonte du parodonte (Schroeder, 1988). Dans ce cas, si l’un des deux organes est pathologique, il est possible que l’autre ne soit pas affecté.
En revanche, si des communications anatomiques existent entre l’endodonte et le parodonte, les agents infectieux de l’un peuvent envahir l’autre (Bender, 1972) (Goldberg et al., 1987) (Chapple et Lumley, 1999). C’est le cas lorsque le cément est absent, notamment lorsqu’il a été éliminé par un surfaçage vigoureux (Nyman et al., 1998).
Il semblerait qu’à l’exception des spirochètes, il existe une certaine similitude entre la flore incompatible avec la santé parodontale et celle retrouvée au sein des pulpes infectées
(Baumgartner, 1991) (Sundqvist, 1992) (Rôças et al., 2001) (Harrington, Steiner et Ammons, 2002) (Rotstein et Simon, 2004). C’est la raison pour laquelle, en cas d’infection, il sera nécessaire de traiter – de manière conservatrice ou radicale – les deux organes (pulpaire et parodontal).
Le clinicien doit alors répondre à la question suivante : quelle maladie doit bénéficier prioritairement d’une thérapeutique ?
Il est clair que toutes les décisions d’ordre thérapeutique (extraction, pulpectomie, amputation radiculaire, traitement parodontal, etc.) reposeront sur la qualité et l’exactitude du diagnostic car, comme c’est la règle en médecine, il faut d’abord traiter les causes pour en supprimer les effets.
Il existe d’excellentes revues traitant des lésions endoparodontales (JOE, 2008). Pour notre part, nous avons délibérément choisi d’aborder la problématique « endodonte – parodonte » en décrivant :
- les différentes situations cliniques pulpaires et parodontales les plus fréquemment rencontrées
- les attitudes cliniques possibles (i.e. diagnostic étiologique et traitements)
- l’organe qui peut (ou doit) être traité en priorité.
1. Lésions endodontiques et parodontie
On décrira ici les principales situations cliniques en rapport avec une atteinte pulpaire et l’attitude clinique à adopter lorsqu’il existe des pathologies parodontales.
a. Pulpite
Les pulpites aiguës représentent une des causes principales de consultation en urgence (douleurs spontanées intenses mais mal localisées car irradiantes). Elles peuvent être provoquées principalement par une lésion carieuse profonde, un bruxisme, une fêlure ou une fracture. Si aucun traitement n’est réalisé, cette pulpite aiguë évoluera vers une pulpite chronique avec nécrose.
Par ailleurs, il est possible d’observer des sensibilités dentinaires par exposition des tubuli dentinaires résultant d’un surfaçage radiculaire2 (Fig. 1).
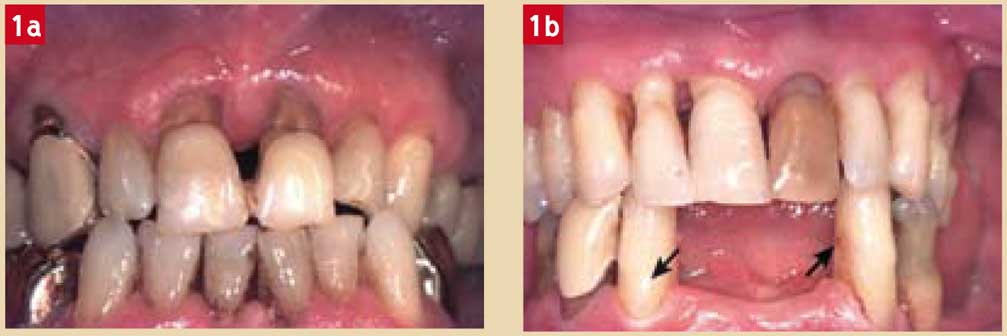
Fig. 1a et 1b : (a) mylolyses (11 et 21) ayant atteint la proximité des tissus pulpaires pouvant entraîner des signes de pulpite ; (b) récessions gingivales associées à des pertes d’attache (flèches) : le surfaçage a mis à nu la dentine entraînant ainsi une sensibilité pulpaire
Attitude clinique
Dans les cas de pulpite irréversible (douleur persistante après une stimulation thermique), le patient est soulagé par la réalisation d’une pulpotomie qui sera suivie plus tard par un traitement endodontique complet (rarement réalisable en urgence).
En cas de sensibilité thermique due à des récessions gingivales, il est possible d’utiliser des vernis dentinaires et/ou des dentifrices adaptés3.
En cas de pertes d’attache de sévérité légère à moyenne, il est souvent possible de conserver la dent. En revanche, si les pertes d’attache sont sévères et que la dent n’est pas fonctionnelle, le pronostic à long terme est réservé.
b. Nécrose pulpaire avec ou sans lésion apicale
La nécrose pulpaire peut être la conséquence d’une pulpite non traitée, d’un traumatisme (surtout pour les dents antérieures) ou d’une contamination endodontique a retro par voie parodontale (plus rare). À ce stade, le réseau canalaire est infecté. Les tests de vitalité (thermiques et/ou électriques) sont alors négatifs.
Les bactéries et toxines présentes dans le réseau canalaire peuvent migrer au niveau du parodonte par la voie foraminale, par les canaux latéraux, voire par les tubuli dentinaires (en l’absence de cément) et engendrer une réaction inflammatoire parodontale (Seltzer et al., 1967) (Hiatt, 1977) (Jansson et al., 1998) (Marton et Kiss, 2000). La dent devient sensible au chaud, à la percussion et à la mastication avec une mobilité importante, surtout en cas de pertes d’attache.
Attitude clinique
Une nécrose pulpaire implique la réalisation d’un traitement endodontique afin d’éliminer tous les agents pathogènes contenus dans le réseau canalaire (rôle de la préparation et de l’irrigation) et de maintenir cet état de désinfection (rôle de l’obturation).
Si le traitement endodontique n’est pas ou incomplètement mené, il y aura alors développement d’une lésion péri-apicale. Il faudra donc envisager un retraitement ou un traitement endodontique a retro si l‘abord orthograde est impossible, voire l’association des deux (Gold et Moskow, 1987).
En présence de nécrose pulpaire, l’extraction d’une partie ou de la totalité de la dent est indiquée si les pertes d’attache sont totales (validées par un cliché radiologique avec un cône de gutta in situ) (Fig. 2). Cependant, la décision d’extraction ne peut se prendre qu’après avoir contrôlé l’infection pulpaire et parodontale.
c. Fractures
Les fractures peuvent concerner uniquement l’organe dentaire ou impliquer les tissus parodontaux par fracture radiculaire ou corono-radiculaire (Bakland et al., 2002).
Le diagnostic des fractures radiculaires se fait par une évaluation de la mobilité (variable en fonction du niveau de la fracture) et par des clichés rétro-alvéolaires sous différentes incidences. En cas de pertes d’attache, il est quelquefois difficile de « faire la part du feu » entre la mobilité due aux pertes d’attache et celle due à la fracture.
Attitude clinique
Fractures coronaires
En cas d’effraction pulpaire, le traitement peut varier du simple coiffage pulpaire à la pulpotomie, voire à un traitement endodontique.
Si les pertes d’attache ne sont pas importantes et que la fracture ne concerne que la partie cervicale de la dent, il est possible d’envisager une chirurgie d’élongation coronaire afin de permettre la réalisation de la restauration dans de bonnes conditions.
Fractures radiculaires
L’attitude clinique face à ce type de fracture dépendra essentiellement du niveau de la fracture. Plus la fracture radiculaire est située coronairement, moins bon sera le pronostic (Fig. 3).
En présence de perte d’attache, il est rare d’observer des fractures radiculaires car la mobilité amortit les forces. Si elles sont présentes, il y a souvent indication d’extraction.
d. Luxations
Lors d’une luxation, il y a un déplacement de la dent provoquant des dommages des tissus parodontaux avec éventuellement une rupture du paquet vasculo-nerveux (Andreasen, 1989).
Attitude clinique
Il faut évaluer (1) le degré de la sévérité et la direction du déplacement par observation clinique et radiographique, (2) la sévérité de la mobilité et (3) l’état de vitalité pulpaire.
En cas de mobilité importante et de pertes d’attache peu sévères, une contention sera réalisée et laissée en place pendant environ 2 semaines. La conservation de la vitalité pulpaire sera dépendante de l’intensité du déplacement ainsi que de sa direction (les intrusions ayant un moins bon pronostic que les extrusions).
Des contrôles réguliers doivent être réalisés afin de surveiller l’état pulpaire et l’apparition d’éventuelles zones de résorption radiculaire. Si les pertes d’attache sont importantes, il y a en général expulsion de la dent concernée (Fig. 4).
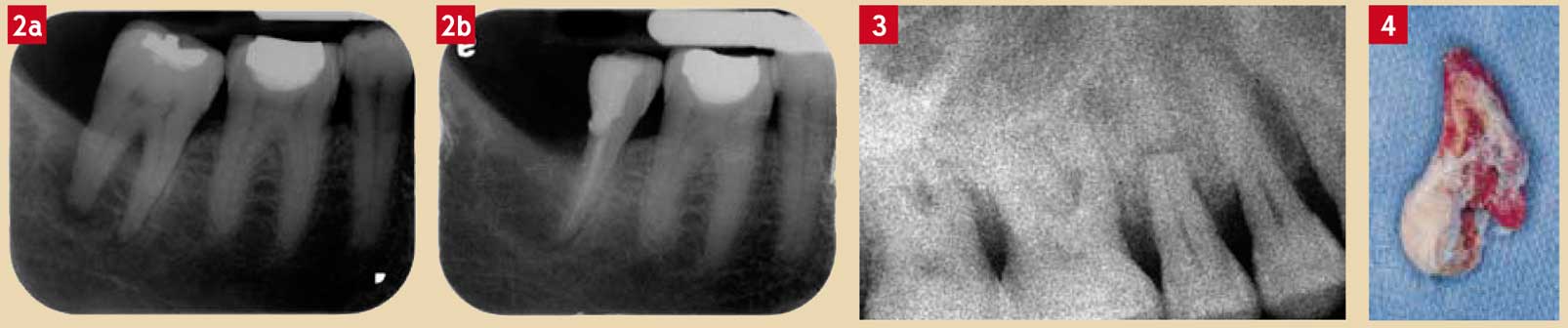
Fig. 2a et 2b : (a) lésion endoparodontale (nécrose pulpaire avec pertes d’attache totale) affectant une 47 et ayant nécessité (b) un traitement endodontique suivi de l’amputation de la racine distale Fig. 3 : fracture radiculaire survenue au tiers apical d’une prémolaire maxillaire ; dans ce cas, en l’absence de signe de pathologie pulpaire et parodontale, une surveillance régulière est nécessaire Fig. 4 : expulsion au cours des soins locaux d’une incisive mandibulaire pour laquelle les pertes d’attache étaient totales
e. Fêlures
Les fêlures radiculaires créent des lésions endodontiques et parodontales par contamination bactérienne qui se propage le long du trait de fêlure (Rotstein et Simon, 2004).
Cliniquement, on observe une lésion parodontale ponctuelle sur une face de la racine avec souvent le même phénomène sur la face opposée mise en évidence par un sondage « à pic ». Le trait de fêlure peut être mis en évidence par l’utilisation de bleu de méthylène et/ou l’observation de la dent en cause avec des aides optiques (microscope opératoire ou loupe).
À l’examen radiologique, on peut fréquemment visualiser une image « en doigt de gant » autour de la racine fêlée.
Attitude clinique
Actuellement, le seul traitement à notre disposition est malheureusement l’extraction (Fig. 5).
f. Résorptions internes
L’étiologie des résorptions internes n’est pas encore complètement élucidée (Heithersay, 1999). Il semblerait qu’elles résultent de processus inflammatoires pulpaires chroniques compliqués par des contaminations bactériennes.
Elles sont habituellement asymptomatiques et généralement découvertes lors de bilans radiologiques de routine. On observe alors sur les clichés une lacune à un niveau quelconque de la racine.
Attitude clinique
La réalisation d’un traitement endodontique adéquat permet généralement de stopper l’évolution de la résorption (Fig. 6).
Si la résorption interne communique avec le ligament avec présence de pertes d’attache, il y a souvent indication d’extraction.
g. Résorptions externes
Il existe différents types de résorptions externes aux étiologies variées, dont la classification a été établie (Magnusson et al., 1985) (Tronstad, 1988) (Heithersay, 1999).
Les résorptions externes les plus courantes concernent les zones apicales ou latéro-radiculaires. Elles sont généralement dues à la présence d’une infection canalaire associée à une lésion péri-apicale. Leur évolution est relativement lente et progressive et n’est donc pas toujours facilement objectivable radiologiquement, surtout à leur début.
Attitude clinique
Un traitement (ou retraitement) endodontique, avec guérison de la lésion péri-apicale secondaire, suffit souvent à stopper l’évolution de la résorption. Cependant, dans les cas de découverte tardive avec destruction tissulaire importante, l’extraction peut être envisagée surtout si les pertes d’attache sont sévères.
Le plus mauvais pronostic dans le traitement des résorptions externes concerne les résorptions cervicales externes. L’étiologie peut être d’origine traumatique ou à la suite d’un traitement d’éclaircissement interne au peroxyde d’hydrogène. Dans certains cas, l’étiologie ne peut pas être définie clairement. La résorption entraîne la destruction du cément, de la dentine et parfois même de l’émail (Fig. 7).
Si la lésion est débutante et d’un abord favorable, on pourra éventuellement tenter un traitement consistant en un curetage soigneux de la zone atteinte par la résorption, une préparation des surfaces à l’acide trichloracétique suivie de l’obturation de la cavité. Cependant, le pronostic est péjoratif lorsque la zone de résorption est importante.
Si la résorption concerne la partie de la racine où il existe encore de l’attache parodontale, l’extraction est à envisager (Fig. 8).
h. Perforations
Les perforations peuvent être consécutives à une préparation canalaire iatrogène ou subvenir pendant la phase de préparation des ancrages radiculaires (Torabinejad et al., 1996). Il en résulte une communication entre l’endodonte et le parodonte.
Le pronostic de ces perforations dépend de plusieurs facteurs comme l’ancienneté de la perforation, son étendue, son niveau plus ou moins apical et la présence d’une infection parodontale en regard de la perforation.
Attitude clinique
Lorsqu’un traitement endodontique de la perforation est possible, il sera mené en ayant soin de réaliser un contrôle de l’infection dans la zone de la perforation avec une obturation de celle-ci au MTA™ (Fig. 9).
Si la perforation a lieu au niveau de l’attache restante, l’extraction est en général indiquée.
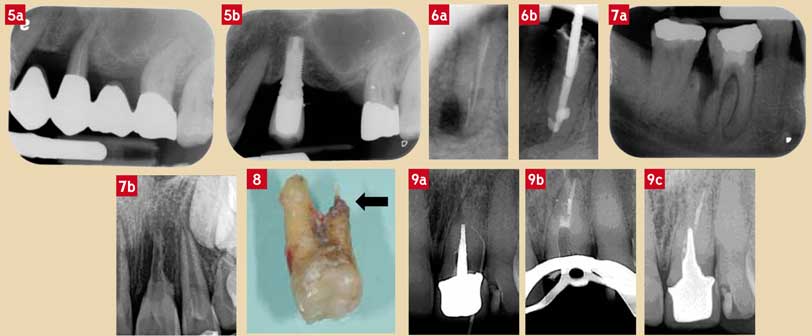
Fig. 5a et 5b : (a) fêlure d’une deuxième prémolaire maxillaire ayant entraîné son extraction puis (b) de la réalisation d’un implant Fig. 6a et 6b : (a) résorption radiculaire interne d’une 35 associée à une résorption latéro-radiculaire externe due à une lésion endodontique péri-apicale et un instrument fracturé (b) : dans ce cas, les pertes d’attache n’étant pas sévères, la dent peut être conservée sur l’arcade après retraitement endodontique Fig. 7a et 7b : (a) résorption radiculaire externe affectant une 46 et justifiable d’une avulsion ; (b) résorption externe consécutive à une expulsion suivie d’une ré-implantation mais sans traitement endodontique ni suivi radiologique (cliché radiologique réalisé 8 mois après ré-implantation) ; à terme, l’extraction est inévitable Fig. 8 : résorption radiculaire externe (flèche) avec pertes d’attache totales ayant entraîné une extraction Fig. 9a, 9b et 9c : (a) perforation vestibulaire d’un tenon radiculaire en l’absence de traitement endodontique ; (b) après dépose de la restauration prothétique, un traitement endodontique a été réalisé avec obturation du canal (gutta) et de la perforation à l’aide de « Mineral Trioxide Aggregate » (MTA™, Maillefer®) ; (c) contrôle à 18 mois montrant la disparition radiologique des deux lésions
2. Maladies parodontales et endodontie
a. Les gingivites
Il existe deux types de gingivites selon qu’elles sont à risque de se transformer en parodontite agressive ou non.
Les signes cliniques sont les mêmes (i.e. présence d’inflammation gingivale en l’absence de pertes d’attache cliniquement et radiologiquement décelables) et ne permettent donc pas de les distinguer (Charon, 2009). Pour faire la différence, il faut tenir compte des principales caractéristiques du risque parodontal : facteurs génétiques (antécédents familiaux avec ou sans polymorphisme du gène codant l’IL-1 ), présence de stress et d’anxiété (dépression), tabagie active, antécédents médicaux évoquant une plus grande fragilité face aux infections systémiques (infections herpétiques, SIDA, VIH positif, hyperglycémie chronique, immunodépressions, grossesse, maladies hématologiques, obésité, dys-lipidémies, etc.).
Attitude clinique
En présence d’une gingivite à risque parodontal avéré, il est impératif que la flore buccale soit rendue compatible avec la santé parodontale à l’aide de soins locaux adaptés (antiseptiques tels que la chlorhexidine, le peroxyde d’hydrogène, les sels inorganiques, etc.) afin de supprimer toute source de contamination pendant et après les traitements endodontiques (Charon, 2009). D’autre part, la suppression de l’inflammation gingivale permet de réaliser les soins endodontiques dans des conditions adéquates (Fig. 10).
En présence de gingivites, les lésions endodontiques et l’inflammation gingivale pourront être prises en charge dans le même temps thérapeutique.
b. La parodontite chronique de l’adulte
La parodontite chronique de l’adulte est une pathologie courante (80 % des parodontites), évoluant lentement sur des dizaines d’années, souvent peu ou pas symptomatique (au moins à son début) (Charon, 2009). Ce sont des patients en général âgés de plus de 40 ans pour lesquels le diagnostic est souvent posé fortuitement au décours des soins dentaires4. Chez ces patients non traités, on retrouve souvent une flore sous-gingivale non compatible avec la santé parodontale mais peu agressive. Par ailleurs, les patients ne présentent en général pas d’antécédent médical pertinent. Enfin et de manière caractéristique, à quantité de plaque supra-gingivale et d’inflammation gingivale égale, les pertes d’attache sont localisées aux sites où il existe des soins et/ou de la prothèse (Fig. 11).
Pour ce type de parodontite, il est possible de faire le choix d’un traitement parodontal « conventionnel » (i.e. hygiène dentaire, détartrage, surfaçage, mise à plat des poches parodontales à l’aide de chirurgies à lambeau).
Le risque de récidive est faible dès lors que les conditions de santé systémique ne changent pas et que le contrôle de plaque reste adéquat.
Attitude clinique
Dans ce type de parodontite chronique, il est très fréquent qu’il y ait de très nombreux soins et/ou prothèses, avec ou sans présence de lésion endodontique.
Les pathologies pulpaires peuvent être prises en charge rapidement malgré la présence d’une infection parodontale, somme toute banale. Cependant, l’instauration d’un contrôle de plaque rigoureux est – et reste – requis.
c. Les parodontites agressives
Les parodontites agressives (anciennement appelées « parodontite à progression rapide » ou « à début précoce ») s’observent chez de jeunes adultes (de 25 à 35 ans) pour lesquels on retrouve souvent des facteurs de risque parodontal majeurs (antécédents familiaux de parodontite sévère, Génotype IL-1 positif, tabagie, stress, diabète non contrôlé, etc.). Les pertes d’attache peuvent être de sévérité inégale, mais toujours généralisées (Fig. 12).
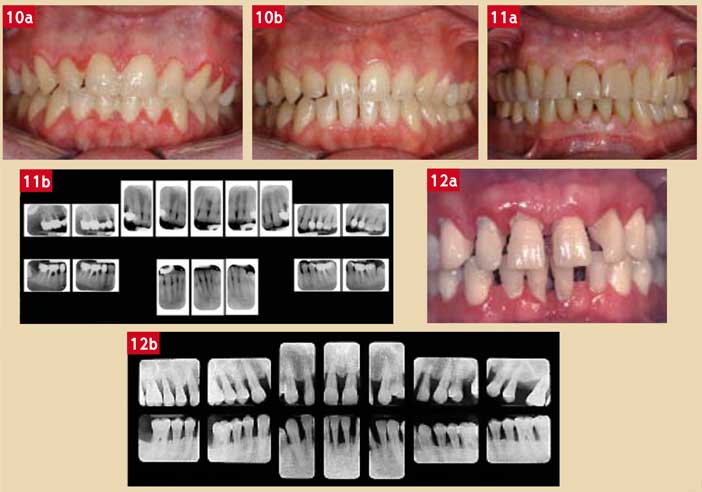
Fig. 10a et 10b : (a) cas d’une gingivite généralisée à faible risque parodontal chez un jeune homme de 30 ans interdisant la réalisation de soins dans de bonnes conditions ; (b) après résolution de l’inflammation à l’aide de soins locaux, les soins dentaires peuvent être réalisés Fig. 11a et 11b : cas d’une parodontite chronique de l’adulte ; chez ce patient de 60 ans, on observe que les lésions sont survenues aux sites où existent des restaurations prothétiques Fig. 12a et 12b : cas d’une patiente de 30 ans où les lésions parodontales sont généralisées en l’absence quasi totale de carie ; en cas de lésions pulpaires, le traitement endodontique ne pourra être réalisé qu’après mise au repos de la pathologie parodontale par un traitement anti-infectieux adapté
Au contraire des parodontites chroniques de l’adulte, la symptomatologie est riche, surtout lors des poussées actives (saignement, mobilité, migration, sensibilité au froid, halitose, tassements alimentaires, suppuration, récession gingivale). Certains de ces symptômes d’origine parodontale (suppurations, abcès, mobilité) peuvent être confondus ou partagés avec ceux des pathologies pulpaires rendant ainsi le diagnostic relativement difficile. Dans ce cas, les tests de vitalité pulpaire prennent ici toute leur importance. Il est possible d’utiliser la microscopie pour distinguer les exsudats d’origine endodontique de ceux d’origine parodontale (Trope et al., 1988).
En cas de pertes d’attache sévères et afin de déterminer la réelle position de l’attache épithélio-conjonctive et/ou si les lésions parodontale et endodontique communiquent entre elles, il est fortement conseillé de réaliser un ou plusieurs cliché(s) rétro-alvéolaire(s) en présence d’un ou plusieurs cônes de gutta au sein de la lésion (Fig. 13). Avec cette technique, on est quelquefois surpris de constater que la destruction des tissus parodontaux (dont l’os parodontal) est moins importante que ne le laissait penser l’image radiologique (Charon, 2009).
D’autre part, s’il existe une fistule (ce qui est relativement rare dans les lésions parodontales pures), son trajet et son origine seront déterminés de la même façon (Fig. 14). Au total, les éléments cliniques et radiologiques mènent souvent au diagnostic étiologique.
Enfin, dans certaines circonstances médicales (i.e. hyperglycémie non contrôlée, immunodépression, maladies cardiovasculaires, etc.), il est prudent de faire réaliser des examens biologiques et de se mettre en rapport avec le médecin interniste pour éviter que l’infection et son traitement ne mettent en danger la santé générale du patient. Dans de tels cas, il est quelquefois nécessaire d’avoir recours aux antibiotiques et de retarder les soins endodontiques.
Pour les parodontites agressives localisées (anciennement appelées « parodontites juvéniles localisées »), les lésions sont souvent limitées aux incisives et aux premières molaires (Fig. 15). Il s’agit d’une maladie relativement rare survenant chez des adolescents. Dans ce type de pathologie, on retrouve souvent des antécédents familiaux de parodontites sévères.
D’autre part, lors des survenues d’épisodes d’infection parodontale aiguë, les symptômes peuvent évoquer des maladies pulpaires (notamment en présence d’abcès). Dans le cas de lésions terminales, on peut observer des pulpites a retro par propagation des agents infectieux via le foramen apical (Jansson et al., 1995).
Les parodontites agressives sont, hélas, trop souvent traitées de manière inadéquate par des soins locaux non adaptés5 avec détartrage et surfaçage vigoureux (Charon, 2009). Ces patients ne peuvent pas justifier d’un traitement parodontal « conventionnel ». Il faut avoir recours aux antiseptiques adaptés afin de contrôler la plaque supra et sous-gingivale. D’autre part, si le cément est éliminé par surfaçage, il est possible d’observer des lésions pulpaires par pénétration des agents infectieux à travers les tubuli dentinaires (Adriaens et al., 1988) (De Deus, 1975) (Kirkham, 1975). Ceci est d’autant plus vrai lorsque les pertes d’attache sont quasi totales (Kobayashi et al., 1990).
Attitude clinique
En dehors des situations d’urgence (douleurs, signes généraux), les lésions endodontiques ne pourront être traitées avec succès que lorsqu’un traitement parodontal actif adapté sera terminé ou, à tout le moins, lorsque l’infection parodontale sera sous contrôle (Fig. 16).
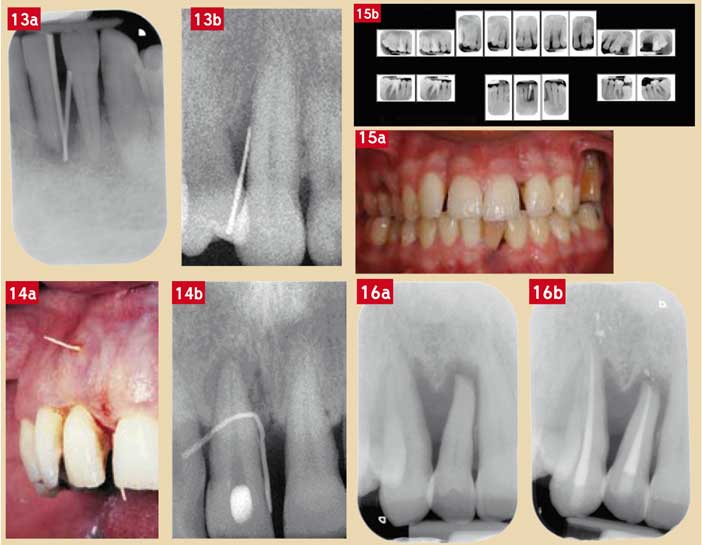
Fig. 13a et 13b : mise en place de cônes de gutta au sein de la lésion endoparodontale ; (a) pertes d’attache totales avec lésion pulpaire (nécrose) ; (b) le cône de gutta indique qu’il n’y a pas de perte d’attache apicalement au cône de gutta Fig. 14a et 14b : communication entre une lésion parodontale et endodontique mise en évidence par l’insertion d’un cône de gutta dans la lésion parodontale et émergeant dans la fistule vestibulaire Fig. 15a et 15b : chez ce jeune homme de 19 ans, les abcès parodontaux récurrents sur les molaires ont été traités (à tort) par pulpectomies ; cependant, l’absence de prise en charge de la pathologie parodontale a eu pour conséquences des extractions et la récidive des abcès sans cicatrisation des lésions parodontales Fig. 16a et 16b : parodontite agressive généralisée qui était sous contrôle après un traitement parodontal actif chez cet homme de 52 ans ; cependant, (a) deux nécroses pulpaires (13/12) avec résorption radiculaire apicale (12) sont survenues brutalement (présence d’un stress psychologique majeur) ; ces lésions ont justifié d’un traitement endodontique adéquat (Dr Olivier Lerouge, Lille) ; (b) les dents très mobiles en phase aiguë endodontique sont devenues fonctionnelles avec une amélioration radiologique un mois après prise en charge des nécroses pulpaires
En effet, si les traitements endodontiques sont réalisés dans une bouche au parodonte infecté, non seulement le praticien travaillera dans des conditions défavorables, mais exposera le patient à des récidives parodontales et endodontiques à plus ou moins long terme.
Conclusions
Quelles que soient la chronologie et les relations anatomiques que peuvent entretenir des lésions endodontiques et parodontales, ce qui peut être discriminant du point de vue pratique est la présence de l’une des maladies parodontales actives.
Dans ce cas, s’il existe une atteinte pulpaire avérée, l’endodonte doit, bien entendu, être traité. Cependant, lorsqu’il existe une parodontite agressive évolutive, le traitement parodontal est un prérequis avant la prise en charge de l’atteinte pulpaire. En revanche, s’il s’agit d’une parodontite chronique de l’adulte ou d’une gingivite à faible risque parodontal, le traitement des lésions endodontiques peut être entrepris d’emblée (Tableau 1).
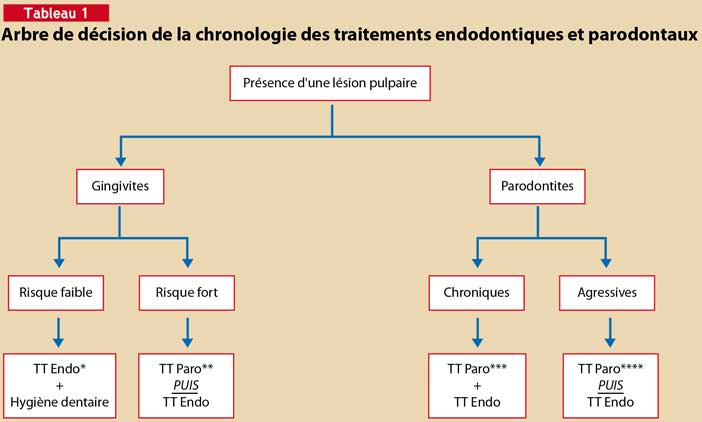
En cas de lésion pulpaire, le traitement endodontique peut-être entrepris d’emblée dans le cas de gingivite à risque faible (l’hygiène dentaire dans ce cas suffit à résoudre l’inflammation gingivale) ou de parondontite chronique de l’adulte (un traitement conventionnel peut suffire). En revanche, un traitement parodontal (utilisation d’antiseptiques avec ou sans recours aux antibiotiques) doit précéder les soins endodontiques dans le cas de gingivite à fort risque parodontal ou de parodontite agressive.
* Traitement endodontique ** Traitement parodontal soins locaux avec antiseptiques *** Traitement parodontal conventionnel (hygiène, détartrage, surfaçage, chirurgies)
**** Traitement parodontal médical (soins locaux avec antiseptiques avec ou sans antibiotique, lithotritie)
Remerciements
Les auteurs tiennent à remercier vivement Kim et Alizée BOURBON ainsi que le docteur Serge BAL pour leur aide précieuse au cours de la rédaction du manuscrit.
Bibliographie
1. Adriaens P., Edwards C.A., De Boever J.A. et Loesche W.J. – Ultrastructural observations on bacterial invasion in cementum et radicular dentin of periodontally diseased human teeth. J Periodontol 59 : 493 – 503, 1988.
2. Andreasen F.M. – Pulpal healing after luxation injuries and root fracture in the permanent dentition. Endod Dent Traumatol 5 : 111 – 133, 1989.
3. Armitage G.C. – Development of a classification system for periodontal diseases and conditions. Annals of Periodontol 41 : 1 – 6, 1999.
4. Bakland L.K., Andreasen F.M. et Andreasen J.O. – Management of traumatized teeth. In Walton R.E. Torabinejad M. Editors. Principles and practice of endodontics. 3rd Philadelphia : W.B. Saunders Co. Pages 445 – 465, 2002.
5. Baumgartner J.C. – Microbiologic and pathologic aspects of endodontics. Curr Opin Dent. 1 (6) : 737 – 743, 1991.
6. Bender I.B. – The effect of periodontal disease on the pulp. Oral Surg Oral Med Oral Path 33 : 468 – 474, 1972.
7. Chapple I. et Lumley P. – The periodontal-endodontic interface. Dent Update 26 : 331 – 334,1999.
8. Charon J. – Parodontie Médicale, Innovations cliniques. Seconde édition. CDP éditions, Paris, 2009.
9. Contreras A. et Slots J. – Herpes virus in human periodontal disease. J Periodont Res 35 : 3 – 16, 2000.
10. De Deus Q.D. – Frequency, location and direction of the lateral, secondary and accessory canals. J Endod 1 : 361 – 366, 1975.
11. Dujardin S., Charon J. et Joachim F. – Données récentes sur la réaction inflammatoire. Le Fil Dentaire 56 : 56 – 62, 2010.
12. Genco R.J. – Clinical innovations in managing inflammation and periodontal diseases : The Workshop on inflammation and periodontal diseases. J Periodontol 79 (8) : 1609 – 1611, 2008.
13. Gold S.I. et Moskow B.S. – Periodontal repair of periapical lesions : the borderland between pulpal and periodontal disease. J Clin Periodontol 14 : 251 – 256, 1987.
14. Goldberg F., Massone E.J., Soares I. et Bittencourt A.Z. – Anatomical relationship between the chamber floor and the furcation. J Endod 13 : 176 – 181, 1987.
15. Goldman M., Pearson A.H. et Darzenta N. – Reliability of radiographic interpretation. Oral Surg Oral Med Oral Path 38 : 287 – 293, 1974.
16. Harrington G.W., Steiner D.R. et Ammons W.F. – The periodontal-endodontic controversy. Periodontol 2000 30 :123 – 130, 2002.
17. Heithersay G.S. – Clinical, radiologic, and histopathologic features of invasive cervical resorption. Quintesscence Int 30 : 27 – 37, 1999.
18. Hiatt W.H. – Pulpal periodontal disease. J Periodontol. 48 (9) : 598 – 609, 1977.
19. Jansson L.E. et Ehnevid H. – The influence of endodontic infection on periodontal status in mandibular molars. J Periodontol. 69 (12) : 1392 – 1396,1998.
20. Jansson L., Ehnevid H., Lindskog S. et Blomlöf L. – The influence of endodontic infection on progression of marginal bone loss in periodontitis. J Clin Periodontol. 22 (10) : 729 – 734, 1995.
21. JOE Editorial Board. – Endodontic – Periodontal Interrelationships : An Online Study Guide – J Endod. 34 (5) Supplément : 71- 77, 2008
22. Jung I.Y., Choi B.K., Kum K.Y., Roh B.D., Lee S.J., Lee C.Y. et Park D.S. – Molecular epidemiology and association of putative pathogens in root canal infection. J Endod. 26 (10) : 599 – 604, 2000.
23. Kirkham D.B. – The location and incidence of accessory pulpal canal in periodontal pockets. J Am Dent Assoc 91 : 353 – 356, 1975.
24. Kobayashi T., Hayashi A., Yoshikawa R., Okuda K. et Hara K. – The microbial flora from root canals and periodontal pockets of non-vital teeth associated with advanced periodontitis. Int Endod J. 23 (2) : 100 – 106, 1990.
25. Magnusson I., Claffey N., Bogle G., Garrett S. et Egelberg J. – Root resorption following periodontal flap procedure in monkeys. J Periodont Res 20 : 79 – 85, 1985.
26. Marton I.J. et Kiss C. – Protective and destructive immune reactions in apical periodontitis. Oral Microbiol Immunol 15 : 139 – 150, 2000.
27. Molander A., Reit C., Dahlen G. et Kvist T. – Microbiological status of root filled teeth with apical periodontitis. Int Endod J 31 : 1 – 7, 1998.
28. Nyman S., Westfelt E., Sarhed G. et Karring T. – Role of diseased root cementum in healing following treatment of periodontal disease. J Clin Periodontol 15 : 464 – 468, 1998.
29. Rôças I.N., Siqueira J.F. Jr, Santos K.R. et Coelho A.M. – «Red complex» (Bacteroides forsythus, Porphyromonas gingivalis, and Treponema denticola) in endodontic infections : a molecular approach. Oral Surg Oral Med Oral Pathol Oral Radiol Endod. 91 (4) : 468 – 471, 2001.
30. Rotstein I. et Simon J.H.S. – Diagnosis, prognosis and decision-making in the treatment of combined periodontal-endodontic lesions. Periodontol 2000 34 : 165 – 203, 2004.
31. Schoeder H.E. – Cemento-enamel junction – Revisited. J Periodont Res 23 : 53 – 59, 1988.
32. Seltzer S., Bender I.B. et Turkenkoff S. – Factors affecting successful repair after root canal therapy. J Am Dent Assoc. 67 : 651 – 662, 1963.
33. Seltzer S., Bender I.B., Nazimov H. et Sinaï I. – Pulpitis-induced interradicular periodontal changes in experimental animals. J. Periodontol 38 : 124 – 129, 1967.
34. Simon J.H., Glick D.H. et Frank A.L. – The relationship of endodontic-periodontic lesions. J Periodontol. 43 (4) : 202 – 208, 1972.
35. Socransky S.S., Haffajee A.D., Cugini M.A., Smith C. et Kent R.L. – Microbial complexes in subgingival plaque. J Clin Periodontol 25 : 134 – 144, 1998.
36. Sundqvist G. – Ecology of the root canal flora. J Endod.18 (9) : 427 – 430, 1992.
37. Torabinejad M. et Lemon R.L. – Procedural accidents. In Walton R.E. Torabinejad M. Editors. Principles and practice of endodontics. 2nd Philadelphia : W.B. Saunders Co. Pages 306 – 323, 1996.
38. Tronstad L. – Root resorption – Etiology, terminology and clinical manifestations. Endod Dent Traumatol 4 : 241 – 252, 1988
39. Trope M., Tronstad L., Rosenberg E.S. et Listgarten M.A. – Darkfield microscopy as a diagnostic aid in differentiating exudates from endodontic and periodontal abscesses. J Endod.14 (1) : 35 – 38, 1988.




