Les maladies parodontales sont des maladies infectieuses à étiologie bactérienne et à manifestations inflammatoires. Elles font partie de la famille des maladies infectieuses liées à un déséquilibre de flore. Les parodontites sont étroitement associées aux modifications de l’écosystème bactérien buccal. Son déséquilibre est à l’origine de différentes formes de gingivites et de parodontites.
L’apport exogène de bactéries peut être parfois à l’origine de certaines formes de parodontites. Une parfaite compréhension de ces maladies nécessite quelques rappels bactériologiques de la flore buccale.
La flore buccale
Les bactéries de la flore buccale sont classiquement classées en deux grands groupes en fonction de la structure de leurs parois : bactéries à Gram positif et bactéries à Gram négatif. Les bactéries à Gram positif sont les plus nombreuses dans la flore d’un sujet sain. À l’inverse, les bactéries à Gram négatif sont les plus importantes quantitativement et qualitativement chez les sujets atteints de maladies parodontales (Fig. 1).
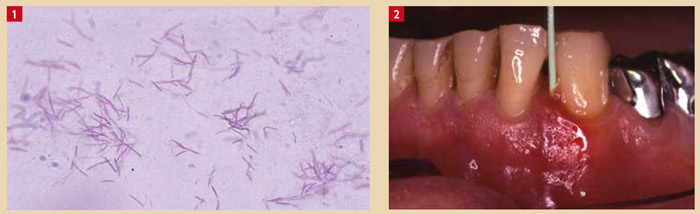
Les bactéries à Gram négatif sont principalement localisées dans le sillon gingival où la modification pathologique de ce site constitue la poche parodontale. La plupart des bactéries à Gram négatif, anaérobies stricts, non mobiles font partie de la famille des Bacteroïdaceae. Cette famille comprend les genres Bacteroides, Fusobacterium, Porphyromonas, Prevotella. Les principaux Gram négatif, mobiles, sont représentés par les genres Selenomonas, Centipeda et Campylobacter. Certaines autres bactéries, bacilles à Gram négatif peuvent cohabiter avec les bactéries à métabolisme anaérobie strict mais possèdent un métabolisme respiratoire capnophile donc plus tolérant à l’oxygène. Les principaux genres correspondants sont: Aggregatibacter (ancien Actinobacillus), Capnocytophaga, Cardiobacterium, Eikenella, Haemophilus. Des cocci à Gram négatif seront aussi retrouvés de façon habituelle dans la cavité buccale : Neisseria et Veillonella.
Les maladies parodontales
Les parodontites sont des pathologies qui atteignent les tissus de soutien et de revêtement de la dent (desmodonte, gencive, cément, os alvéolaire). Elles constituent la principale cause de perte de dents chez l’adulte.
Le développement important de la microbiologie parodontale au cours de ces dernières années découle directement du concept de spécificité bactérienne. L’ensemble des études menées à partir de ce concept a permis de démontrer que les maladies parodontales sont des pathologies infectieuses. Chaque type de pathologie parodontale présente une flore sous-gingivale constituée d’une association de microorganismes qui lui est propre. Ce concept de spécificité bactérienne n’a pu être mis en évidence que grâce aux progrès des techniques de cultures anaérobies et à la mise au point de nouveaux milieux de cultures sélectifs (Sixou et al., 1991).
La plupart des microorganismes intervenant dans ces pathologies sont des bacilles à Gram négatif, anaérobies stricts (Porphyromonas gingivalis, Prevotella intermedia, Tanarella forsythia, Fusobacterium nucleatum, Campylobacter rectus, Treponema denticola) ou capnophiles (Aggregatibacter actinomycetemcomitans, Eikenella corrodens, Capnocytophaga ochracea). Les difficultés d’isolement et d’identification de ces microorganismes expliquent pourquoi la plupart des laboratoires d’analyses médicales ne pratiquent pas la recherche de ces pathogènes parodontaux. Cependant, les travaux de différentes équipes de recherche ont permis de définir les associations bactériennes spécifiques identifiées dans les différentes formes de pathologies parodontales (1).
Intérêt des examens de laboratoire pour le parodontiste
Le clinicien confronté aux multiples formes cliniques de maladies parodontales pourra faire appel aux examens de laboratoire pour l’aider dans sa démarche de thérapeute (12 ; 13) (Fig. 2). Deux grandes catégories d’examens de laboratoire sont à sa disposition : la culture bactérienne et les techniques moléculaires.
Des renseignements à cinq niveaux différents pourront être recueillis à partir de ces examens biologiques et en fonction du choix de la technique d’examen : une aide au diagnostic, au pronostic, un contrôle de l’efficacité du traitement, l’indication d’une antibiothérapie et le choix de la ou des molécules les plus appropriées (uniquement par culture).
Diagnostic
Un nombre important de micro-organismes participe à l’étiologie des maladies parodontales. La sélection d’un traitement et le pronostic seront différents en fonction des bactéries pathogènes identifiées. La première étape consistera à déterminer quels sont les pathogènes spécifiques qui infectent les sites parodontaux d’un patient. Les prélèvements pourront provenir d’un seul site ou d’une série de sites d’un même patient, ce qui permettra une meilleure évaluation de la flore parodontale sous-gingivale.
Les examens de laboratoire moléculaires peuvent ou non utiliser une méthode d’amplification du matériel génétique développée en 1983 appelée PCR (Polymerase Chain Reaction). Le concept de la PCR a été fortement optimisé en 1993 par le développement d’une nouvelle technique appelée PCR Real Time. Cette nouvelle approche présente comme avantages une automatisation de la méthode, une rapidité importante, une quantification avec un seuil de sensibilité abaissé et un coût inférieur aux autres approches. Ces tests sont commercialisés par plusieurs laboratoires comme GABA® ou Pierre Fabre. Il constitue aujourd’hui un des meilleurs choix pour le clinicien lorsqu’un examen de laboratoire est requis. Cet examen présente cependant un inconvénient important comparativement à la culture : la réalisation d’un test de sensibilité aux antibiotiques est impossible.
Pronostic
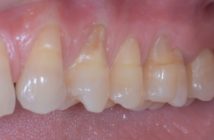
La présence de certains pathogènes permet d’apprécier le potentiel évolutif de lésions parodontales (P. gingivalis). L’association de certaines souches entre elles peut potentialiser leur virulence (A. actinomycetemcomitans, P. gingivalis, P. intermedia) et accélérer le processus de destruction des tissus parodontaux (Fig. 3). La titration des principales bactéries pathogènes parodontales apporte également des informations supplémentaires afin d’aider le clinicien à apprécier l’évolution d’une pathologie parodontale.
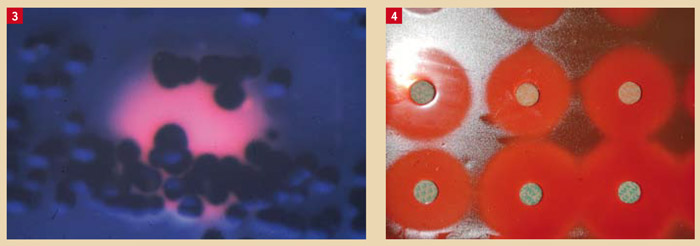
Contrôle d’un traitement
En toute rigueur, l’efficacité d’un traitement parodontal se traduit par la disparition de la symptomatologie clinique et par la disparition des principaux pathogènes impliqués dans cette pathologie. Si, à la suite d’un traitement initial (soins locaux prescrits au patient, détartrage, surfaçage, curetage), des phénomènes inflammatoires persistent dans certains sites et que des pathogènes parodontaux spécifiques sont présents, le traitement devra être repris afin d’obtenir la disparition des signes cliniques et des pathogènes impliqués.
Indication d’une antibiothérapie
La nature des microorganismes isolés peut aider le thérapeute à poser l’indication d’antibiothérapie (Lakhssassi et al., 2005). Par exemple, dans la situation d’une parodontite agressive localisée, l’éradication d’A. actinomycetemcomitans nécessitera de compléter le traitement mécanique, chirurgical, par une antibiothérapie par voie générale. L’absence de recours à une antibiothérapie dans cette situation se traduira dans le meilleur des cas, par une réduction du nombre d’A. actinomycetemcomitans. A l’inverse, dans une situation de parodontite chronique de l’adulte et en présence d’une flore sous-gingivale à virulence modérée (Eikenella corrodens, Capnocytophaga ochracea,…), une antibiothérapie ne sera pas nécessaire. Un traitement associant des phases de détartrage, surfaçage et curetage à des antiseptiques locaux et un contrôle de plaque de qualité peut apporter d’excellents résultats.
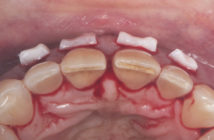
Détermination de l’antibiogramme
L’antibiogramme est une technique classiquement utilisée en bactériologie médicale afin de déterminer la sensibilité bactérienne à différentes molécules antibiotiques (3) (Sixou et al., 1993) (Lakhssassi et al., 2005) (Fig. 4). Cette méthode permet également de contrôler immédiatement la présence d’un mutant ou d’une résistance inductible, ou d’apprécier l’intérêt d’une association de deux antibiotiques. Les résultats de cet examen appliqués aux bactéries anaérobies et capnophiles de la cavité buccale apportent des informations importantes au clinicien afin qu’il puisse choisir l’antibiotique ou l’association de molécules antibiotiques la plus appropriée.
Conclusions
Le milieu buccal est un milieu complexe dans lequel cohabite un grand nombre de micro-organismes. L’état de santé parodontale est un équilibre fragile entre l’agressivité de cet écosystème et la réponse de l’hôte (2 ; 7). Toute perturbation de cet équilibre engendrera l’apparition de manifestations cliniques infectieuses et inflammatoires de type gingivite ou parodontite (14). Une meilleure connaissance de cet écosystème et de ses perturbations devrait permettre la mise en place de meilleures stratégies thérapeutiques et de tests diagnostic et pronostic.
Bibliographie
1. DiRienzo J.M., Slots J., Sixou M., Sol M.A., Harmon R., McKay T. Specific genetic variants of Actinobacillus actinomycetemcomitans correlate with localized juvenile periodontitis. Infection and Immunity 62 (8) : 3058 – 3065,1994
2. Gainet J., Dang P.M.C., Chollet-Martin S., Brion M., Sixou M., Hakim J., Gougerot-Placiet Elbim C. Neutrophil dysfunctions, Il8, and soluble L-selectine plasma levels in rapidly progressive versus adult and localized juvenile periodontitis : variations according to disease severity and microbial flora. Journal of Immunology : 5013 – 5019, 1999
3. Kamagate A., Kone D., Coulibaly N.T., Sixou M. et al. A comparative study of various evaluation methods of the antibiotic sensitivity of strict anaerobiec bacteria of the subgingival flora. Odontostomatologie Tropical, 24, 95, 9 -12, 2001
4. Lakhssassi N., Elhajoui N., Lodter J.P., Pineill J.L., Sixou M. ntimicrobial susceptibility variation of 50 anaerobic periopathogens in agressive periodontitis. An interindividual variability study. Oral Microbiology and Immunology 20 : 244 – 252, 2005
5. Lakhssassi N., Sixou M. Efficacy variation of erythromycin and spiramycin on periopathogens in aggressive periodontitis. An in vitro comparative study. Pathologie Biologie 53 : 527 – 535, 2005
6. Lakhssassi N., Reboul O., Elhajoui N., Sixou M. Antimicrobial susceptibility variation of 50 anaerobic periopathogens in aggressive periodontitis. An interindividual variability stydy. Oral Microbiology and Immunology. 20 : 244-252, 2005
7. Plombas M., Gobert B., March A.K., Sarda M.N., Sixou M., Bene M.C., Miller N., ure G.C. Isotypic antibody response to plaque anaerobes in periodontal disease. Journal of Peridontology 12 : 1507 – 1511, 2002
8. Sixou M., Duffaut-Lagarrigue D., Lodter J.P. A comparison between 4 subgingival bacteriologic sampling technics. Journal de Biologie Buccale, France, 19 (1) : 16 – 21, 1991a
9. Sixou M., Duffaut-Lagarrigue D., Lodter J.P. The transmission of Actinobacillus actinomycetemcomitans between spouses. Journal de Biologie Buccale, France, 19 (2) : 161 – 166,1991b
10. Sixou M., Duffaut-Lagarrigue D., Lodter J.P. The distribution and prevalence of Haemophilus actinomycetemcomitans in the oral cavity. Journal de Biologie Buccale, France, 19 (3) : 221 – 228,1991c
11. Sixou M., Kone D., Duffaut-Lagarrigue D., Lodter J.P., Berdoulat C. Etude in vitro de la sensibilité aux antibiotiques des principales bactéries impliquées dans l’étiologie des parodontites chez l’homme. Journal de Parodontologie 257 – 263, 1993.
12. Sixou M. Diagnostic testing as a supportive measure of treatment strategy. Oral disease 9 : 54 – 62, 2002
13. Verner C., Lemaitre P., Daniel A., Giumelli B., Lakhssassi N., Sixou M. Carpagen Real-time PCR versus anaerobic culture for periodontal pathogen identification. Oral Microbiology and Immunology 21 : 341 – 346, 2006
14. Vergnes J.N. and Sixou M. Preterm low birth weight and maternal periodontal status : a meta-analysis. American Journal of Obstetrics and Gynecology. February, 2007.



2 commentaires
Excellente synthèse presque compréhensible par certains de nos patients demandeurs de plus de renseignements avec mon explication de texte ! Bravo et merci pour cette mise en ligne!
Dr Sylvie HARTMANN-FROSSARD Grenoble Omnipraticienne orientation paro/implanto.
Synthèse intéressante , mais la nouvelle classification des maladies parodontales ( dite “de CHICAGO ” ) est passée par là , l’ examen bactériologique n’est plus une aide au diagnostic . Par contre , l’établissement du pronostic , le contrôle de l’ efficacité du traitement et l’ indication d’une antibiothérapie sont toujours améliorés grâce à la microbiologie . Evidemment , les paro-pathogènes étant quasiment ” incultivables ” en pratique , il faut bien admettre que la biologie moléculaire est devenue le gold-standard actuel en parodontie . Et donc , pour le choix de la molécule antibiotique , le sens clinique du praticien demeure un atout majeur .
Dr. SANCHEZ Michel . Parodontiste exclusif à CARVIN .