Les études cliniques montrent que le traitement des parodontites par une thérapeutique mécanique, c’est-à-dire l’enseignement et le contrôle de l’hygiène bucco-dentaire, les détartrages et les surfaçages radiculaires, suffisent à établir un succès thérapeutique. Une thérapeutique parodontale de soutien permet d’obtenir des résultats stables dans le temps. Cependant, on rencontre des sites qui continuent à perdre de l’attache ou d’autres qui récidivent.
La présence de certaines espèces bactériennes entraîne un risque plus grand de progression de la maladie, notamment Aggregatibacter actinomycetemcomitans (Actinobacillus actinomycetemcomitans), et Porphyromonas gingivalis (Haffajee & Socransky 1994). On sait que le traitement mécanique n’élimine pas de façon prévisible Aa qui a une capacité à envahir les tissus parodontaux ou les tubuli dentinaires (Adriaens 1988). De plus, la recolonisation peut provenir d’aires non dentaires : face dorsale de la langue, amygdales. Les antibiotiques peuvent-ils être un complément du traitement mécanique, peuvent-ils potentialiser ses effets ?
L’antibiotique de choix doit pouvoir cibler les pathogènes parodontaux et respecter la flore commensale. Il doit donc avoir une activité sur l’ensemble des bactéries impliquées dans la maladie parodontale essentiellement anaérobies Gram -.
L’antibiotique doit être efficace en concentration suffisante en dehors des tissus, dans la poche parodontale, et surtout, il doit pouvoir agir non pas sur des bactéries isolées, mais sur un biofilm. Au sein de ce biofilm (composé de bactéries et d’une matrice extracellulaires), les bactéries se protègent mutuellement (sécrétion de βlactamases, transfert de matériel génétique…). L’efficacité de l’antibiotique est également réduite par le grand nombre de bactéries présentes dans la poche (effet inoculum).
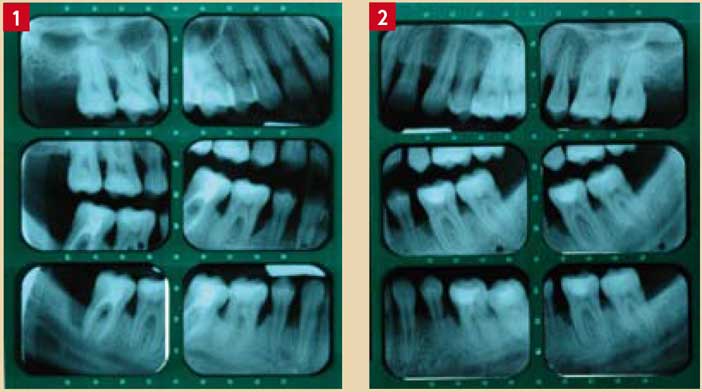
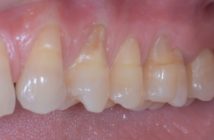
Fig. 1 et 2 : Parodontite agressive généralisée chez une patiente de 30 ans (secteurs molaires).
La concentration d’antibiotique nécessaire est donc beaucoup plus importante que celle utilisée dans les études in vitro.
La stratégie de traitement est donc de diminuer le nombre de bactéries, de désorganiser le biofilm par une action mécanique avant ou de façon concomitante à l’utilisation des antibiotiques.
De nombreuses molécules ont été utilisées, telles les tétracyclines (doxycycline, minocycline), les pénicillines (amoxicillines, seule ou associé à l’acide clavulanique), le métronidazole (seul ou associé à l’amoxicilline), les macrolides (spiramycine, azithromycine, clindamycine).
Globalement, d’après les études cliniques (Haffajee et coll. 2003, Loesche 1999, VanWinkelHoff et coll. 1996), il semblerait que l’administration d’antibiotique permet, en association avec le détartrage surfaçage radiculaire, une amélioration du gain d’attache clinique, notamment avec les tétracycline (doxycycline), le métronidazole et l’association amoxicilline et métronidazole. Les posologies les plus étudiées sont pour :
- Doxycycline : 200 mg/jour sur 8 jours,
- Métronidazole : 750 mg à 1500 mg/jour sur 7 jours,
- Amoxicilline + métronidazole : respectivement 1500 mg/jour et 750 mg à 1500 mg /jour sur 7 jours.
Les indications d’une antibiothérapie peuvent être :
- La parodontite agressive,
- La parodontite chronique généralisée sévère,
- La parodontite avec une perte d’attache progressive malgré une thérapeutique appropriée,
- La parodontite modérée à sévère, associée à des maladies systémiques entraînant une immunodéficience.
S’il est important de traiter l’infection parodontale, qui augmente le risque de maladies systémiques, il faut cependant émettre de fortes réserves sur l’utilisation des antibiotiques compte tenu du développement important de souches parodontales résistantes. Dans la majorité des cas, de bons résultats seront obtenus sans antibiothérapie, et si malgré tout une antibiothérapie semble nécessaire, il est intéressant de réaliser une analyse microbiologique au préalable (par culture ou sonde ADN) pour cibler les pathogènes.
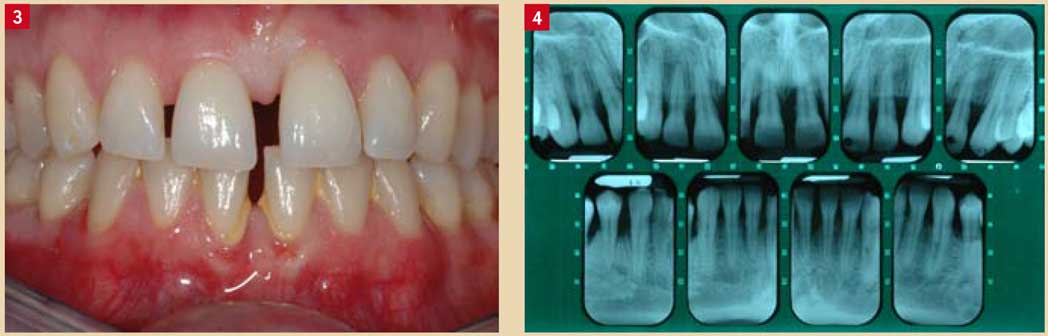
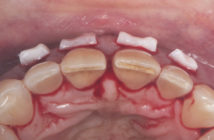
Fig. 3 et 4 : Parodontite agressive généralisée chez la même patiente de 30 ans (secteurs incisivo canins).
Antibiotiques d’action locale
Les effets secondaires des antibiotiques par voie générale, l’apparition de résistances, la concentration en antibiotique insuffisante dans certains sites, conduisent à s’intéresser à une administration par voie locale. Pour être efficace, la concentration doit rester haute avec une libération continue sans être éliminée par le fluide gingival. Les molécules étudiées sont :
- La tétracycline placé dans une fibre polymère non résorbable (Actisite®) qui permet une concentration 150 fois plus importante que par voie systémique ;
- Un gel de doxycycline à 10 % (Atridox®),
- Un gel de minocycline à 2 % microencapsulé dans un polymère résorbable (Parocline®),
- Un gel de metronidazole à 25 % (Elyzol®).
Le gel de métronidazole semble agir le moins longtemps (sur 48 heures) et, les fibres de tétracycline le plus (10 jours à la même concentration), mais sont plus difficile à mettre en place et non résorbables.
Les études cliniques sur ces produits essentiellement menées sur des parodontites chroniques modérées à sévère donnent de bons résultats. Ces produits trouvent leur intérêt non pas dans une première approche thérapeutique, mais dans le contrôle de sites localisés progressant, malgré une thérapeutique étiologique initiale.
Actuellement, seul le gel de minocycline à 2 % est commercialisé en France.
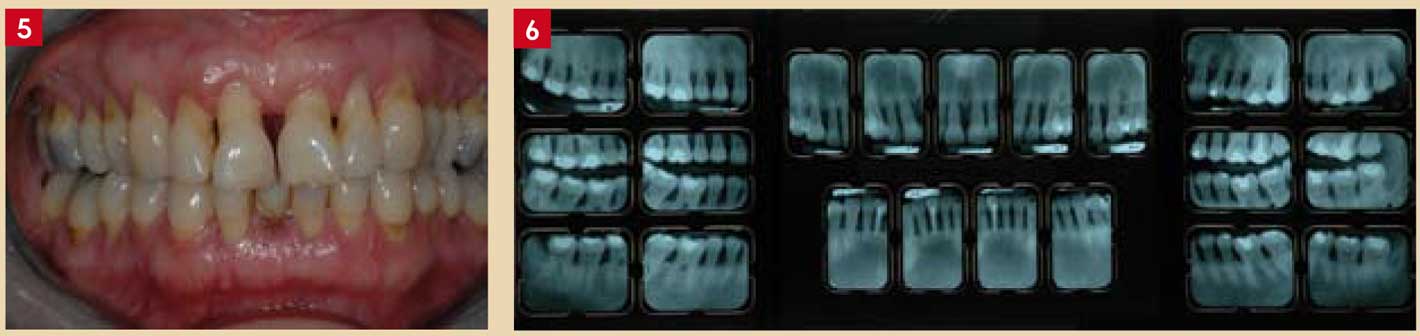
Fig. 5 et 6 : Parodontite chronique généralisée sévère chez une patiente de 49 ans fumeuse (20cigarettes/jour depuis 20 ans).
Les antiseptiques en parodontologie
Les études cliniques abondent pour démontrer que le contrôle mécanique de plaque a son importance dans la guérison de la maladie parodontale. Sachant que la gingivite et la parodontite sont le continuum d’une même maladie, la prévention de l’apparition ou de la récurrence de la parodontite repose sur le contrôle de la plaque supragingivale. Pour pallier les insuffisances du nettoyage mécanique, le concept du contrôle chimique se justifie. C’est un complément aux méthodes d’hygiène mécanique reconnues, telles que la brosse à dent manuelle ou électrique, les brossettes interdentaires et le fil dentaire.
Les études cliniques sur le sujet sont intéressantes, dans la mesure où elles comparent, sur une phase thérapeutique ou préventive en ajout à des moyens mécaniques, un antiseptique donné à un antiseptique de référence et un placebo.
Un antiseptique a quatre niveaux d’action :
- Antiadsorption
- Antimicrobien (bactériostatique et bactéricide),
- Antipathogénique (inhibiteur des facteurs de virulence),
- Antiplaque (suppresseur d’un biofilm établi).
La majorité des antiseptiques sont antimicrobiens, cela signifie qu’ils empêchent la formation du biofilm par leur action bactériostatique et bactéricide.
Une qualité majeure recherchée chez un antiseptique est la rémanence, c’est-à-dire la persistance de son activité dans le temps, après application. Cette rémanence dépend de l’aptitude à être adsorbé à une surface dentaire pour subir une élution sous forme biologiquement active.
Parmi les molécules antiseptiques, celle considérée comme le « gold standard » est la chlorhexidine (digluconate de chlorhexidine). Cette molécule possède un spectre large : Gram+ et Gram-, levures, et sa fixation sur les tissus mous et durs permet une rémanence de 12 heures.
Les bains de bouche à 0,10 %, à 0,12 % et 0,2 % font l’objet d’un grand nombre d’études cliniques. Cette molécule se présente également sous forme de gel, en spray, en dentifrice, en vernis. C’est l’agent le plus efficace dans le contrôle de plaque et la gingivite. Mais son utilisation à long terme entraîne de nombreux effets secondaires :
- Une modification de la microflore commensale,
- Des colorations marron des dents et muqueuses,
- Une perturbation du goût,
- Une érosion des muqueuses.
De plus, son activité est inhibée par les savons, les détergents, le sang et le pus.
La chlorhexidine est supérieure à toutes les autres molécules au moment du traitement actif des parodontites, mais par la suite, on peut utiliser des antiseptiques ciblés sur une action préventive.
Ces antiseptiques doivent donc avoir une activité antiplaque et antigingivite et pouvoir être utilisés sur un long terme sans effets secondaires.
Sans énumérer toutes les molécules antiseptiques étudiées, nous allons nous intéresser à celles qui semble apporter un plus sur la prévention de l’apparition et de la récurrence de la maladie parodontale.
Le triclosan est une molécule à large spectre, bactéricide, bactériostatique et anti-inflammatoire. Mais il est éliminé rapidement de la cavité buccale, c’est pourquoi on l’a associé à un copolymère qui augmente sa rémanence. Il est aussi retrouvé associé au citrate de Zinc (action antibactérienne additive et synergistique) et au pyrophosphate (agent anti-cristallisant).
Les études cliniques montrent que sous forme de dentifrice, le triclosan avec son copolymère (Colgate total®) est supérieur à un placebo dans son action antiplaque et antigingivite. Enfin, il n’a pas d’effets indésirables à long terme (Rosling et coll. 1997).
Les huiles essentielles font aussi l’objet de nombreuses études cliniques (Listerine®). Comparé à un placebo, on note une diminution de la plaque et de la gingivite sans apparition de bactéries opportunistes ou pathogènes (Walker 1989).
L’association fluorures d’étain et fluorures d’amine, sous forme de dentifrice ou de bain de bouche, (Meridol®) permet également une diminution de la plaque, de l’inflammation et du saignement, comparé à un placebo (McClanahan et coll. 1997).
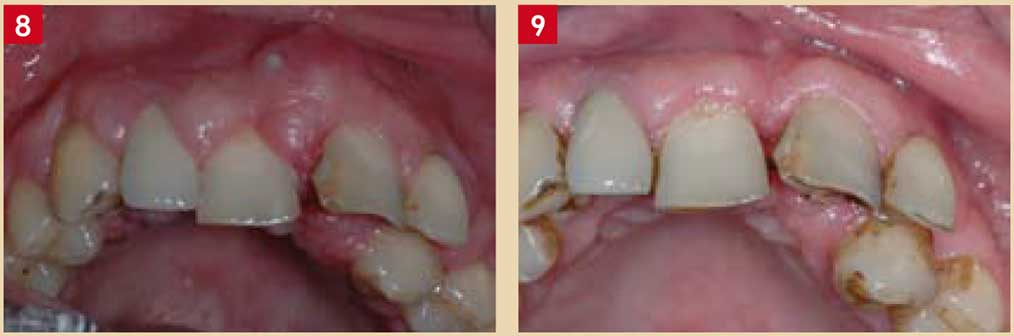
Action sous gingivale des antiseptiques
En application sous gingivale, on peut écarter la chlorhexidine dont l’action est inhibée par le sang et le pus.
Par contre, la povidone-iodine (bétadine®), utilisée en adjonction dans les systèmes d’irrigation des détartreurs ultrasoniques, permettrait de potentialiser le traitement non chirurgical des parodontites chroniques (Rosling et coll. 1983).
Conclusion sur les antiseptiques
Au cours de la thérapeutique active de la parodontite, la chlorhexidine est la molécule de référence. Pour prévenir l’apparition et la récidive, les dentifrices et bains de bouches à base de triclosan et copolymère, fluorures d’amine et d’étain, et huiles essentielles sont utiles.
Bibliographie
1. Adriaens P.A., De Boever J.A. et Loesche W.J. Bacterial invasion in root cementum and radicular dentin of peridontally diseased teeth in humans. Journal of Periodontology 1988; 59,222-230
2. Haffajee A.D. et Socransky S.S. Microbial etiological agents of destructive periodontal diseases. Periodontology 2000 1994; 5, 744-750
3. Haffajee A.D., Socransky S.S. et Gunsollay. Systemic anti-infective periodontal therapy : a systematic review. Ann Periodontol 2003 ; 8,115-181
4. Loesche W.J . The antimicrobial treatment of periodontal disease : Changing the treatment paradigm. Crit Rev Oral Biol Med 1999; 10(3), 245-275
5. MacClanahan S.F., Beiwanger B.B., Bartizek R.D. et al. A comparaison of stabilized stannous fluoride dentifrice and triclosan/copolymer dentifrice for efficacy in the reduction of gingivitis and gingival bleeding : 6 month clinical result. J Clin Dent 1997; 8(2), 39-45
6. Rosling B.G.,Slots J.,Webber R.L. et al. Microbiological and clinical effect of topical subgingival antimicrobial treatment on human periodontal disease. J Clin Periodontol 1983; 10,487-514
7. Rosling B.G., Wannfors B., Volpe R. et al. The use of triclosan/copolymer dentifrice may retard progression of periodontitis. J Clin Periodontol 1997 24(12), 873-880
8. Van Winkelhoff A.J.,Rams T.E.,Slots J. Systemic antibiotic therapy in periodontics. Periodontology 2000 1996; 10, 45-78
9. Walker C., Cark W., Tyler K. Evaluation of microbial shifts following long term antiseptic use. J Dent Res 1989 21: 60



Un commentaire
Pourquoi le parontologue de mon fils n à pas fait de soins des la première séance, c est pas normal merci de me répondre