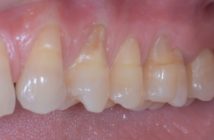
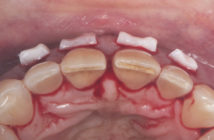
Introduction
La Fédération Européenne de Parodontologie a publié en 2020 les premières recommandations basées sur des preuves scientifiques concernant le traitement des parodontites des stades I à III. L’objectif était de présenter les meilleurs traitements possibles.
Ces recommandations ont été publiées en Juillet 2020 dans le Journal of Clinical Periodontology et sont en accès libre. Elles contiennent 62 recommandations concernant les différentes thérapeutiques proposées qui sont classées selon la puissance des preuves scientifiques (recommandations basées sur les preuves scientifiques ou Evidence-Based-EB) et le degré de consensus des experts mobilisés pour la rédaction de ce travail (recommandations basées sur le consensus-C). [1]
La puissance des recommandations est expliquée dans le Tableau 1. Ces recommandations sont le produit du Perio Workshop 2019 (novembre 2019) où 90 experts de 19 pays ont évalué 15 revues systématiques de la littérature concernant les différentes formes de thérapeutiques parodontales. [2]
L’objectif de cet article est de faire le point sur les recommandations ayant le plus d’impact sur nos traitements.
Parmi les prérequis , le diagnostic doit avoir été posé à l’aide de la classification de Chicago 2017. De plus, le patient a été informé de son diagnostic de parodontite, des causes, des facteurs de risque, des différentes possibilités de traitements ainsi que des bénéfices et risques (abstention thérapeutique incluse). L’accord sur le plan de traitement personnalisé et le consentement éclairé sont nécessaires.

Tableau 1 : puissance des recommandations : Gradation selon l’association allemande des sociétés spécifiques médicales (AWMF) et la comission permanente des recommandations (2012).
Première étape de traitement : l’élimination du biofilm supra-gingival
Cette étape a pour but de guider le changement de comportement du patient en le motivant à effectuer une élimination efficace du biofilm dentaire supra-gingival et à contrôler les facteurs de risques.
Les recommandations insistent sur le contrôle du biofilm supra-gingival par le patient, signant son engagement dans le traitement (C-Grade a). Il est également recommandé au dentiste d’effectuer une élimination professionnelle du biofilm supra-gingival (détartrage) et d’éliminer les facteurs de rétention de plaque (restaurations débordantes, …) comme première étape de la thérapeutique (C-Grade a). Concernant le contrôle des facteurs de risque, il est recommandé de mettre en place un sevrage tabagique et un contrôle régulier du diabète chez les patients en cours de traitement parodontal (EB-Grade a)[4].Tableau 2
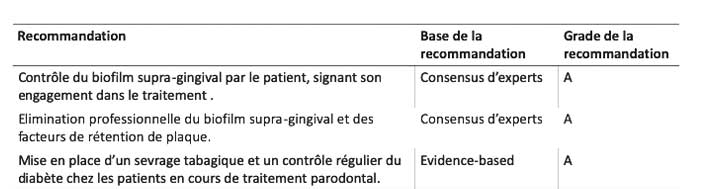
Tableau 2 : première étape du traitement : Prinicipales recommandations
Deuxième étape de traitement : l’instrumentation sous-gingivale non-chirurgicale
La deuxième étape de traitement, également appelée thérapeutique étiologique a pour but d’éliminer (réduire) le biofilm sous gingival et le tartre. Les procédures ciblées ont différents noms dans la littérature scientifique (débridement sous-gingival, détartrage sous-gingival, surfaçage radiculaire, …) donc le terme “instrumentation sous-gingivale” a été sélectionné pour traiter de toutes les procédures non-chirurgicales effectuées en manuel ou sonique/ultrasoniques. Cette étape nécessite la réussite de la première étape de traitement.
L’instrumentation sous-gingivale, effectuée à l’aide d’instruments manuels ou sonores/ultrasonores seuls ou combinés, est fortement recommandée afin de traiter la parodontite dans le but de réduire la profondeur des poches, l’inflammation gingivale et le nombre de sites atteints (EBGrade A). Il est suggéré que l’instrumentation sous-gingivale puisse être effectuée soit en thérapeutique traditionnelle par quadrant ou bouche entière dans les 24H (EB-Grade B). Il est important de garder en tête la présence d’une réponse inflammatoire systémique aiguë suite aux protocoles bouche entière, nécessitant de tenir compte de l’état général du patient lors du choix de la thérapeutique.
Pour l’utilisation d’agents physiques adjuvants lors de l’instrumentation sous-gingivale, il est suggéré de ne pas utiliser les lasers ainsi que la thérapeutique photodynamique adjuvante (a PDT) à des longueurs d’ondes de 660-670 ou 800-900 chez les patients atteints de parodontite (EB-Grade B).
L’utilisation d’agents immuno-modulateurs adjuvants par voie locale ou systémique n’est pas recommandée. Ceci concerne l’administration locale de gels de statines (atorvastatine, simvastatine, rosuvastatine), les probiotiques, les doses systémiques de doxycycline sub antimicrobiennes (SDD), les gels de bisphosphonates par voie locale, les bisphosphonates par voie systémique, les anti-inflammatoires non stéroïdiens, les omégas 3 poly-insaturés et les gels de metformine. Les antiseptiques adjuvants peuvent être considérés, spécifiquement les bains de bouche de chlorhexidine pendant une durée limitée, comme adjuvants au débridement mécanique, dans des cas spécifiques (CGrade 0).
L’administration locale de chlorhexidine à libération prolongée comme adjuvant peut être considérée (EB-Grade 0). L’administration locale d’antibiotiques à libération prolongée comme adjuvants à peut être considérée (EBGrade 0). Concernant les antibiotiques systémiques adjuvants à l’instrumentation sous-gingivale, leur utilisation systématique n’est pas recommandée (EB-Grade a). Leur usage peut être considéré dans certains cas pour certaines catégories de patients, les recommandations citant en exemple la Parodontite généralisée Stade III chez les jeunes adultes, sans plus de précision (EB-grade 0). Tableau 3
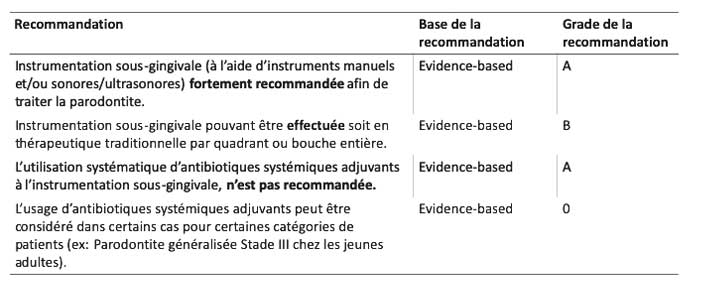
Tableau 3 : deuxième étape du traitement : Prinicipales recommandations
Ces recommandations permettent d’atteindre les objectifs du traitement étiologique soit aucune poche parodontale
= 4mm avec saignement au sondage ou aucune poche
= 6mm (Fig.1).
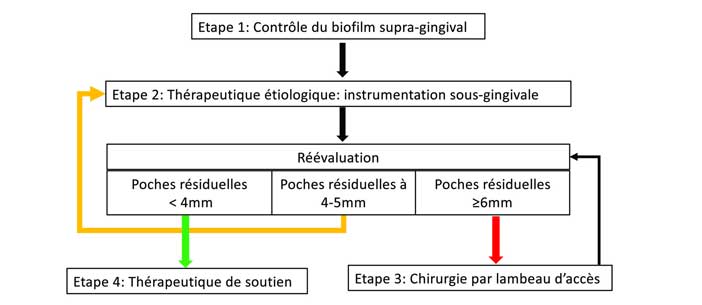
Fig. 1 : prise en charge des parodontites de stades I à III
Troisième étape de traitement : la chirurgie par lambeau d’accès
Une chirurgie avec lambeau d’accès est suggérée en présence de poches résiduelles profondes (PPD = 6mm) chez les patients atteints d’une parodontite de stade III après les 2 premières étapes du traitement parodontal (EB-Grade B).
En présence de poches résiduelles de 4-5 mm , il est suggéré de répéter l’instrumentation sous-gingivale nonchirurgicale (étape 2) (EB-Grade B).
Dans le cas de poches profondes résiduelles (PPD = 6mm) chez les patients atteints d’une parodontite de stade III après une deuxième étape adéquate, il est suggéré d’utiliser la chirurgie parodontale résectrice (modification de l’architecture des tissus durs et/ou durs), en tenant compte de l’augmentation potentielle des récessions gingivales (EB-Grade B).
Comme prise en charge minimale, il est recommandé d’effectuer des détartrages et surfaçages radiculaires réguliers avec ou sans lambeau d’accès dans un contexte de traitement optimal (étapes 1 et 2) ainsi qu’un programme régulier de thérapeutique de soutien comprenant une instrumentation sous-gingivale (Grade a). Il est recommandé de traiter les poches profondes résiduelles associées à des défauts infraosseux de 3 mm ou plus avec une chirurgie parodontale régénératrice (Grade A).
Lors des thérapeutiques régénératrices, il est préconisé d’utiliser une membrane ou un dérivé de la matrice amélaire avec ou sans l’ajout de substituts osseux (Grade A).
Les recommandations suggèrent de sélectionner le biomatériaux le plus adapté selon les critères décrits dans le Workshop Mondial de 1996 tout en précisant que certains matériaux ne respectent pas ces éléments et possèdent tout de même des marquages CE ou FDA.
Il est conseillé l’utilisation de formes de lambeaux spécifiques avec un maximum de préservation des tissus mous inter-dentaires tels que les lambeaux à préservation papillaire. Dans certaines situations spécifiques, il est également conseillé de limiter l’élévation du lambeau afin d’optimiser la stabilité du caillot sanguin et de réduire la morbidité (EB-grade a) [7, 8]. Tableaux 4 & 5
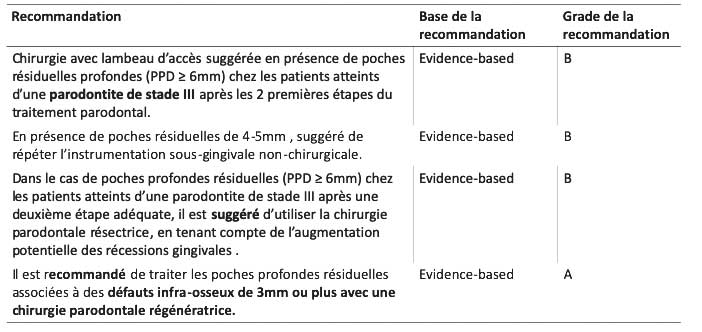
Tableau 4 : troisième étape du traitement : Prinicipales recommandations
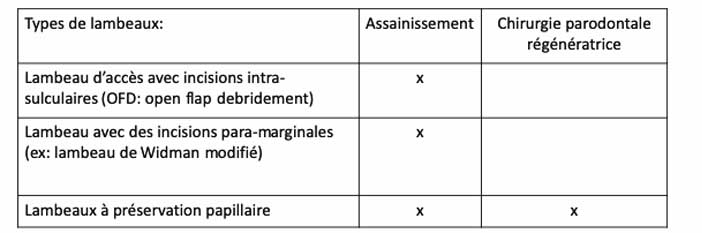
Tableau 5 : indications des différents types de lambeaux
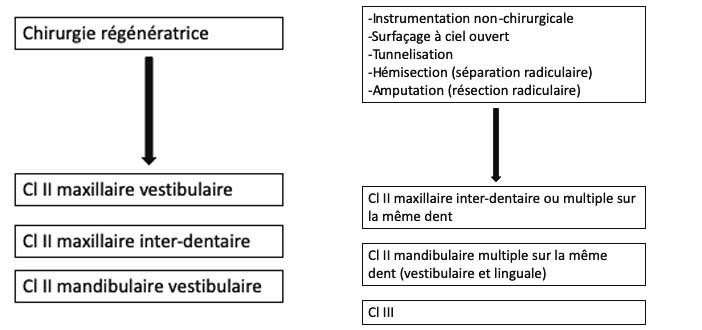
La gestion des lésions de furcation est résumée dans la Figure 2. La présence de défauts de furcation n’étant pas une indication d’extraction, il est conseillé de traiter les molaires avec des poches résiduelles associées à des défauts de classe II de furcation vestibulaire maxillaire et mandibulaire avec une thérapeutique de régénération parodontale en utilisant soit des dérivés de la matrice amélaire seuls soit des substituts osseux avec ou sans membrane résorbable (EB-grade a)
Quatrième étape de traitement : thérapeutique parodontale de soutien
Les rendez-vous de thérapeutique de soutien sont fortement recommandés, tous les 3 à 12 mois maximum et doivent être adaptés au profil de risque du patient (ex : grade de la parodontite) et à sa situation parodontale après thérapeutique active (C-Grade a). Effectivement, l’adhésion à la thérapeutique parodontale de soutien est essentielle à la stabilité parodontale à long terme et à la potentielle amélioration de l’état parodontal (C-grade a).
Des instructions d’hygiène sur-mesure et individuelles sont recommandées, comprenant l’hygiène inter-dentaire, afin de contrôler l’inflammation et d’éviter tout dommage potentiel chez les patients lors de la thérapeutique parodontale de soutien (grade a). Si cela est possible d’un point de vue anatomique, il est recommandé de compléter le brossage par l’utilisation de brossettes inter-dentaires (EB-grade a). Il n’est pas suggéré d’utiliser le fil dentaire comme premier choix de nettoyage inter-dentaire chez les patients en maintenance (EB-grade B).
La base de la gestion de l’inflammation gingivale étant l’élimination mécanique du biofilm effectuée par le patient, des antiseptiques adjuvants peuvent être considérées dans des cas spécifiques comme approche personnalisée de traitement lors de la thérapeutique de soutien (EB-grade 0).
Dans le cas d’antiseptiques adjuvants, les molécules suivantes sont suggérées (EB-grade B) :
- dentifrices contenant de la chlorhexidine, du triclosancopolymère ou du fluorure stanneux hexametaphosphate de sodium.
- bains de bouche antiseptique contenant de la chlorhexidine, des huiles essentielles ou du chlorure de cetylpyridinium.
Le contrôle des facteurs de risque est recommandé, notamment les interventions de sevrage tabagique chez les patients en thérapeutique parodontale de soutien (C-Grade a). Tableau 6
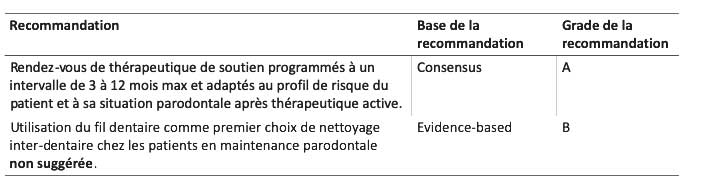
Tableau 6 : quatrième étape du traitement : Prinicipales recommandations
Principales conclusions
- Ces recommandations, dans la continuité de la dernière classification des pathologies parodontales (Chicago 2017), permettent d’éclaircir et de standardiser la prise en charge des parodontites en se basant sur les preuves scientifiques.
- La première étape du traitement a pour objectif de contrôler le biofilm supra-gingival avec l’implication du patient dans son traitement, une élimination professionnelle effectuée par le chirurgien-dentiste et un contrôle des facteurs de risques (tabac, diabète).
- La deuxième étape de traitement (ou thérapeutique étiologique) illustre un changement de paradigme en recommandant une instrumentation sous-gingivale nonchirurgicale systématique, peu importe la profondeur de poche initiale.
- Lors de la troisième étape, la thérapeutique parodontale chirurgicale est suggérée en présence de poches résiduelles profondes (PPD = 6mm) chez les patients atteints d’une parodontite de stade III, après les 2 deux premières étapes du traitement parodontal.
- La quatrième étape insiste sur la nécessité d’une thérapeutique de soutien régulière (une à quatre fois par an) selon le profil de risque du patient.
NB : toutes les figures et tableaux ont été mis en forme et traduits d’après [1].
Bibliographie
[1] Sanz M, Herrera D, Kebschull M, et al. treatment of stage I–III periodontitis—the EFP S3 level clinical practice guideline. J Clin Periodontol 2020; 47: 4–60.
[2] German Association of the Scientific Medical Societies (AwMF), & Standing Guidelines Commission. aWMF Guidance manual and rules for guideline development, https://www.awmf.org/leitlinien/awmf-regelwerk/awmfguidance.html.
[3] Papapanou PN, Sanz M, Buduneli N, et al. Periodontitis: Consensus report of workgroup 2 of the 2017 World Workshop on the Classification of Periodontal and Peri-Implant Diseases and Conditions: Classification and case definitions for periodontitis. J Clin Periodontol 2018; 45: S162–S170.
[4] Ramseier CA, woelber JP, Kitzmann J, et al. Impact of risk factor control interventions for smoking cessation and promotion of healthy lifestyles in patients with periodontitis: a systematic review. J Clin Periodontol 2020; 47: 90–106.
[5] Suvan J, Leira Y, Moreno Sancho FM, et al. Subgingival instrumentation for treatment of periodontitis. a systematic review. J Clin Periodontol 2020; 47: 155–175.[5] Suvan J, Leira Y, Moreno Sancho FM, et al. Subgingival instrumentation for treatment of
periodontitis. A systematic review. J Clin Periodontol 2020; 47: 155–175.
[6] Consensus Report Periodontal Regeneration Around Natural Teeth. Ann Periodontol
1996; 1: 667–670.
[7] Graziani F, Gennai S, Cei S, et al. Clinical performance of access flap surgery in the
treatment of the intrabony defect. A systematic review and meta-analysis of
randomized clinical trials. J Clin Periodontol 2012; 39: 145–156.
[8] Nibali L, Koidou VP, Nieri M, et al. Regenerative surgery versus access flap for the
treatment of intra‐bony periodontal defects: A systematic review and meta‐analysis. J
Clin Periodontol 2020; 47: 320–351.
[9] Jepsen S, Gennai S, Hirschfeld J, et al. Regenerative surgical treatment of furcation
defects: A systematic review and Bayesian network meta‐analysis of randomized
clinical trials. J Clin Periodontol 2020; 47: 352–374.