Les recherches des dix dernières années indiquent que le modèle étio-pathogénique en parodontie est celui qu’ont proposé Socransky, Page et Schroeder (6) (8). Les parodontites ne sont donc en définitive que de « banales » (mais complexes) infections multifactorielles. Elles doivent donc être diagnostiquées, traitées et prévenues en tant que telles.
La quasi-totalité des infections procèdent par cycle avec un début et une fin en passant par différentes étapes telles que la transmission de la source à l’hôte, l’adhérence, la croissance, l’évitement des défenses immunitaires, l’invasion puis finalement la destruction tissulaire. On déclare un sujet « malade » lorsque le cycle est parvenu à son terme et que les tissus sont détruits (Fig. 1). Avant ce stade, la personne est « contaminée », « infectée » mais pas nécessairement « malade ».
En parodontie, lorsque le parodonte est détruit, on parle de « perte d’attache » avec ou sans formation de poche.
Étiologie
Quelles sont les conditions qui permettent au cycle infectieux de parvenir jusqu’à la destruction des tissus parodontaux ? Pour que les tissus parodontaux soient détruits, on s’accorde aujourd’hui à reconnaître qu’il faut réunir quatre conditions au même moment en sachant que chacune de ces conditions est nécessaire mais non suffisante à elle seule pour déclencher des pertes d’attache (6) (Charon et al., 1995). Ces quatre conditions se présentent comme suit :
- Présence de bactéries virulentes
- Absence de bactéries protectrices
- Environnement dento-gingival défavorable
- Défaillance(s) du système immunitaire
Présence de bactéries virulentes
Les bactéries pathogènes non compatibles avec la santé parodontale sont anaérobies, à Gram négatif, protéolytiques pour la plupart d’entre elles, motiles et non motiles (voir l’article de M. Sixou p.xx de ce numéro). Les bactéries les plus étudiées sont Aggregatibacter actinomy-cetemcomitans, Porphyromonas gingivalis, Treponema denticola, Tannerella forsythia, Parimona micra (à Gram positif) et Campylobacter rectus qui font partie du complexe « rouge » de Socransky (9). Ces bactéries sont asaccharolytiques et donc incapables de métaboliser les hydrates de carbone en acide lactique.
Implications cliniques
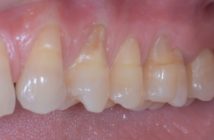
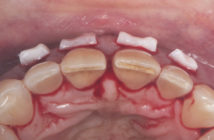
L’identification des bactéries pathogènes peut se faire par des moyens simples tels que la microscopie à contraste de phase et/ou l’utilisation de sondes nucléiques. Les bactéries pathogènes n’étant pas ou très peu cariogènes expliquent que les patients atteints de parodontite agressive présentent souvent peu ou pas de caries (Fig. 2a et 2b).
Il nous semble important de rappeler qu’un diagnostic étiologique ne peut pas reposer uniquement sur la nature de la flore sous-gingivale. En effet, la flore incompatible est nécessaire – mais non suffisante à elle seule – pour déclencher des pertes d’attache.
Absence de bactéries protectrices
Les bactéries compatibles, et souvent nécessaires à la santé parodontale, sont aujourd’hui nommées « probiotiques » (Teughels et al., 2008). Elles sont aérobies, à Gram positif, non motiles. Il s’agit principalement de filaments, de bâtonnets et de cocci (streptococcus mutans, actinomyces) (Haffajee et Socransky, 1994) (3).
Ces bactéries, essentielles à la santé parodontale, sont – entre autres – antagonistes des bactéries pathogènes. Par exemple, certains streptocoques produisent du peroxyde d’hydrogène (eau oxygénée) qui détruit les bactéries anaérobies (3).
Implications cliniques
La plaque dentaire doit donc être considérée aujourd’hui comme un « biofilm » physiologique essentiel et non en tant qu’« ennemi invisible » qu’il faut totalement « éliminer » trois fois par jour. L’identification des bactéries « protectrices » peut se faire à l’aide d’un microscope ou des tests utilisés en cariologie. Il semblerait que des sondes nucléiques soient en préparation pour la détection des probiotiques. Le détartrage conventionnel modifie souvent la nature de la plaque dentaire sous gingivale par apport massif d’oxygène en rétablissant une flore compatible avec la santé parodontale (Listgarden et al., 1979) (Mousques et al., 1980). Hélas, les études montrent que ses effets sur la flore sont transitoires si le patient ne contrôle pas la plaque supragingivale. La prescription d’antibiotiques à large spectre (tétracyclines par exemple) peuvent atteindre les bactéries probiotiques et expliquer leur relative inefficacité en parodontie. Les patients sensibles à la carie dentaire le seraient donc beaucoup moins aux destructions parodontales.
Environnement dentogingival défavorable
Si les éléments présents à la jonction dento-gingivale créent un environnement anaérobie, il est clair que, si les bactéries pathogènes citées plus haut sont présentes, elles pourront proliférer.
C’est le cas lorsque les éléments suivants sont présents :
- Le tartre
- L’inflammation gingivale
- La prothèse scellée ou amovible
- Certains dispositifs orthodontiques
Le tartre supragingival crée ipso facto un environnement anaérobie en modifiant le potentiel d’oxydo-réduction (8). La présence d’inflammation gingivale (avec ou sans pertes d’attache) implique donc une forte concentration d’hémoglobine et de fer. Cet ion est essentiel à la croissance d’une majorité des bactéries pathogènes.
Implications cliniques
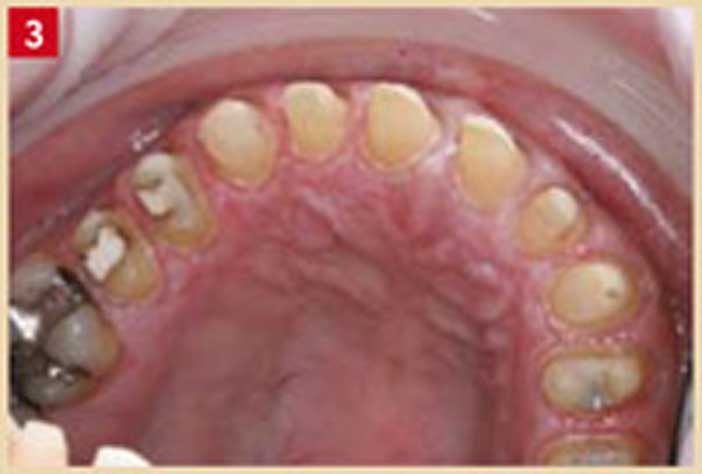
Le contrôle de l’inflammation est donc un pré-requis à tout type d‘intervention mécanique (y compris le détartrage). La réalisation et le scellement de la prothèse doit donc être faite en éloignant les limites cervicales de la jonction dento-gingivale (Fig. 3).
Défaillance(s) du système immunitaire
Deux leucocytes sont principalement impliqués dans la défense du parodonte : le polymorphonucléaire neutrophile (PMN) et le monocyte (6) (10) (Denison et Van Dyke, 1997). S’il existe une dysfonction des PMN soit dans l’adhésion, la diapédèse, la chimiotaxie, la phagocytose et/ou la bactéricidie, le parodonte n’est plus défendu et les pertes d’attache peuvent avoir lieu si les trois autres conditions sont présentes (Hemmerle et al., 1991).
Ces défaillances du système immunitaire peuvent être innées ou acquises (Genco, 1996). Les défaillances acquises peuvent être les suivantes (7) (Kinane et al., 2007) (Nishimura et al., 2007) :
- Infections virales (Mononucléose ou Herpes par exemple)
- Hémopathies acquises (certaines leucopénies par exemple)
- Médications immunodépressives (anti-inflammatoire notamment)
- SIDA ou HIV+
- Grossesse
- Tabagie
- Présence de stress
- Chimiothérapie anti-cancéreuse
- Diabète de type 1 non contrôlé
- Dyslipidémies
Les défaillances innées sont les suivantes (5) (Yoshie et al., 2007) :
- Dysfonction génétique des PMN (leucopénie notamment)
- Dysfonction génétique des monocytes (surproduction d’interleukine 1ß) (voir plus loin)
- Diabète de type 2 non contrôlé
L’équipe de Slots a démontré que certains virus de type Herpes sont capables de « déprimer » la réponse immunitaire et de faciliter l’installation de certaines bactéries pathogènes (Slots, 2007). Il est donc important de savoir si le patient est sujet à des infections herpétiques (zona, « boutons de fièvre »).
Implications cliniques
On voit toute l’importance de l’entretien de première consultation pour évaluer les facteurs médicaux et ainsi collaborer plus efficacement avec les autres membres de l’équipe soignante (médecins, spécialistes ou non). C’est souvent le cas lorsque le patient est diabétique car les infections parodontales actives ont un effet hyperglycémiant et une glycémie non contrôlée complique le traitement parodontal (Nishimura et al., 2007). D’autre part, dans certaines situations, le praticien peut être amené à demander un certain nombre de paramètres biologiques (Numération/Formule, Vitesse de sédimentation, Protéine Réactive C, Fibrinogène, Lipides, Glycémie, etc.).
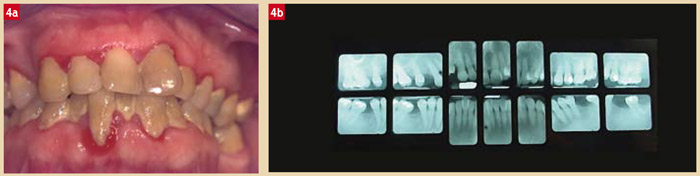
Lorsque les quatre conditions sont réunies, souvent et de manière intense, les pertes d’attache seront sévères, rapides et souvent généralisées ce qui est le cas dans les parodontites agressives. Inversement, lorsque les quatre conditions sont réunies peu souvent et de manière peu intense, les patients souffriront alors de parodontite chronique de l’adulte qui évolueront pendant des années avant qu’un symptôme n’apparaisse. De même, il est possible qu’un sujet sans hygiène bucco-dentaire peut ne souffrir que d’une banale gingivite ne mettant pas les dents en danger du point de vue parodontal (si c’est la seule condition présente) (Fig. 4a et 4b).
D’autre part, pour stopper la progression d’une parodontite active, il suffira de « briser le modèle infectieux » en éliminant une des quatre conditions. Il semble que la méthode la plus simple et la plus prévisible soit l’élimination – la plus complète possible – des bactéries pathogènes par l’utilisation des prescriptions adéquates (antiseptiques avec ou sans antibiotiques).
Prévention
La prévention « primaire » consistera donc à agir sur une ou plusieurs des étapes du cycle infectieux pour l’empêcher de parvenir à son terme (e.i. la destruction tissulaire). La prévention « secondaire » consistera à empêcher le cycle de parvenir à nouveau à son terme et donc provoquer des récidives.
Le modèle étiologique rend possible une définition du sujet à risque en parodontie : Un sujet à risque en parodontie est un sujet qui présente une plus forte probabilité de réunir souvent et de manière intense les quatre conditions pour perdre de l’attache.
Les études indiquent que les principales caractéristiques des sujets à risque parodontal majeur ont la présence de (Johnson et al., 1988) (Charon et al., 1990) (Johnson,1992) (Salvi et al., 1997) (Hart et Kornman, 1997) :
- Facteur génétiques : antécédents familiaux et/ou PST positif (voir plus loin)
- Faible résistance aux infections (le diabète par exemple) (Taylor et al., 1996)
- Stress psychologique (les « dépressions ») (Bailleux, 1991)
- Tabagie
- Faible résistance à la carie
Implications cliniques
Le praticien pourra donc – dans un premier temps – dépister les sujets à risque en détectant la présence ou l’absence – totale ou relative – d’une ou plusieurs de ces caractéristiques. Puis, il s’agira de déterminer l’intensité du risque parodontal afin de prescrire le traitement préventif adapté (2). La conséquence clinique la plus importante à nos yeux est le strict respect d’une chronologie des actes en parodontie (Fig. 5). Une partie importante des échecs en parodontie est souvent la conséquence de vouloir gagner de l’attache avant de contrôler l’infection (Fig. 6).
Il s’agira donc, après établissement d’un diagnostic étiologique, de :
- Stopper l’activité des lésions parodontales.
- Regagner le plus d’attache possible en supprimant les obstacles à la cicatrisation des lésions parodontales (principalement le tartre sous-gingival).
- Maintenir les gains d’attache en évitant que les quatre conditions soient à nouveau réunies.
Lorsque cette chronologie est respectée, les résultats cliniques sont à la hauteur des attentes des patients et des cliniciens car un simple « petit détartrage » sur un parodonte infecté peut conduire à la présence d’abcès et de pertes d’attache réactivées (Fig. 6).
Pathogénie
Le modèle de pathogénèse qui explique la destruction du parodonte est basé sur le dysfonctionnement des monocytes (6).
Chez la plupart des sujets, les bactéries pathogènes productrices d’endotoxines (lipopolysaccharides) sont éliminées rapidement et efficacement par le système immunitaire. L’initiation de ce système est provoquée (en autres) par l’interleukine 1ß (IL1ß) syntéthisée et excrétée principalement par les monocytes et les macrophages (Reynolds et Meikle, 1997).
En revanche, si les monocytes (en présence d’endotoxines) produisent de trop grandes quantités d’IL1ß, le métabolisme du collagène par les fibroblastes parodontaux sera perturbé avec blocage de sa synthèse et accélération de sa dégradation (Reynolds et Meikle, 1997) (Fig. 7).
Cette dysfonction des monocytes a été démontrée notamment chez les patients dont la glycémie n’est pas contrôlée, chez les patients « dépressifs » et chez les patients fumeurs (1) (Shapira et al., 2000) (Genco, 1993) (Grossi et al., 1996). Cependant, les monocytes peuvent dysfonctionner en l’absence des conditions citées ci-dessus chez des patients dont le gène codant pour l’ILß est dysfonctionnel (« polymorphisme génétique ») (Kornman et al., 1997).
Implications cliniques
Il existe aujourd’hui un test fiable, simple, non invasif, peu coûteux (Test PST) qui permet de savoir si oui (patient PST positif) ou non (patient PST négatif) le gène est dysfonctionnel.
Conclusion
Il apparaît donc qu’il est primordial d’établir – avant toute manoeuvre thérapeutique – un diagnostic étiologique. Considérant les recherches sur l’étio-pathogénie, il nous semble qu’il faille utiliser celles-ci afin améliorer la santé parodontale des patients et de notre responsabilité de traiter ces maladies (parodontite agressive) avec une approche médicale.
Bibliographie sélective
1. Breivik T., Thrane P.S., Murison R., Gjermo P. Emotional stress effects on immunity, gingivitis and periodontitis. Eur J Oral Sc 1996 ; 104 : 327-34
2. Charon J., Mouton C. Étiologie des maladies parodontales. Parodontie médicale, Éd. CdP 2003; 113-126
3. Darveau RP, Tanner A, Page RC. The microbial challenge in periodontitis. Periodontol 2000 1997 ; 14 : 12-37.
4. Kornman K.S., Page R.C., Tonetti M.S. The host response to the microbial challenge in periodontitis: assembling the players. Periodontol 2000 1997 ;14 : 33-53
5. Nassar H., Kantarci A., Van Dyke T.E. Diabetic periodontitis: a model for activated innate immunity and impaired resolution of inflammation, Periodontol 2000 2007 ; 43 : 233-244
6. Page R.C., Offenbacher S., Schroeder H.E., Seymour G.J., Kornman K.S. Advances in the pathogenesis of the periodontitis : summary of développements, clinical implications and future directions. Periodontol 2000 1997; 14 : 216-48
7. Ryder M. The influence of smoking on host responses in periodontal infections, Periodontol 2000 2007 ; 43 : 267-277
8. Socransky S., Haffajee A.D. The bacterial etiology of destructive periodontal disease: current concepts. J Periodontol. 1992 ; 63 : 322-331
9. Socransky S., Haffajee A.D., Cugini M.A., Smith C., Kent R.L. Jr. Microbial complexes in subgingival plaque. J Clin Periodontol 1998: 25: 134–144
10. van Dyke T.E., Taubman M.A., Ebersole J.L., Haffajee A.D., Socransky S., Smith D.J., Genco R.J. The Papillon-Lefèvre syndrome: neutrophil dysfunction with severe periodontal disease. Clin Immunol Immunopathol. 1984 ; 31 : 419-29