L’élimination du tartre reste toujours une étape importante quasi-incontournable de tous les types de traitements parodontaux quels qu’ils soient. La question est de savoir pourquoi, quand et comment procéder au « détartrage » afin d’atteindre les buts fixés conjointement par le patient et le praticien. Ce court article essaie de répondre à ces questions. Il décrit également une nouvelle technique d’élimination des spicules de tartre pour que les patients et les praticiens soient satisfaits.
Le détartrage est probablement un des actes les plus couramment réalisés dans un cabinet d’omnipratique.
Un certain nombre de paradigmes, largement ancrés chez les praticiens comme chez les patients, déterminent la façon dont il est couramment pratiqué :
(1) le détartrage ne peut faire que du bien
(2) le détartrage peut être répété autant de fois que désiré ou demandé
(3) le détartrage peut être pratiqué avec vigueur (i.e. « détartrage profond »)
(4) le détartrage peut être réalisé d’emblée dès le premier contact
(5) le détartrage peut être réalisé par un débutant sans inconvénient majeur.
Il n’est pas impossible que ces affirmations méritent une « révision » à la fois dans les concepts et leurs applications.
Le but de cet article est d’examiner pourquoi et comment l’élimination du tartre peut être modifiée, voire améliorée, pour que son efficacité soit augmentée à la satisfaction conjointe des praticiens et des patients.
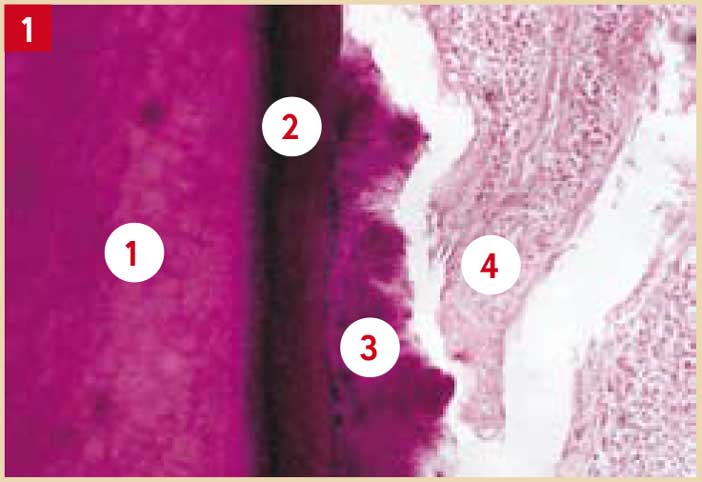
Fig. 1 : histologie d’un spicule de tartre adhérent au cément et recouvert de plaque. Il fait face à un tissu gingival ulcéré ; dans cette situation, aucune ré-attache n’est possible. (1) dentine, (2) cément, (3) spicule de tartre recouvert de plaque bactérienne, (4) tissu gingival ulcéré
Qu’est-ce que le tartre ?
Le tartre résulte de la minéralisation intra et extracellulaire du biofilm microbien (i.e. plaque dentaire) (Fig. 1) (Schroeder, 1969). Il est composé de cristaux dont la nature et la composition varient selon la nature de la plaque bactérienne ainsi que de sa localisation (Fairbrother et Heasman, 2000).
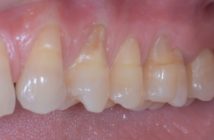
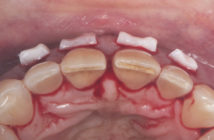
Il est recouvert de micro-organismes vivants et morts. Il a été montré très tôt que les micro-organismes pathogènes à la surface et au sein du tartre rendent probablement les gains d’attache impossibles (Allen et Kerr, 1965). En revanche, lorsque la flore est compatible avec la santé parodontale, le tartre peut être associé à la stabilité de l’attache épithélio-conjonctive. On connaît ces cas où le tartre est abondant sans perte d’attache (Fig. 2).
Fig. 2a et 2b : cas clinique où la présence de tartre est compatible avec le maintien du niveau de l’attache ; cette patiente de 55 ans ne souffre que d’une banale gingivite chronique stable malgré une absence quasi totale de visite chez le dentiste pendant des dizaines d’années Fig. 3: localisation du tartre supra-gingival (flèches) Fig. 4 : exemple de tartre sous-gingival (flèches)
Où se trouve le tartre ?
Il existe deux sortes de tartre selon qu’il se situe au-delà ou en deçà de la gencive marginale (pour revue voir Fairbrother et Heasman, 2000) :
- le tartre supra-gingival trouve sa source minérale (notamment le calcium) dans la salive (d’où l’ancien nom de tartre « salivaire ») et les aliments (Fig. 3). Sa coloration, au départ blanchâtre, se modifie en fonction des aliments et des boissons ingérés ainsi que de l’éventuelle consommation de tabac (sous toutes ses formes, légales ou illégales)
- le tartre sous-gingival se minéralise à partir des sels inorganiques contenus dans le fluide gingival (d’où l’ancien nom de tartre « sérique ») et dans le sang (d’où sa couleur brunâtre due à la dégradation de l’hémoglobine) (Fig. 4).
D’autre part et en moyenne, environ la moitié de la surface de la racine est occupée par le tartre sous-gingival (Richardson, Chadroff et Bowers, 1990). Il n’est donc pas nécessaire d’instrumenter la totalité de la surface radiculaire.
Il est très important de savoir qu’il n’y a pas de tartre radiculaire sous l’attache épithélio-conjonctive (ce qui n’a jamais pu être expliqué). On en déduit que si le détartrage entraîne un saignement, c’est que l’instrument (curette, sonde, détartreur sonique ou ultrasonique) a rompu cette attache puisque les epithelia de jonction, sulculaire et de la poche ne sont pas vascularisés (Fig. 5).
En termes clairs, il résulte qu’il n’est donc pas utile d’instrumenter la partie de la racine qui ne contient pas de tartre et que l’émission de sang lors de son élimination doit être nulle ou minimale (en tout cas, non recherchée).
Pourquoi faut-il éliminer le tartre ?
Il existe trois raisons majeures pour justifier l’élimination la plus complète possible du tartre.
- En omnipratique, la plupart des patients demandent un « petit détartrage » pour des raisons cosmétiques à des fréquences variées (une à deux fois par an). Cette demande est licite puisque le tartre est très souvent pénalisant au niveau esthétique (Fig. 6). Cependant, très peu de patients font la relation tartre-perte d’attache. D’autre part, certains d’entre eux confondent polissage avec détartrage.
- La deuxième raison pour justifier l’élimination du tartre est qu’il représente un obstacle aux gains d’attache. Malgré le fait qu’il ait été montré, au niveau microscopique et de manière anecdotique, que l’épithélium pouvait s’attacher à des spicules microscopiques de tartre, il est admis que cela ne peut pas être considéré comme reproductible (Listgarten et Ellegard, 1973).
- Enfin, la présence de tartre à l’entrée de la poche ou du sulcus crée, ipso facto, un environnement anaérobie ce qui représente une des conditions pour que les bactéries du complexe rouge de Socransky puissent proliférer (Socranky et al., 1998).
Quand faut-il éliminer le tartre ?
Il semblerait que l’élimination du tartre (surtout vigoureuse) lorsque le parodonte est infecté soit synonyme de perte d’attache, voire d’abcès après détartrage (Fig. 7).
En effet, Noël Claffey du Trinity College de Dublin a montré que le détartrage conventionnel régulier, surtout au niveau des poches peu profondes, pouvait entraîner des pertes d’attache (Claffey, 1990).
Les endodontistes l’ont compris car ils n’interviennent que très rarement au niveau des canaux en période d’infection active de peur de déclencher ce qu’ils nomment un « Flare up » (Walton et Fouad, 1992).
Nous proposons donc de procéder à l’élimination du tartre supra et sous-gingival à la condition que l’infection parodontale soit d’abord mise au repos clinique (absence de saignement, d’halitose, de suppuration, diminution ou arrêt des mobilités et/ou des migrations) et micro-biologique (absence ou forte diminution des bactéries non compatibles avec la santé parodontale) (Charon, 2009).
Ceci est très souvent obtenu en quelques semaines d’observance des soins locaux adéquats de contrôle de plaques, avec ou sans prescription d’un antibiotique (Fig. 8).
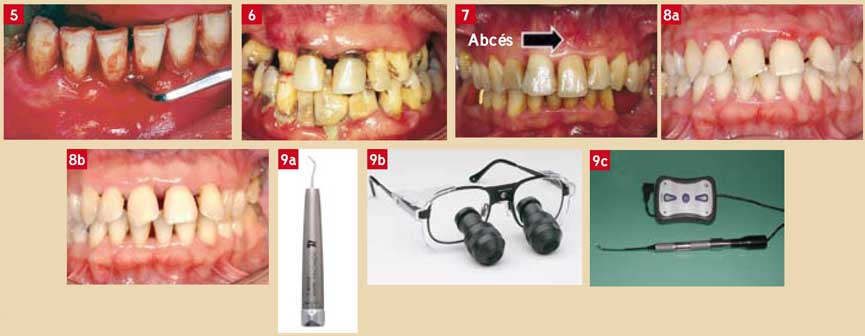
Fig. 5 : tentative brutale d’élimination du tartre sans respect des tissus parodontaux Fig. 6 : aspect inesthétique du tartre ; dans ce cas, le patient consultait pour un détartrage avant une cérémonie ! Fig. 7 : présence d’un abcès apparu une semaine après un détartrage conventionnel sur une parodontite active Fig. 8a et 8b : parodontite active (a) avant les soins locaux et (b) un mois après les soins locaux ; noter le retour à un tissu gingival sain et la fermeture « spontanée » du diastème 21/22 alors que le tartre est encore présent Fig. 9a, 9b et 9c : matériel nécessaire pour la réalisation d’une lithotritie parodontale. (a) SonicFlex® (Kavo™), (b) Binoculaires (Dentalis™), (c) fibre optique (Dentalis™)
Avec quoi faut-il éliminer le tartre ?
Afin de respecter le cément chaque fois qu’il est nécessaire (ce qui est souvent le cas dans les parodontites agressives), nous préconisons l’emploi d’un instrument infra-sonique tel que le SonicFlex® (Kavo™) (Laurell et Pettersson, 1988) (AAP, 2001) (Fig. 9a). Cet instrument est capable de fournir 3 000 à 6 000 cycles par seconde ce qui permet d’intervenir sans douleur. L’emploi de l’insert universel est souvent suffisant pour avoir accès au tartre sous-gingival.
D’autre part, puisque la difficulté est d’avoir le meilleur accès visuel possible du tartre, nous recommandons l’emploi de loupes (Fig. 9b) et d’une trans-lumination à l’aide d’une fibre optique (Johnson et al., 1989) (Fig. 9c). Pour les praticiens qui possèdent un microscope opératoire, son utilisation augmentera considérablement son efficacité (Fig. 10).
Il est également possible d’utiliser le PerioScan® (Sirona, Siemens™) qui possède un dispositif permettant d’avoir un contrôle visuel et auditif de la présence ou de l’absence de spicules de tartre sousgingival (Fig. 11).
Enfin, il existe un laser (K3®, Kavo™) qui permet l’ablation du tartre mais également de vérifier qu’il a bien été éliminé. Cependant, son coût semble excessif pour ceux qui n’en ont l’usage qu’en parodontie (Muller et al., 2010). De plus, il reste à déterminer l’impact d’un rayonnement laser sur le cément.
Quel que soit l’outil utilisé, la durée nécessaire pour l’élimination du tartre peut varier d’une à cinq heures de fauteuil selon la quantité, la nature, la localisation et l’adhérence des spicules de tartre. Son temps augmente également en présence de prothèses et d’éventuelles difficultés d’ordre psychologique. Ceci inclut évidemment un entretien avant et après les soins. On voit immédiatement les conséquences financières et le « conflit » avec la nomenclature des actes en parodontie.
Comment faut-il éliminer le tartre ?
L’approche décrite ci-dessous se réfère et se base sur celle qu’utilisent les médecins et chirurgiens (urologues, stomatologues, chirurgiens digestifs) qui ont, eux aussi, à éliminer des calculs en prenant toutes les précautions pour ne pas léser les tissus sains environnant les calculs. Puisque nos confrères ont baptisé cette technique « lithotritie », nous prenons le risque de les copier et de nommer notre approche de l’élimination du tartre « Lithotritie parodontale » (Charon, 2009). Nous pensons que cette dénomination est licite car la lithotritie parodontale est suffisamment éloignée du détartrage décrit et couramment enseigné pour l’élimination du tartre (i.e. « détartrage parodontal profond » quelquefois sous anesthésie).
L’habitude veut que l’on pratique l’élimination du tartre par quadrant ou par sextant. Cette approche conventionnelle présente deux inconvénients. Le premier est que la cicatrisation des lésions se fait de manière asynchrone.
Le second est que le patient peut avoir l’impression que la bouche n’est pas prise en charge globalement. C’est une des raisons pour laquelle certains cliniciens ont décrit une technique dite de « Full Mouth Approach » (Quirynen et al., 1999).
D’autre part, comme les sites à risque majeur sont les espaces interdentaires, le tartre des faces interproximales sera éliminé en priorité.
Enfin, il semble plus prudent d’éliminer le tartre en procédant de la superficie vers la profondeur. En effet, avec cette approche, le risque de léser l’attache épithélio-conjonctive est faible.
À chaque séance, il est conseillé de vérifier, à l’aide d’un sondage adéquat (inférieur à 50 grammes de pression), la cicatrisation et la fermeture des lésions. Pour permettre la maturation du parodonte profond, un temps de 1 à 2 mois sera laissé entre chaque séance de lithotritie (Listgarten, Lindhe et Hellden, 1992) (Rosling et al., 1976) (Saglie, 1977).
Que peut-on espérer de l’élimination du tartre ?
Après mise au repos de l’infection, l’élimination du tartre se justifie essentiellement par la possibilité de fermer les lésions parodontales (Rosling et al., 1976) (Bowers et al., 1989). Évidemment, la cicatrisation des lésions est conditionnée par l’observance thérapeutique des soins locaux qui assure la pérennité des résultats (Fig. 12).
La cicatrisation des lésions parodontales se fait d’abord par l’adhésion de l’épithélium de jonction à la surface de la racine puis, si possible, par la fixation des fibres supracrestales au cément à la condition qu’il ne soit pas éliminé par surfaçage. Cependant, l’épithélium de jonction peut être de longueur supérieure à celle d’un épithélium de jonction sain et normal. On parle alors de « long épithélium de jonction » qui peut atteindre plusieurs millimètres.
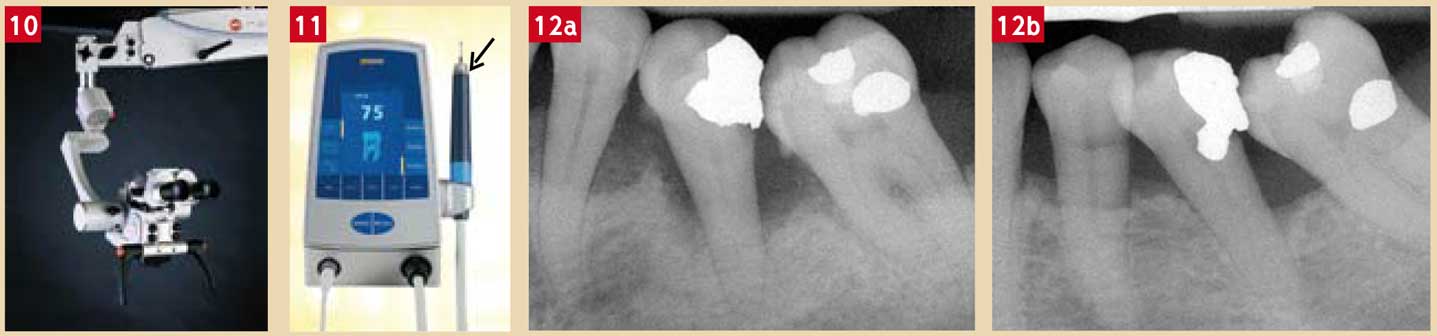
Fig. 10 : microscope opératoire qui permet une vision parfaite du tartre (Kaps®, 3M Concept ™) Fig. 11 : PerioScan® (Siemens™) : dispositif ultrasonique (piézo-électricité) utilisé pour l’élimination du tartre ; l’anneau vert lors de l’introduction délicate de l’insert en contact avec la surface de la racine suggère l’absence de tartre ; si l’anneau est bleu, il est fort possible qu’il reste du tartre sur la racine (flèche) Fig. 12a et 12b : radiologie de lésions parodontales (a) avant élimination du tartre sous-gingival et (b) après son élimination ; noter les changements radiologiques
Conclusion
Même si certaines études ont montré que la suppression totale du tartre ne pouvait être atteinte que très rarement (Kepic, O’Leary et Kafrawy, 1990) (Sherman et al., 1990), on voit qu’il est possible d’éliminer suffisamment de tartre pour que les lésions parodontales cicatrisent et que les patients puissent garder leurs dents.
Le pré-requis pour que la lithotritie parodontale soit efficace est d’obtenir d’abord une parodontite au repos clinique et micro-biologique.
Il reste à résoudre la question de savoir si la présence de tartre est l’expression d’une réaction efficace de l’organisme ou s’il s’agit au contraire d’une maladie en soi.
Bibliographie
1. Allen D.L. et Kerr D.A. – Tissue response in the guinea pig to sterile and non sterile calculus. J Periodontol 36 : 121 – 126, 1965.
2. American Academy of Periodontology. Sonic and ultrasonic scalers in periodontics. – J Periodontol 71 : 1792 – 801, 2001.
3. Bowers G.M., Chadroff B., Carnavale R., Mellonig J., Corio J., Emerson J., Stevens M. et Romberg E. – Histologic evaluation of new attachment apparatus formation in humans. Part III. J Periodontol 60 : 683 – 693, 1989.
4. Charon J. – Parodontie Médicale. Innovations cliniques. CDP éd., Paris, 2009
5. Claffey N. – Comment gagner ou perdre de l’attache parodontale. J Parodontol 13 : 193 – 202, 1990.
6. Fairbrother K.J. et Heasman P.A. Anticalculus agents. – J Clin Periodontol 27 : 285 – 301, 2000.
7. Johnson G.K., Reinhardt R.A., Tussing G.J. et Rrojci R.F. – Fiber optic probe augmented scaling versus conventional scaling. J Periodontol 60 : 131 – 136, 1989.
8. Kepic T.J., O’Leary T.J. et Kafrawy A.H. – Total calculus removal : an attainable objective ? J Periodontol 61 : 16 – 20, 1990.
9. Laurell L. et Pettersson B. – Periodontal healing after treatment with either the Titan-S® sonic scaler or hand instruments. Swed Dent J 12 : 187 – 192, 1988.
10. Listgarten M.A. et Ellegaard B. – Electron microscopic evidence of a cellular attachment between junctional epithelium and dental calculus. J Periodontal Res 8 : 143 – 150, 1973.
11. Listgarten M.A., Lindhe J. et Hellden L. – Effect of tetracycline and/or scaling on human periodontal disease, clinical, microbiological and histological observations. J Clin Periodontol 5 : 246 – 337, 1992.
12. Müller P., Guggenheim B., Attin T., Marlinghaus E. et Schmidlin P.R. – Potential of shock waves to remove calculus and biofilm. Clin Oral Investig. 2010.
13. Quirynen M., Mongardini C., Pauwels M., Bollen C.M., van Eldere J. et van Steenberghe D. – One stage full-versus partial-mouth disinfection in the treatment of chronic adult or generalized early-onset periodontitis. II. Long-term impact on microbial load. J Periodontol 70 : 646 – 656, 1999.
14. Richardson A.C., Chadroff B. et Bowers G.M. – The apical location of calculus within the intrabony defect. J Periodontol 61 : 118 – 122, 1990.
15. Rosling B., Nyman S., Lindhe J. et Jern B. – The healing potential of periodontal tissues following different techniques of periodontal surgery in plaque free dentitions. J Clin Periodontol 13 : 233 – 250, 1976.
16. Saglie F.R. – A scanning electron microscopic study of the relationship between the most apically located subgingival plaque and the epithelial attachment. J Periodontol 48 : 105 – 115, 1977.
17. Schroeder H.E. – Formation and inhibition of dental calculus. Berne : Hans Huber Publishers, 1969.
18. Sherman P.R., Hutchens L.H. Jr, Jewson L.G., Moriarty J.M., Greco G.W. et McFall W.T. Jr. – The effectiveness of subgingival scaling and root planing. I. Clinical detection of residual calculus. J Periodontol 61 : 3 – 8, 1990.
19. Socransky S.S., Haffajee A.D., Cugini M.A., Smith C. et Kent R.L. – Microbial complexes in subgingival plaque. J Clin Periodontol 25 : 134 – 144, 1998.
20. Stambaugh R.V., Myers G., Ebling W., Beckman B. et Stambaugh K. – Endoscopic visualization of the submarginal gingiva dental sulcus and tooghe root surfaces. J Periodontol 73 : 374 – 382, 2002.
21. Walton R. et Fouad A. – Endodontic interappointment flare-Ups : A prospective study of incidence and related factors. J of endodontics 18 (4) : 172 – 177, 1992.