Les techniques de concentrés plaquettaires ont été introduites il y a 13 ans. Les preuves cliniques et expérimentales de l’efficacité du PRF existent mais il persiste toujours plusieurs questions : pourquoi, comment et quel tissu y est sensible ? Les publications récentes (nombreuses) permettent d’y voir un peu plus clair.
Cicatrisation et facteurs de croissance
a. Les plaquettes sanguines
L’idée d’utiliser de la fibrine en clinique revient à Tayapongshak (1) en 1994. Les plaquettes sanguines renferment des cytokines ou facteurs de croissance qui sont responsables des cascades de réactions qui gèrent la cicatrisation tissulaire. Ces cytokines sont libérées au moment de la dégranulation des plaquettes initiée par la coagulation et la constitution du caillot. La présence de leucocytes est fondamentale pour la formation d’un thrombus homogène et physiologique (3,4). Les facteurs de croissance initient les premières phases de la cicatrisation : néo-angiogenèse et stimulation cellulaire.
b. La cicatrisation
Elle débute par la formation d’un caillot de fibrine qui contient des plaquettes, des leucocytes et de la fibrine.
La fibrine est la principale matrice de cicatrisation dont dispose l’organisme : il est impossible de cicatriser sans fibrine. C’est dire l’importance capitale de cette molécule dérivée du fibrinogène circulant.
c. Les conditions cellulaires de l’action des cytokines
Pour obtenir une stimulation tissulaire, les cytokines doivent être en contact avec des cellules vivantes. Tous les types de cellules sont stimulés par les cytokines (5).
On peut comprendre pourquoi les cytokines stimulent toujours les tissus mous : la disponibilité des cellules fibroblastiques est immédiate avec un résultat clinique rapidement visible. Lorsqu’une greffe osseuse ou un comblement osseux sera réalisé, l’efficacité des cytokines dépendra de la teneur en cellules dans le comblement au cours des premières heures ou premiers jours. La croissance des néo-vaisseaux, stimulée par le VEGF permet d’apporter des cellules souches dans le site (13).
Le PRF ?
Le PRF ou Platelet Rich Fibrin (2) est tout simplement un caillot de fibrine qui s’est constitué naturellement pendant que le sang coagule dans le tube, la centrifugation n’ayant pour seul effet que de séparer les différents éléments. Le caillot de fibrine contient la forme moléculaire naturelle de la fibrine, à l’inverse du PRP. La présence de leucocytes dans le caillot permet également d’avoir une configuration physiologique du thrombus.
Cette approche naturelle du caillot est appréciée par de nombreux auteurs (6). La récente découverte de quantités importantes de protéines d’adhésion dans l’exsudat du PRF a justifié la modification du protocole du PRF (PRF Box).
Cinétique de libération et mécanisme d’action du PRF
La présence de fibrine et de leucocytes est responsable d’un mécanisme de libération original : les cytokines produites par les plaquettes et les leucocytes sont libérées progressivement dans le milieu par la membrane pendant plus de sept jours : VEGF, PDGF, TGFβ, thrombospondine (5). Mais ce qui est étonnant, c’est que l’on va retrouver dans le milieu, au bout de 7 jours, des quantités beaucoup plus importantes de cytokines que celles retrouvées dans la membrane immédiatement après la centrifugation ! Le PRF est-il une usine à cytokines ? Vraisemblablement, en raison de la présence des leucocytes qui, seuls, peuvent produire ces cytokines ou alors ce sont des cellules non encore identifiées qui sont chargées de cette tâche. Cette libération lente, progressive et continue a 2 conséquences :
- les quantités libérées par heure sont faibles et sont donc tout à fait compatibles avec un effet clinique
- cette libération prolongée permet éventuellement de parer, du moins au début, à l’absence de cellule dans le site et permet d’attendre leur arrivée. Ces cellules seront stimulées dès leur arrivée sur le site.
La membrane de PRF est-elle une barrière ?
Oui, la membrane est une barrière cellulaire mais elle ne peut jouer ce rôle que pendant un temps réduit : entre 7 et 15 jours. On peut alors conclure que ce rôle limité dans le temps va dépendre de la vitesse d’installation de la matrice osseuse. Si la matrice osseuse s’installe rapidement, alors une ou plusieurs membranes de PRF suffisent. Si la matrice n’est pas installée, il faudra alors utiliser une membrane plus durable : collagène ou mieux, péricardique : stabilité de l’ordre de 4 mois ou une membrane non résorbable. Une étude récente (8) montre la supériorité de la membrane de PRF sur la membrane collagène dans son aptitude à stimuler les cellules périostées. Mais une membrane de PRF ne peut remplacer une membrane à résorption longue. Par contre, l’association du PRF à une barrière ne peut être que bénéfique, le PRF jouant parfaitement son rôle de stimulant des cellules présentes avec la néo-angiogenèse en plus. On comprend que le choix du biomatériau va influer sur la qualité de la stimulation par le PRF : il y a des biomatériaux qui se comportent comme de véritables « aimants » envers les cellules osseuses.
Utilisation clinique du PRF
L’effet clinique dépend de la concentration cellulaire du site.
a. Tissus mous
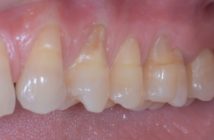
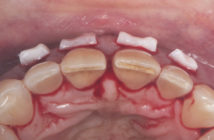
L’efficacité des facteurs de croissance n’est pas contestée : la stimulation de la croissance des cellules est facile car les cellules des tissus gingivaux sont immédiatement disponibles. Les résultats sont constants et la cicatrisation muqueuse est toujours améliorée avec un effet certain sur la croissance du tissu kératinisé (11). (Cas clinique 1: Del Corso M.)
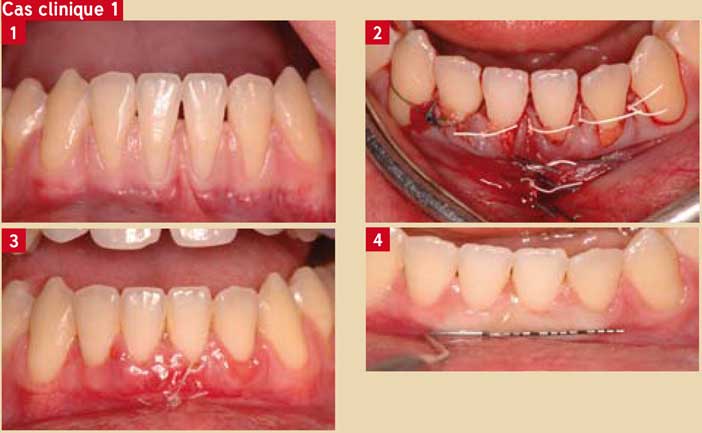
Fig. 1 : récession gingivale Fig. 2 : traitement + PRF Fig. 3 : cicatrisation à 20 jours Fig. 4 : cicatrisation à 9 mois
b. Tissus durs
L’effet du PRF va dépendre de la disponibilité des cellules dans le site. Ce qui nous amène à distinguer deux types de sites : les sites naturellement riches en cellules (sites d’extraction et cavité sinusienne) et les sites pauvres en cellules (greffes d’apposition avec des biomatériaux).
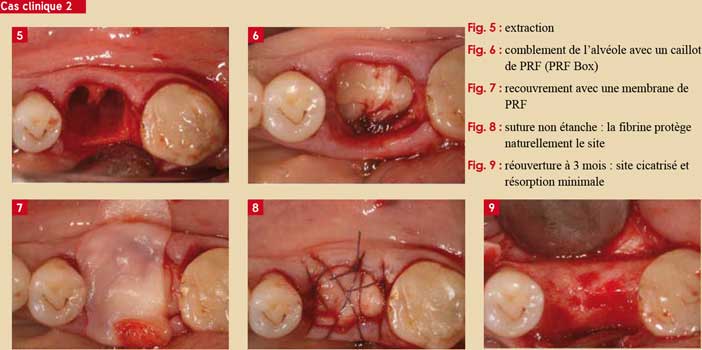
1. Sites d’extraction
Les alvéoles sont naturellement riches en cellules osseuses et progénitrices. L’application de membranes de PRF dans les alvéoles provoque une cicatrisation accélérée.
Le meilleur facteur de cicatrisation d’une alvéole est le caillot sanguin : le PRF est un caillot sanguin plus concentré.
La reconstruction est facilitée et accélérée. Ce qui fait du PRF le meilleur matériau de comblement des alvéoles à condition que les parois osseuses soient conservées. Un phénomène fréquemment observé : le PRF permet de réduire sensiblement la résorption osseuse post extractionnelle.
S’il y a une déhiscence pariétale, l’utilisation de biomatériaux est alors fortement conseillée. L’ajout de PRF dans le comblement ne fera qu’accélérer la formation osseuse. (Cas clinique 2 : Del Corso M).
2. Sinus lifts
La cavité sinusienne offre les meilleures conditions pour la croissance osseuse : la paroi du sinus est tapissée de cellules périostées et la membrane de Schneider est recouverte de cellules progénitrices lui procurant le statut « ostéogénique » (7). La réussite de la greffe intra sinusienne est donc facile : tous les biomatériaux donnent de bons résultats dans les sinus-lifts (9). Le PRF va naturellement accélérer la croissance de l’os nouveau. Ces conditions cellulaires favorables expliquent également le succès obtenu par les greffes sinusiennes n’utilisant que le PRF comme biomatériau de comblement (10, 14) : la fibrine joue son rôle de matrice et les facteurs de croissance stimulent les cellules présentes dans le site. Résultat : une croissance osseuse rapide avec des temps de cicatrisation réduits de moitié (12). La stabilité de l’os obtenu est constante à cinq ans. (Cas clinique 3 : Simonpieri A).
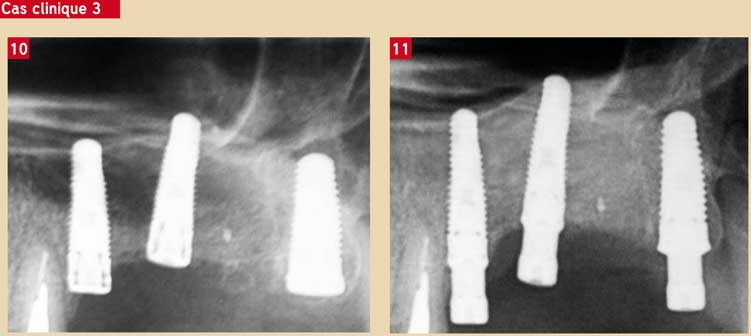
Fig. 10 : comblement sinusien avec PRF seul Fig. 11 : cicatrisation à 6 mois
3. Greffes d’apposition
La difficulté de ces procédures tient au fait que la disponibilité immédiate des cellules est réduite (les cellules ne peuvent venir que de la surface osseuse native). La libération prolongée des facteurs de croissance est un atout déterminant pour accélérer la formation osseuse. Mais si le biomatériau n’a pas la faculté d’attirer les cellules rapidement, alors les facteurs de croissance seront peu efficaces. D’où le choix délibéré d’un biomatériau apte à créer ces conditions favorables ou alors l’utilisation d’une membrane de protection sera inévitable. La présence de PRF sera toujours bénéfique à un comblement osseux à condition que le biomatériau soit rapidement envahi de cellules osseuses.
Conclusion
On ne peut pas tout attendre du PRF : il ne peut que stimuler puissamment des cellules présentes et accélérer la revascularisation du site. Il peut être une aide certaine à la fermeture accélérée des lambeaux et favoriser la reconstruction osseuse lorsque les conditions cellulaires sont favorables. Mais les voies de recherche actuelles nous incitent à approfondir notre connaissance sur les cellules que le PRF peut contenir et également nous orienter vers la chronobiologie : on sait que de nombreux mécanismes hormonaux et cellulaires varient dans leur intensité et leur spécificité en fonction du nycthémère : c’est une des voies qui nous permettrait de progresser dans l’amélioration de nos protocoles cliniques. Nous avons bon espoir d’y répondre prochainement.
Bibliographie
1. TAYAPONGSHAK P, O’BRIEN DA, MONTEIRO CB, ARECEO-DIAZ LY. Autologus fibrin adhesive in mandibular reconstruction with particulate cancellous bone and marrow. J Oral Maxillofac Surg 1994 Feb;52(2):161-5
2. CHOUKROUN J, ADDA F, SCHOEFFLER C, VERVELLE A. Une opportunité en paro-implantologie. Implantodontie 2001 vol.42 ;55-62
3. DOHAN DM, CHOUKROUN J, DISS A, Platelet-rich fibrin (PRF): a second generation platelet concentrate. Part 1; technological concepts and evolution. Oral Surg Oral Med Oral Pathol Oral Radiol Endod. 2006 Mar;101(3)
4. WOHNER N. Role of Cellular Elements in Thrombus Formation and Dissolution Cardiov. & Hematol. Ag.Med Chem, 2008, 6, 224-228
5. DOHAN D, DEPEPPO G, DOGLIOLI P, SAMMARTINO G : Slow release of growth factors and thrombospondin-1 in Choukroun’s PRF: a gold standart to achieve for all surgical platelet concentrates technologies. Growth Factors feb 2009
6. DOHAN EHRENFEST DM, RASMUSSON L, ALBREKTSSON T. Classification of platelet concentrates: from pure platelet-rich plasma (P-PRP) to leucocyteand platelet-rich fibrin (L-PRF).Trends Biotechnol. 2009 Mar;27(3):158-67
7. SROUJI S, KISHNER T. BEN DAVID D; RIMINUCCI M. BIANCO P LIVNE E. The Schneiderian Membrane Contains Osteoprogenitor Cells :In Vivo and In Vitro Study. Calcif Tissue Int (2009) 84:138–145
8. GASSLING V, DOUGLAS T, WARNKE PH, WILTFANG J, BECKER ST. Platelet-rich fibrin membranes as scaffolds for periosteal tissue engineering. Clin. Oral Impl. Res. 21, 2010; 543–549
9. PIATTELLI A. Maxillary sinus augmentation with different biomaterials: Comparative histologic and histomorphometric study in man Implant Dentistry 2006 10. DISS A. et al. Osteotome sinus floor elevation using Choukroun’s platelet-rich fibrin as grafting material: a 1-year prospective pilot study with microthreaded implants. OOOE may 2008, 105(5):572-9
10. AROCA S. KEGLEVICH T; BARBIERI B. GERA I. ETIENNE D. Evaluation of a Modified Coronally Advanced Flap Alone or in Combination With a Platelet-Rich Fibrin Membrane forthe Treatment of Adjacent Multiple Gingival Recessions: A 6-Month Study. J Periodontol. 2009 Feb;80(2):244-52
11. CHOUKROUN J. DISS A. SIMONPIERI A. GIRARD MO. SCHOEFFLER C. DOHAN DM Platelet-rich fibrin (PRF): a second-generation platelet concentrate. Part V: histologic evaluations of PRF effects on bone allograft maturation in sinus lift. Oral Surg Oral Med Oral Pathol Oral Radiol Endod. 2006 Mar;101(3):299-303
12. MOSESSON N.W. Fibrinogen and fibrin structure and functions. Journal of Thrombosis and Haemostasis, 2006.3: 1894–1904 14. MAZOR Z. HOROWITZ R. DEL CORSO M. HARI S. RASAD P. ROHRER M. DOHAN EHRENFEST D. Sinus Floor Augmentation With Simultaneous Implant Placement Using Choukroun’s Platelet-Rich Fibrinas the Sole Grafting Material: A Radiologic and Histologic Study at 6 MonthS. J Periodontol. 2009 Dec;80(12):2056-64.