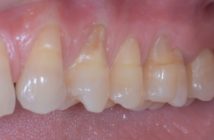
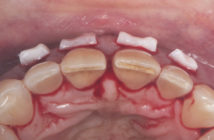
Phénomène inflammatoires et rôle essentiel de l’équilibre nutritionnel et acide / base
Les parodontites sont des lésions du parodonte profond, d’étiologie infectieuse et à manifestation inflammatoire, entraînant la destruction des tissus de soutien de la dent (Listgarten 1986)(1).
Pour comprendre les facteurs déclenchant les pertes d’attache, il est nécessaire de s’appuyer sur le modèle infectieux de Socransky (2) basé sur 4 conditions conjointes
- Présence de bactéries virulentes
- Absence de bactéries protectrices
- Défaillances du système immunitaire
- Environnement dento-gingival défavorable
Défaillances du système immunitaire : Lorsque celui-ci est sollicité par certaines bactéries virulentes (Porphyromonas Gingivalis…) et se retourne (dans certaines conditions acquises ou génétiques) contre l’hôte infecté en intensifiant la réponse inflammatoire et en « sur-produisant » certaines molécules qui, initialement protectrices, deviennent alors destructrices.
En effet, les concentrations abondantes en IL-1 beta, TNFalpha et LPS notamment, induisent la production de collagènases et de prostaglandines PGE2 par les fibroblastes gingivaux et jouent ainsi un rôle majeur dans la pathogénie des pertes d’attaches au cours des parodontites.
Cette contre-réponse auto-immune, activant une réaction inflammatoire exacerbée, entraîne une production importante de dérivés réactifs de l’oxygène, soumettant ainsi les tissus parodontaux à un stress oxydant (Parodontie médicale Charon 2009) (3).
Ainsi, outre la prise en charge parodontale étiologique locale qui s’impose afin de stopper les pertes d’attaches et retrouver la santé du parodonte, il paraît judicieux de s’intéresser aux potentiels adjuvants d’ordre général par exemple l’aspect nutritionnel. Le parodontiste pourrait alors intégrer dans son plan de traitement global, un protocole de « prévention-nutrition » afin de potentialiser la réponse immunitaire « saine » de l’hôte aux thérapeutiques locales.
Le but de cet article est donc de faire le point sur les différents compléments alimentaires susceptibles de prévenir et/ou d’optimiser le traitement parodontal.
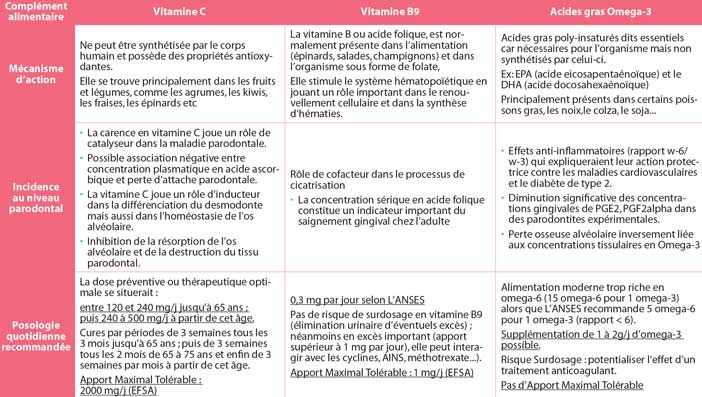
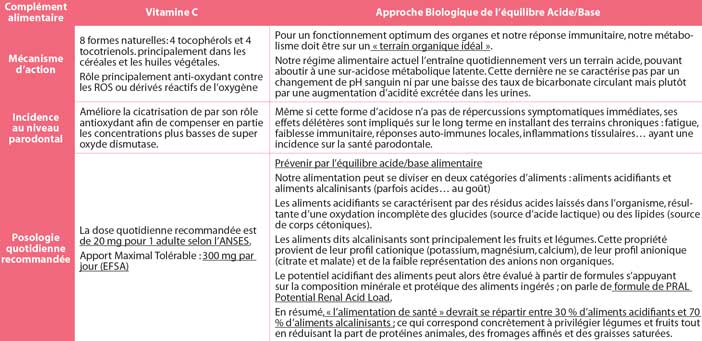
La vitamine C
Mécanisme
La vitamine C ou acide ascorbique ne peut être synthétisé par le corps humain et possède des propriétés antioxydantes permettant, entre autres, de neutraliser les radicaux libres, limitant ainsi le vieillissement de l’organisme et renforçant le système immunitaire. De plus, elle est indispensable à la formation de collagène. La dose quotidienne recommandée par l’ANSES est de 93mg/j.
Elle se trouve principalement dans les fruits et légumes, comme les agrumes, les kiwis, les fraises, les épinards, etc. Il n’y a pas de toxicité avérée en cas de surdosage néanmoins l’étude prospective de Thomas et Al (JAMA 2013) (4) portant sur 20000 hommes pendant 11 ans a montré un lien significatif entre surdosage (1000mg par jour au long cours) et survenue de calculs rénaux.
L’apport Maximal Tolérable est de 2000mg/J selon L’EFSA (European Food Safety Authority)

Fig. 1 : source naturelle de vitamine C
Au niveau parodontal
Dès 1948, Glickman (5) a réalisé une étude sur l’animal (témoin versus carencé) mettant en évidence des œdèmes et des saignements plus importants pour les sujets carencés au niveau de sites recouverts de plaque et surtout des dégénérescences collagéniques.
Il apparaît alors dès la 1re moitié du 20e siècle que la carence en vitamine C joue un rôle de catalyseur dans la maladie parodontale.
De nombreuses études ont ensuite développé le sujet comme celle de Amaliya et coll. (2007) (6) portant sur 128 patients, et ce sur une durée de 3 ans. Les sujets ont eu diverses mesures cliniques (contrôle de plaque, B.O.P, mesure perte d’attache. ) puis une prise de sang afin de doser la concentration plasmatique en acide ascorbique; le tout étant renouvelé 3 ans après. Il est alors ressorti une corrélation basse entre concentration plasmatique en acide ascorbique et perte d’attache parodontale. De nombreuses études suivant celle de Amaliya et coll. Confirment ces faits notamment Staudte et Al (2012) (7).

Fig. 2 : exemples de vitamine C en vente
Enfin, Yan et Al (2013) (8) ont démontré que la vitamine C joue un rôle d’inducteur dans la différenciation du desmodonte, mais aussi dans l’homéostasie de l’os alvéolaire.
De plus Akman et Al (2013) (9) ont mis en évidence l’intérêt de la vitamine C comme outil thérapeutique chez l’animal permettant une inhibition de la résorption de l’os alvéolaire et de la destruction du tissu parodontal.
La dose préventive ou thérapeutique optimale se situerait entre 120 et 240mg/j jusqu’à 65 ans ; puis 240 à 500mg/j à partir de cet âge. Les cures sont recommandées par périodes de 3 semaines tous les 3 mois jusqu’à 65 ans ; puis de 3 semaines tous les 2 mois de 65 à 75 ans et enfin de 3 semaines par mois à partir de cet âge.
La vitamine B9
Mécanisme
La vitamine B ou acide folique est normalement présent dans l’alimentation (épinards, salades, champignons) et dans l’organisme sous forme de folate. Elle stimule le système hématopoïétique en jouant un rôle important dans le renouvellement cellulaire et dans la synthèse d’hématies.
Au niveau parodontal
La vitamine B joue un rôle de cofacteur dans le processus de cicatrisation. En effet, l’étude de Neiva et Al (2005)(10) a permis de démontrer que les gains d’attache clinique suite à une thérapeutique parodontale étaient statistiquement plus importants chez les patients suppléés en acide folique comparativement à un placebo.
Esaki et al. (2010) (11) ont quant à eux démontré sur un échantillon de 497 patients non-fumeurs que la concentration sérique basse en acide folique constitue un indicateur important du saignement gingival chez l’adulte.
Enfin, Akman et Al (2013) (9) avaient associé acide folique et vitamine C pour obtenir un effet thérapeutique positif sur le parodonte lors de leurs expérimentations animales.
En pratique, La dose quotidienne recommandée est de 0,3mg par jour selon L’ANSES, l’Apport Maximal Tolérable défini par l’EFSA est de 1mg/j et les carences sont principalement présentes dans les cas de malnutrition, de tabagisme important, chez les femmes prenant des pilules contraceptives ou encore chez les patients alcooliques chroniques. Enfin, il n’y a pas de risque de surdosage en vitamine B9 (élimination urinaire d’éventuels excès) ; néanmoins en excès important (apport supérieur à 1 mg par jour), elle peut interagir avec les cyclines, AINS, méthotrexate…). L’apport Maximal Tolérable est de 1mg/J selon L’EFSA.

Fig. 3 : source naturelle de vitamine E.
La vitamine E
Mécanisme
Elle existe sous 8 formes naturelles:
4 tocophérols (l’alpha étant le plus actif biologiquement et le gamma le plus abondant dans l’alimentation) et 4 tocotrienols.
Elle est présente principalement dans les céréales et les huiles végétales.
Son rôle est principalement antioxydant contre les ROS ou dérivés réactifs de l’oxygène produits entre autres par l’oxydation des acides gras et dans les parodontopathies par Porphyromonas Gingivalis notamment.
Au niveau parodontal
Peu d’études à l’heure actuelle traitent de la vitamine E, mais si l’on se réfère à celles (expérimentales sur l’animal) de Nelson et Al (1966) (12) et Parrish et Al (1977) (13), il n’y a pas de lien entre déficience en vitamine E et aggravation de parodontites.
Néanmoins, l’étude de Singh et coll. (2014) (14) a démontré un intérêt de cette vitamine pour notre pratique en parodontie: elle améliore la cicatrisation de par son rôle antioxydant afin de compenser en partie les concentrations plus basses de super oxyde dismutase.
En pratique, La dose quotidienne recommandée est de 20mg pour 1 adulte et l’Apport Maximal Tolérable défini par l’EFSA est de 300mg/j.
Les acides gras Omega-3
Mécanisme
Ce sont des acides gras polyinsaturés dits essentiels, car nécessaires pour l’organisme, mais non synthétisés par celui-ci. Ils sont principalement présents dans certains poissons gras, les noix,colza,soja…. La ration quotidienne recommandée est de 500mg par jour si l’on se réfère à l’étude de Gebauer (2006) (15). Il n’y a pas d’Apport Maximal Tolérable d’après l’EFSA.
Les acides gras w-3 ont des effets anti-inflammatoires qui expliqueraient leur action protectrice contre les maladies cardiovasculaires et le diabète de type 2. En effet, l’acide éicosapentaénoïque (EPA) et l’acide docosahexaénoïque (DHA) se lient à un récepteur (GPR120), inhibant l’expression de certains signaux inflammatoires (Young et Al 2010) (16).

Fig. 4 : exemple de supplémentation en Oméga-3.
Au niveau parodontal
Étant donné ce potentiel anti-inflammatoire accordé au rapport Omega-3/ Omega-6, de nombreuses études se sont penchées quant à leur impact sur ces patients atteints de parodontites. L’étude de Naqvi et Al (2010) (17) s’est intéressée à ce lien en se concentrant sur un échantillon de 9182 personnes. Ces sujets ont alors bénéficié d’un examen clinique parodontal et ont rempli un questionnaire nutritionnel très précis. Il en est ressorti que les apports en Omega-3 (surtout en DHA et EPA) sont inversement proportionnels à l’apparition de parodontites; ceux-ci auraient un rôle protecteur par modulation de l’inflammation (Iwasaki et al. 2010) (18).
D’autres études se sont penchées sur le rôle des Omega-3 dans le cadre de la thérapeutique parodontale afin d’évaluer leur rôle en complément alimentaire pendant la période de traitement. Vardar et Al (2004) (19) ont ainsi étudié sur l’animal l’impact de ces acides gras poly insaturés. Il en ressort que ces derniers ont diminué de manière significative les concentrations gingivales de PGE2, PGF2alpha dans des parodontites expérimentales.
Kesavalu et al. (2006) (20) mais aussi Bendyk et Al (2009) (21) se sont concentrés sur les pertes osseuses et oméga-3 chez l’animal et il en ressort que la perte osseuse alvéolaire est inversement liée aux concentrations tissulaires en Omega-3.
Concernant les études sur l’humain, les niveaux de preuve sont encore insuffisants (faibles échantillons), mais les études de El-Sharkawy et al (2010) (22), Elkhouli (2011) (23) et Figueredo et Al (2013) (24) ouvrent des perspectives intéressantes quant à une supplémentation en Omega-3 pour optimiser le succès de la thérapeutique parodontale.
En résumé, dans la mesure où l’ANSES recommande 5 Omega-6 pour 1 Omega-3 (rapport inférieur à 6) et que l’alimentation moderne est riche en Omega 6 (15 pour un Omega-3), une supplémentation de 1 à 2g/j est conseillée néanmoins, il paraît important de rappeler qu’en cas de surdosage, il y a une potentialisation de l’effet des traitements anticoagulants.
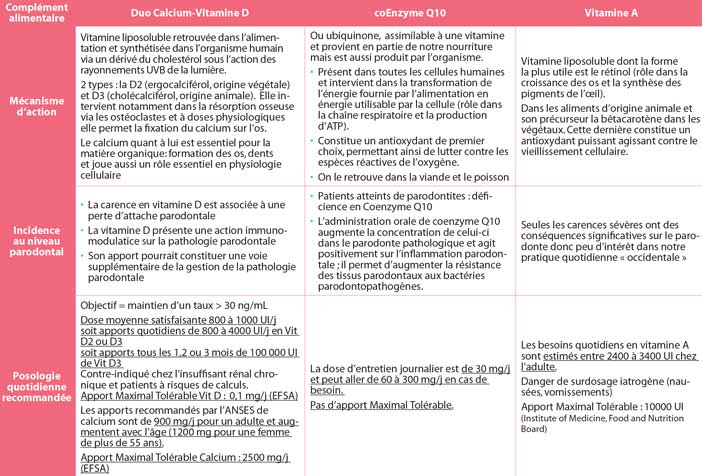
Le duo calcium-vitamine D
Mécanisme
La vitamine D est une vitamine liposoluble retrouvée dans l’alimentation et synthétisée dans l’organisme humain via un dérivé du cholestérol sous l’action des rayonnements UVB de la lumière. On en distingue 2 types: la D2 (ergocalciférol, origine végétale) et D3 (cholécalciférol, origine animale).
Elle intervient notamment dans la résorption osseuse via les ostéoclastes et à doses physiologiques elle permet la fixation du calcium sur l’os. L’académie de médecine évalue la dose journalière à 30 microgrammes. Le calcium quant à lui est essentiel pour la matière organique: formation des os, dents et joue aussi un rôle essentiel en physiologie cellulaire.
Au niveau parodontal
Dès le début des années 2000, le tandem calcium-vitamine D est devenu un centre d’intérêt pour nous, parodontistes. En effet, de nombreuses études ont mis l’accent sur le rôle important joué par ce binôme sur la santé parodontale.
Dietrich et coll (2004) (25) ont démontré au travers d’une étude épidémiologique sur plus de 11000 sujets que la carence en vitamine D est associée à une perte d’attache parodontale. En 2009, Dixon et coll26 ont quant à eux mis en évidence qu’un apport optimal en vitamine D et calcium diminue la résorption osseuse et assure une bonne minéralisation osseuse. De plus, la vitamine D présente une action immunomodulatrice sur la pathologie parodontale. En effet, elle présente des propriétés anti-inflammatoires de par l’inhibition de la production de certaines cytokines et induit la production de polypeptides antimicrobiens trouvés dans les PMN et les macrophages: les cathelicidines.
Miley et coll (2009) (27) ont quant à eux étudié l’impact d’apports de calcium-vitamine D sur des terrains de parodontites chroniques sur une cinquantaine de sujets. Ils en concluent que cet apport pourrait constituer une voie supplémentaire de la gestion de la pathologie parodontale, ce que confirment les travaux de Garcia (2011) (28). Néanmoins, des essais cliniques randomisés sont nécessaires afin de valider ces pistes intéressantes.

Fig. 5 : source naturelle de calcium.
En pratique, la vitamine D peut être prescrite seule ou en association à du calcium, en doses quotidiennes ou en doses espacées, l’espacement pouvant être hebdomadaire à trimestriel.
La dose moyenne est de 800 à 1 200 UI/j correspondant à 5 600 à 7 000 UI par semaine pour les prescriptions hebdomadaires et à 100 000 UI (ampoule buvable) pour les prescriptions trimestrielles (ces dernières étant déconseillées car risques de calculs rénaux et d’ostéophytes)
En cas d’insuffisance ou de carence vitaminique D, un traitement « d’attaque » permet de ramener le taux de 25-(OH)-vitamine D au-dessus de la valeur cible de 30 ng/ml ; à faire confirmer par le médecin traitant au regard de la fonction rénale.
On peut ainsi proposer les schémas d’attaque suivants suivant le taux de :
- 25-OH-D : < 10 ng/ml : 4 prises de 100 000 UI espacées de 15 jours ;
- 10 à 20 ng/ml : 3 prises de 100 000 UI espacées de 15 jours ;
- 20 à 30 ng/ml : 2 prises de 100 000 UI espacées de 15 jours. (Recommandation du Groupe De Recherche et d’Information sur l’Ostéoporose)
Les apports recommandés par l’ANSES de calcium sont de 900mg/j pour un adulte et augmentent avec l’âge (1200mg pour une femme de plus de 55 ans).
L’EFSA a défini pour la vitamine D un Apport Maximal Tolérable de 0,1mg/j et de 2500mg/j pour le calcium.
Le Coenzyme Q10
Mécanisme
Ou ubiquinone, il est assimilable à une vitamine et provient en partie de notre nourriture, mais est aussi produit par l’organisme. Ce coEnzyme est présent dans toutes les cellules humaines et intervient dans la transformation de l’énergie fournie par l’alimentation en énergie utilisable par la cellule (rôle dans la chaîne respiratoire et la production d’ATP). De plus il constitue un antioxydant de premier choix, permettant ainsi de lutter contre les espèces réactives de l’oxygène.
On le retrouve dans la viande et le poisson.
Au niveau parodontal
Dans les années 70, de nombreux travaux ont été publiés quant au rôle adjuvant du coenzyme Q10 dans le traitement des parodontites (Iwamoto et Al 1975 (29), Wilkinson et Al 1976 (30)…), mais ils présentaient un niveau de preuve assez faible (case report…).
L’étude de Littaru et Al (1971) (31) a quant à elle mis en évidence une déficience en coenzyme Q10 chez les patients atteints de parodontites.
La méta-analyse de Prakash et Al (2010) (32) annonces clairement que l’administration orale de coenzyme Q10 augmente la concentration de celui-ci dans le parodonte pathologique et agit positivement sur l’inflammation parodontale. Dès lors, le coenzyme Q10 a un rôle d’aide au traitement de la parodontite chronique et permet d’augmenter la résistance des tissus parodontaux aux bactéries parodontopathogènes.
En résumé, la dose d’entretien journalier est de 30mg/j et peut aller de 60 à 300mg/j en cas de besoin. Il n’y a pas d’Apport Maximal Tolérable défini par L’EFSA.
La vitamine A
Mécanisme
C’est une vitamine liposoluble dont forme la plus utile est le rétinol qui joue un rôle dans la croissance des os et la synthèse des pigments de l’œil. Les besoins quotidiens en vitamine A sont estimés entre 2400 à 3400 UI chez l’adulte. On en retrouve principalement dans les aliments d’origine animale et son précurseur la bêtacarotène dans les végétaux. Cette dernière constitue un antioxydant puissant agissant contre le vieillissement cellulaire. L’Apport Maximal Tolérable est de 10000 UI par jour d’après l’Institute Of Medicine, Food and Nutrition Board.
Au niveau parodontal
Seules les carences sévères ont des conséquences significatives sur le parodonte donc peu d’intérêt dans notre pratique quotidienne « occidentale » d’autant plus qu’il existe un danger de surdosage iatrogène (nausées, vomissements…)
En pratique, peu d’intérêt dans notre approche nutritionnelle de la parodontie.
Approche biologique de l’équilibre acide / base (Rougier et al. 2008) (33)
Pour un fonctionnement optimum des organes et de notre réponse immunitaire, notre métabolisme doit être sur un « terrain organique idéal ». Notre régime alimentaire actuel l’entraîne quotidiennement vers un terrain acide, pouvant aboutir à une suracidose métabolique latente. Cette dernière ne se caractérise pas par un changement de pH sanguin ni par une baisse des taux de bicarbonate circulant, mais plutôt par une augmentation d’acidité excrétée dans les urines.
Même si cette forme d’acidose n’a pas de répercussions symptomatiques immédiates, ses effets délétères sont impliqués sur le long terme en installant des terrains chroniques : fatigue, faiblesse immunitaire, réponses auto-immunes locales, inflammations tissulaires… ayant une incidence sur la santé parodontale.
Prévenir par l’équilibre acide / base alimentaire
Notre alimentation peut se diviser en deux catégories d’aliments : aliments acidifiants et aliments alcalinisant (parfois acides… au goût). Les aliments acidifiants se caractérisent par des résidus acides laissés dans l’organisme, résultante d’une oxydation incomplète des glucides (source d’acide lactique) ou des lipides (source de corps cétoniques).
Les aliments dits alcalinisant sont principalement les fruits et légumes. Cette propriété provient de leur profil cationique (potassium, magnésium, calcium), de leur profil anionique (Citrate et malate) et de la faible représentation des anions non organiques.
Le potentiel acidifiant des aliments peut alors être évalué à partir de formules s’appuyant sur la composition minérale et protéique des aliments ingérés ; on parle de formule de PRAL Potential Renal Acid Load.
En résumé, « l’alimentation de santé » devrait se répartir entre 30% d’aliments acidifiants et 70% d’aliments alcalinisant ; ce qui correspond concrètement à privilégier légumes et fruits tout en réduisant la part de protéines animales, des fromages affinés et des graisses saturées.

Fig. 6 : exemples de compléments alimentaire
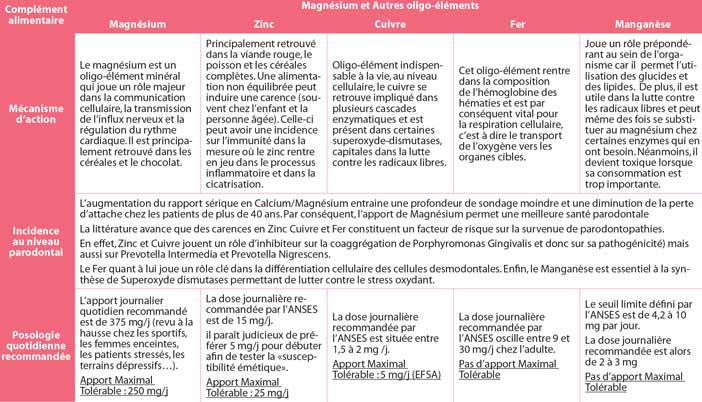
Le magnésium
Mécanisme
Le magnésium est un oligo-élément minéral qui joue un rôle majeur dans la communication cellulaire, la transmission de l’influx nerveux et la régulation du rythme cardiaque. Il est principalement retrouvé dans les céréales et le chocolat.
Au niveau parodontal
Meisel et coll (2005)34 ont étudié l’impact du manque de magnésium sur la maladie parodontale. En se basant sur plus de 4000 sujets âgés de 20 à 80 ans, il a été démontré de manière significative que l’augmentation du rapport sérique en Calcium/Magnésium entraine une profondeur de sondage moindre et une diminution de la perte d’attache chez les patients de plus de 40 ans. Par conséquent, l’apport de Magnésium permet une meilleure santé parodontale, ce que confirme l’étude de Merchant (2006) (35) où le Magnésium diminuerait le risque de maladie parodontale.
En Pratique, L’apport journalier quotidien recommandé est de 375mg/j (revu à la hausse chez les sportifs, les femmes enceintes, les patients stressés, les terrains dépressifs…).
Les autres oligo-éléments : Zinc, Cuivre et Fer
Mécanisme
Le Zinc : principalement retrouvé dans la viande rouge, le poisson et les céréales complètes. Une alimentation non équilibrée peut induire une carence, ce que l’on retrouve souvent chez l’enfant et la personne âgée. Celle-ci peut avoir une incidence sur l’immunité dans la mesure où le zinc rentre en jeu dans le processus inflammatoire et dans la cicatrisation. La dose journalière recommandée par l’ANSES est de 15mg/j. Néanmoins, il paraît judicieux de préférer une dose de 5mg/j pour débuter afin de tester la « susceptibilité émétique ».
Le Cuivre : oligo-élément indispensable à la vie, au niveau cellulaire, le cuivre se retrouve impliqué dans plusieurs cascades enzymatiques et est présent dans certains superoxyde-dismutases, capitales dans la lutte contre les radicaux libres. La dose journalière recommandée par l’ANSES est située entre 1,5 à 2mg /j.
Le Fer : cet oligo-élément rentre dans la composition de l’hémoglobine des hématies et est par conséquent vital pour la respiration cellulaire, c’est-à-dire le transport de l’oxygène vers les organes cibles. La dose journalière recommandée par l ‘ANSES oscille entre 9 et 30mg/j chez l’adulte.
Le Manganèse : Le manganèse est nécessaire à la santé, mais devient toxique lorsque sa consommation est trop importante. En effet, le seuil limite défini par l’ANSES est de 4,2 à 10 mg par jour. La dose journalière recommandée est alors de 2 à 3 mg.
Au niveau parodontal
La littérature avance que des carences en Zinc (Orbak et coll 2007) (36), Cuivre et Fer constituent un facteur de risque sur la survenue de parodontopathies.
En effet, Zinc et Cuivre jouent un rôle d’inhibiteur sur la coaggrégation de Porphyromonas Gingivalis et donc sur sa pathogénicité (Tamura et coll 2009) (37), mais aussi sur Prevotella Intermedia et Prevotella Nigrescens ( Tamura et coll 2005) (38).
Le Fer quant à lui joue un rôle clé dans la différenciation cellulaire des cellules desmodontales (Hou et coll 2013) (39). Enfin, le Manganèse est essentiel à la synthèse de Superoxyde dismutases permettant de lutter contre le stress oxydant.
Discussion
La maladie parodontale constitue une pathologie multifactorielle dont la prise en charge thérapeutique peut s’avérer complexe. Il paraît alors judicieux de prendre en compte tous les paramètres rentrant en ligne de compte aussi bien dans son étiologie que dans sa pathogénie afin d’assurer un succès thérapeutique.
C’est pourquoi le parodontiste, tout comme l’omnipraticien, doit avoir une approche globale du patient et non rester focalisé uniquement sur sa cavité buccale. Cela permet de dépasser la simple prise en charge médicale de la parodontite en exploitant l’approche essentielle de la nutrition santé. On parle alors d’approche nutritionnelle dans la thérapeutique parodontale (Van der Velden 2011) (40).
Bibliographie
1. Listgarten MA. J Clin Periodontol. Pathogenesis of periodontitis 1986 May;13(5):418-30.
2. Socransky SS. Criteria for the infectious agents in dental caries and periodontal disease.
J Clin Periodontol.1979 ; 6 (7) : 16-21
3. Charon J. Parodontie médicale Innovations cliniques ÉDITIONS CDP Collection JPIO année 2009
4. Thomas LD, Elinder CG, Tiselius HG, Wolk A, Akesson A. Ascorbic acid supplements and kidney stone incidence among men: a prospective study. JAMA Intern Med. 2013 Mar 11;173(5):386-8. doi: 10.1001/jamainternmed.2013.2296
5. Glickman I. Acute vitamin C deficiency and the periodontal tissues; the effect of acute vitamin C deficiency upon the response of the periodontal tissues of the guinea pig to artificially induced inflammation. J Dent Res. 1948 Apr;27(2):201-10.
6. Amaliya, Timmerman MF, Abbas F, Loos BG, Van der Weijden GA, Van Winkelhoff AJ, Winkel EG, Van der Velden U. Java project on periodontal diseases: the relationship between vitamin C and the severity of periodontitis. J Clin Periodontol. 2007 Apr;34(4):299-304.
7. Staudte H, Kranz S, Völpel A, Schütze J, Sigusch BW. Comparison of nutrient intake between patients with periodontitis and healthy subjects. Quintessence Int. 2012 Nov-Dec;43(10):907-16.
8. Yan Y, Zeng W, Song S, Zhang F, He W, Liang W, Niu Z. Vitamin C induces periodontal ligament progenitor cell differentiation via activation of ERK pathway mediated by PELP1. Protein Cell. 2013 Aug;4(8):620-7. doi: 10.1007/s13238-013-3030-0. Epub 2013 Jul 8.
9. Akman S, Canakci V, Kara A, Tozoglu U, Arabaci T, Dagsuyu IM. Therapeutic effects of alpha lipoic acid and vitamin C on alveolar bone resorption after experimental periodontitis in rats: a biochemical, histochemical, and stereologic study. J Periodontol. 2013 May;84(5):666-74. doi: 10.1902/jop.2012.120252. Epub 2012 Jun 15.
10. Neiva RF, Al-Shammari K, Nociti FH Jr, Soehren S, Wang HL. Effects of vitamin-B complex supplementation on periodontal wound healing. J Periodontol. 2005 Jul;76(7):1084-91.
11. Esaki M, Morita M, Akhter R, Akino K, Honda O. Relationship between folic acid intake and gingival health in non-smoking adults in Japan. Oral Dis. 2010 Jan;16(1):96-101. doi: 10.1111/j.1601-0825.2009.01619.x. Epub 2009 Aug 28.
12. Nelson MA Jr, Chaudhry AP. Effects of tocopherol (vitamin E)-deficient diet on some oral, para-oral, and hematopoietic tissues of the rat. J Dent Res. 1966 Jul-Aug;45(4):1072-7.
13. Parrish JH Jr, DeMarco TJ, Bissada NF. Vitamin E and periodontitis in the rat. Oral Surg Oral Med Oral Pathol. 1977 Aug;44(2):210-8.
14. Singh N, Chander Narula S, Kumar Sharma R, Tewari S, Kumar Sehgal P. Vitamin E supplementation, superoxide dismutase status, and outcome of scaling and root planing in patients with chronic periodontitis: a randomized clinical trial. J Periodontol. 2014 Feb;85(2):242-9. doi: 10.1902/jop.2013.120727. Epub 2013 May 20.
15. Gebauer SK, Psota TL, Harris WS, Kris-Etherton PM. n-3 fatty acid dietary recommendations and food sources to achieve essentiality and cardiovascular benefits. Am J Clin Nutr. 2006 Jun;83(6 Suppl):1526S-1535S.
16. Da Young Oh, Saswata Talukdar, Eun Ju Bae, Takeshi Imamura, Hidetaka Morinaga, WuQiang Fan, Pingping Li, Wendell J. Lu, Steven M. Watkins, Jerrold M. Olefsky. GPR120 Is an Omega-3 Fatty Acid Receptor Mediating Potent Anti-inflammatory and Insulin-Sensitizing Effects. Cell Volume 142, Issue 5, 3 September 2010, Pages 687–698.
17. Naqvi AZ, Buettner C, Phillips RS, Davis RB, Mukamal KJ. n-3 fatty acids and periodontitis in US adults. J Am Diet Assoc. 2010 Nov;110(11):1669-75. doi: 10.1016/j.jada.2010.08.009.
18. Iwasaki M, Yoshihara A, Moynihan P, Watanabe R, Taylor GW, Miyazaki H. Longitudinal relationship between dietary ω-3 fatty acids and periodontal disease. Nutrition. 2010 Nov-Dec;26(11-12):1105-9. doi: 10.1016/j.nut.2009.09.010. Epub 2010 Jan 25.
19. Vardar S, Buduneli E, Türkoğlu O, Berdeli AH, Baylas H, Başkesen A, Atilla G. Therapeutic versus prophylactic plus therapeutic administration of omega-3 fatty acid on endotoxin-induced periodontitis in rats. J Periodontol. 2004 Dec;75(12):1640-6.
20. Kesavalu L, Vasudevan B, Raghu B, Browning E, Dawson D, Novak JM, Correll MC, Steffen MJ, Bhattacharya A, Fernandes G, Ebersole JL. Omega-3 fatty acid effect on alveolar bone loss in rats. J Dent Res. 2006 Jul;85(7):648-52.
21. Bendyk A, Marino V, Zilm PS, Howe P, Bartold PM. Effect of dietary omega-3 polyunsaturated fatty acids on experimental periodontitis in the mouse. J Periodontal Res. 2009 Apr;44(2):211-6. doi: 10.1111/j.1600-0765.2008.01108.x. Epub 2009 Feb 6.
22. El-Sharkawy H, Aboelsaad N, Eliwa M, Darweesh M, Alshahat M, Kantarci A, Hasturk H, Van Dyke TE. Adjunctive treatment of chronic periodontitis with daily dietary supplementation with omega-3 Fatty acids and low-dose aspirin. J Periodontol. 2010 Nov;81(11):1635-43. doi: 10.1902/jop.2010.090628. Epub 2010 Jun 23.
23. Elkhouli AM. The efficacy of host response modulation therapy (omega-3 plus low-dose aspirin) as an adjunctive treatment of chronic periodontitis (clinical and biochemical study). J Periodontal Res. 2011 Apr;46(2):261-8. doi: 10.1111/j.1600-0765.2010.01336.x. Epub 2011 Jan 25.
24. Figueredo CM, Martinez GL, Koury JC, Fischer RG, Gustafsson A. Serum levels of long-chain polyunsaturated fatty acids in patients with periodontal disease. J Periodontol. 2013 May;84(5):675-82. doi: 10.1902/jop.2012.120171. Epub 2012 Jul 6.
25. Dietrich T, Joshipura KJ, Dawson-Hughes B, Bischoff-Ferrari HA. Association between serum concentrations of 25-hydroxyvitamin D3 and periodontal disease in the US population. Am J Clin Nutr. 2004 Jul;80(1):108-13.
26. Dixon D, Hildebolt CF, Miley DD, Garcia MN, Pilgram TK, Couture R, Anderson Spearie C, Civitelli R. Calcium and vitamin D use among adults in periodontal disease maintenance programmes. Br Dent J. 2009 Jun 27;206(12):627-31; discussion 617. doi: 10.1038/sj.bdj.2009.519.
27. Miley DD, Garcia MN, Hildebolt CF, Shannon WD, Couture RA, Anderson Spearie CL, Dixon DA, Langenwalter EM, Mueller C, Civitelli R. Cross-sectional study of vitamin D and calcium supplementation effects on chronic periodontitis. J Periodontol. 2009 Sep;80(9):1433-9. doi: 10.1902/jop.2009.090077.
28. Garcia MN, Hildebolt CF, Miley DD, Dixon DA, Couture RA, Spearie CL, Langenwalter EM, Shannon WD, Deych E, Mueller C, Civitelli R. One-year effects of vitamin D and calcium supplementation on chronic periodontitis. J Periodontol. 2011 Jan;82(1):25-32. doi:10.1902/jop.2010.100207. Epub 2010 Sep 1.
29. Iwamoto Y, Nakamura R, Folkers K, Morrison RF. Study of periodontal disease and coenzyme Q. Res Commun Chem Pathol Pharmacol. 1975 Jun;11(2):265-71.
30. Wilkinson EG, Arnold RM, Folkers K. Bioenergetics in clinical medicine. VI. adjunctive treatment of periodontal disease with coenzyme Q10. Res Commun Chem Pathol Pharmacol. 1976 Aug;14(4):715-9.
31. Littarru GP, Nakamura R, Ho L, Folkers K, Kuzell WC. Deficiency of coenzyme Q 10 in gingival tissue from patients with periodontal disease. Proc Natl Acad Sci U S A. 1971 Oct;68(10):2332-5.
32. Prakash S, Sunitha J, Hans M. Role of coenzyme Q(10) as an antioxidant and bioenergizer in periodontal diseases. Indian J Pharmacol. 2010 Dec;42(6):334-7. doi: 10.4103/0253-7613.71884.
33. Rougier Y. Les nouveaux programmes hospitaliers de Nutrition-Santé. Importance du concept de l’équilibre Acide/Base et des Index-Minceur de nouvelles générations. Aliments et extraits alimentaires (Prunus mume-Oryza sativa) sélectionnés ayant développé une efficacité biologique versus placebo. Entretiens de Bichat 2008.
34. Meisel P, Schwahn C, Luedemann J, John U, Kroemer HK, Kocher T. Magnesium deficiency is associated with periodontal disease. J Dent Res. 2005 Oct;84(10):937-41.
35. Merchant AT. Higher serum magnesium:calcium ratio may lower periodontitis risk. J Evid Based Dent Pract. 2006 Dec;6(4):285-6.
36. Orbak R, Kara C, Ozbek E, Tezel A, Demir T. Effects of zinc deficiency on oral and periodontal diseases in rats. J Periodontal Res. 2007 Apr;42(2):138-43.
37. Tamura M, Ochiai K. Zinc and copper play a role in coaggregation inhibiting action of Porphyromonas gingivalis. Oral Microbiol Immunol. 2009 Feb;24(1):56-63. doi: 10.1111/j.1399-302X.2008.00476.x.
38. Tamura M, Hirano Y, Koruda K, Kuwata F, Hayashi K. Effects of zinc and copper on adhesion and hemagglutination of Prevotella intermedia and Prevotella nigrescens. Oral Microbiol Immunol. 2005 Dec;20(6):339-43.
39. Hou J1, Yamada S, Kajikawa T, Ozaki N, Awata T, Yamaba S, Fujihara C, Murakami S. Iron plays a key role in the cytodifferentiation of human periodontal ligament cells. J Periodontal Res. 2014 Apr;49(2):260-7. doi: 10.1111/jre.12103. Epub 2013 May 28.
40. Van der Velden U1, Kuzmanova D, Chapple IL. Micronutritional approaches to periodontal therapy. J Clin Periodontol. 2011 Mar;38 Suppl 11:142-58. doi: 10.1111/j.1600-051X.2010.01663.x.