Concepts actuels et nouvelles technologies
Les parodontites sont des maladies infectieuses polymicrobiennes de type mixte où sont incriminés des germes anaérobies présumés très parodontogènes (Costerton et coll.,1994). L’objectif premier de la thérapeutique parodontale consiste à contrôler le processus infectieux afin d’éviter la destruction tissulaire traduite au niveau du parodonte par la perte d’attache et la résorption osseuse.
Le schéma thérapeutique global se résume comme suit (schéma 1) :
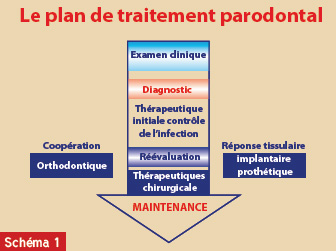
- La thérapeutique étiologique : enseignement des techniques d’hygiène, séances de détartrage et de surfacage radiculaires visant à éliminer mécaniquement le tartre et les biofilms sous-gingivaux ;
- La reévaluation parodontale et la validation du plan de traitement ;
- Phase chirurgicale parodontale : parfaire le débridement et/ou reconstruire ;
- Traitement multidisciplinaire ;
- Maintenance : fréquence établie en fonction du rythme d’évolution de la maladie et de l’hygiène du patient ;
Détartrage-Surfaçage : nouvelle définition
Les données biologiques actuelles concernant la structure bactérienne et la notion du cément infecté ont modifié nos comportements thérapeutiques et incité à des innovations technologiques plus adaptées à nos besoins. La notion de biofilm a redéfini l’organisation des colonies bactériennes et leur comportement, et la notion de l’élimination totale du cément contaminé est remise en question.
Notions

* Le biofilm (schéma 2) constitue une structure hautement spécialisée de la plaque dentaire. C’est un ensemble de micro-colonies bactériennes (15 à 20 % du volume) organisées dans une matrice d’exopolysaccharides (75 à 80 % du volume) sous forme de structure spatiale particulière permettant des dépendances nutritionnelles et un échange d’informations génétiques entre les bactéries. De multiples canaux de fluides traversent cette structure et contribuent à assurer les nutriments, à éliminer les produits métaboliques nocifs et à expulser les composants antimicrobiens.
* Le détartrage sous-gingival consiste à éliminer les dépôts tartriques adhérant aux surfaces radiculaires.
* Données acquises qui justifiaient le surfaçage agressif :
- Eliminer les endotoxines des couches profondes du cément et de la dentine (Jones et O’Leary, 1978) ;
- Assurer un état de surface le plus plisse pour éviter l’adhésion des endotoxines (Renvert et coll.,1990) ;
- Invasion du cément par des parodontopathogènes justifiant l’élimination totale du cément infecté (Adriaens et coll., 1988) ;
En revanche :
- Aucun moyen clinique ne nous permet de contrôler l’épaisseur retirée du cément ;
- 99 % des lipopolysaccharides (facteurs de virulence) peuvent être éliminés par simple rinçage à l’eau (Moore et coll., 1986) ;
- La coexistence bactérienne au sein du biofilm et leur mode de vie communautaire leur permet de ne plus se diviser et donc de développer une grande résistance aux agents antimicrobiens, antiseptiques et antibiotiques (Potera, 1999).
L’objectif thérapeutique prend aujourd’hui une autre définition; il incite à être plus économe dans l’ergonomie du temps et moins invasif dans l’élimination des tissus radiculaires infiltrés, tout en étant plus efficace… Le « surfaçage radiculaire » qui visait à cureter « le cément nécrotique et la dentine rugueuse » (Carranza, 1988) est remplacé par « une décontamination » de la surface radiculaire et de la poche qui vise à désintégrer mécaniquement le biofilm pour détruire la virulence des complexes bactériens, et à évacuer grâce à l’irrigation simultanée les résidus organiques responsables en partie de la destruction parodontale.
La nouvelle génération des micro-inserts ultrasoniques a permis également de remettre en question l’usage manuel systématique des curettes ; à résultat clinique égal l’usage de ces inserts technologiquement performants semble répondre à cette nouvelle notion du débridement radiculaire.
Les acquis de la thérapeutique non chirurgicale
Les effets cliniques de la thérapeutique non chirurgicale ont été bien démontrés dans :
- L’élimination du biofilm (Darveau et coll.,1997) et la réduction de l’inflammation
- La réduction de la profondeur des poches d’au moins 2 mm
- Le gain d’attache clinique supérieur à 1 mm (Cobb, 2002)
Ces modifications cliniques surviennent six semaines après l’instrumentation et se stabilisent à un ou trois mois plus tard. Elles sont plus significatives chez les non-fumeurs (Jin et coll., 2000) (Fig. 1, 2, 3, 4).
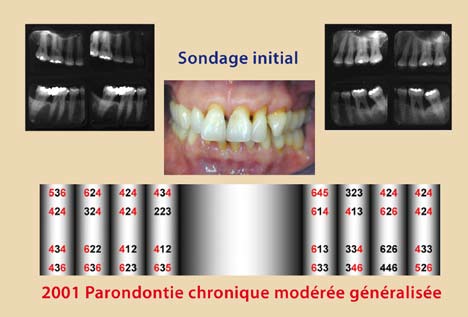
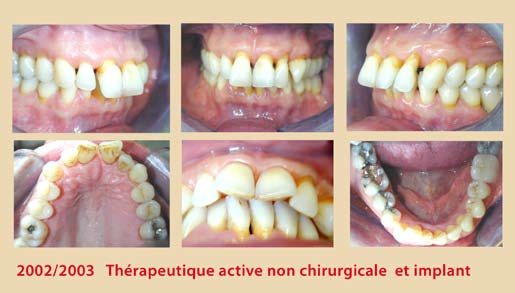
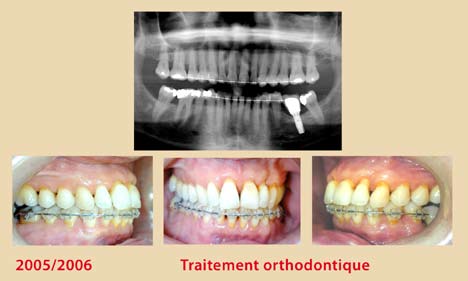

Néanmoins, cette thérapeutique non-chirurgicale a ses limites, surtout dans les poches profondes supérieures à 4 mm, où les difficultés d’accès et les contraintes de l’anatomie radiculaire deviennent plus imminentes (Cafesse et coll.,1986 – Badersten et coll.,1984). De plus, l’expérience du clinicien semble jouer un rôle critique dans le résultat final du débridement radiculaire et ce, quel que soit le type d’instrumentation ; curettes conventionnelles, instruments ultrasoniques ou combinaison des deux (Adriaens et Adriaens, 2004). A l’heure actuelle, la conception de l’instrumentation est en pleine évolution afin de remédier à ces obstacles et de faciliter la tâche au praticien.
La nouvelle instrumentation vs les curettes
Rappels
1. Les différents types de détartreurs
Les détartreurs soniques
- Les vibrations sont générées par une turbine à air ou une pièce à main ;
- Le mouvement de l’insert est principalement circulaire;
- De 2 500 à 16 000 Hertz,
- Soniflex®/Kavo
Les détartreurs à ultrasons « magnétostrictifs »
- Bandes métalliques ou barre ferro-magnétique,
- Création d’un champ magnétique au passage du courant,
- Le mouvement de l’insert est elliptique ;
- De 18 000 à 45 000 Hertz,
- Cavitron SPS®/Dentsply
Les détartreurs à ultrasons « piézoélectriques »
- Cristaux de quartz électriquement réactifs,
- Le mouvement de l’insert est linéaire ;
- Piezo master®/EMS, P-max®/Satelec
2. La cavitation (Fig. 5)
La cavitation et la micro-répartition sont le résultat du mouvement rapide ultrasonique qui conduit à un effet de turbulence autour de l’insert. Les bulles remplies de gaz ou de vapeur d’eau grandissent et implosent pour former des micro-bulles engendrant des ondes de choc. Dans les années 50, les chercheurs avaient l’impression que le contact direct de l’insert avec la surface radiculaire n’était pas nécessaire pour l’effet de nettoyage. Cependant, il a été montré que l’effet de cavitation est capable d’éliminer fortement la matière attachée. Ceci a lieu jusqu’à 0,5 mm de la pointe de l‘insert. En présence de sang, l’effet de cavitation peut également déclencher un effet thrombogénique. Cela peut expliquer la réduction de l’hémorragie qui se produit en travaillant avec les détartreurs à ultrasons.
3. L’aérosol
Aucune preuve n’est établie qu’un opérateur ou un patient ait jamais présenté une pathologie grave due à un aérosol.
Comparaison des détartreurs et des instruments manuels
Avantages
- plus facile
- plus rapide
- élimination rapide des colorations
- moins de fatigue pour l’opérateur
- meilleur accès dans les furcations
- légère pression
- irrigation de la poche parodontale avec des agents anti-microbiens
Inconvénients
- contamination par l’aérosol
- coût élevé
- réduction de la sensibilité tactile
- toutes les pièces à main ne peuvent pas être stérilisées
Contre-indications
- patient atteint de tuberculose
- système immunitaire déprimé
- émail décalcifié
- risque potentiel pour les patients porteurs d’un pacemaker
Choix de l’insert et modalités thérapeutiques
Le choix de l’insert dépendra en premier de la phase du traitement parodontal. Les phases essentielles du plan de traitement parodontal sont : la phase active chez des patients atteints de gingivite ou de parodontite, où est réalisé le maximum du débridement professionnel, la phase chirurgicale et la phase de maintenance. En second lieu, ce choix dépendra de l’adaptation de l’insert à la zone à traiter. Nombreux inserts sont disponibles dans des formes et tailles variés. La forme est conçue telle que la zone à nettoyer puisse être nettoyée de façon optimale. Pour l’élimination du tartre les inserts sont courts, plus larges et plus puissants.
Phase active de débridement profond chez des patients atteints de parodontite
Un débridement professionnel supra et sous-gingival est réalisé. L’anesthésie locale est conseillée et doit être systématique dans les poches profondes. Ainsi, pour un traitement parodontal en phase active au cours de laquelle la plaque et les dépôts tartriques doivent être éliminés, l’insert doit procurer un transfert d’énergie élevé, doit être large et donc réglé sur une puissance plus élevée. Il existe des inserts recouverts d’une couche diamantée (70μm) qui éliminent cinq fois plus de structure comparativement aux inserts conventionnels. Ils doivent être seulement utilisés en vision directe au cours de la chirurgie parodontale.
Phase active de traitement des gingivites et phase de la prophylaxie professionnelle
Le débridement professionnel de toute la bouche se fait en une seule séance.
Nouvelle génération d’inserts
Inserts lumineux : Actuellement, il existe des unités piézoélectriques avec des pièces à mains permettant une illumination de l’insert pour une meilleure visibilité
Inserts en plastique : Des inserts en plastique et en fibre de carbonne ont été conçus. Ils sont indiqués pour la maintenance parodontale et pour le nettoyage des implants.
Inserts à extrémité arrondie et émoussée : ces inserts permettent de nettoyer au niveau des furcations sans agresser les tissus fins à ce niveau. Ils présentent une petite sphère avec un diamètre de 0,8 mm à leur extrémité. Ils sont fabriqués avec deux orientations droite et gauche.
Inserts avec une forme de sondes : ce sont des inserts fins et élégants qui épousent la forme des sondes parodontales et qui permettent d’explorer la poche avant, pendant et après utilisation. Ils facilitent l’accès aux furcations et aux poches profondes.
Recommandations pour l’utilisation des instruments ultrasoniques
- Demander au patient de mettre la prothèse auditive en position « off » ;
- Faire rincer le patient avec un bain de bouche à la chlorhexidine avant le traitement ;
- Utiliser une irrigation suffisante pour éviter un suréchauffement de l’instrument et des surfaces dentaires ;
- Régler la puissance sur « moyen » ou « faible » ;
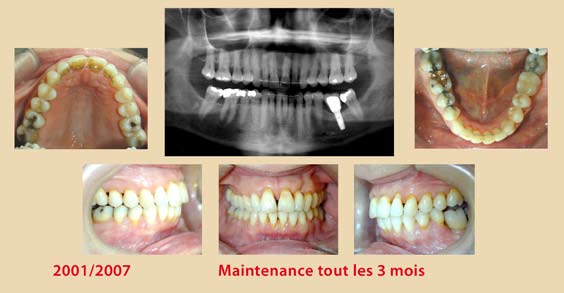
- Appliquer l’insert contre la surface dentaire avec un angle d’environ 15° (schéma 3) ;
- Ne jamais utiliser la pointe ;
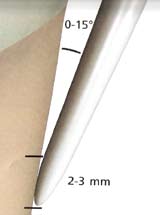
- Utiliser des mouvements de balayage par petites surfaces (schéma 4) ;
- Utiliser une force faible ;
- Employer une aspiration à fort volume pour réduire l’aérosol ;
- Ne pas tenir l’aspiration trop près de l’insert du détartreur pour éviter que l’irrigation ne devienne insuffisante ;
- Les instruments ultrasoniques ne doivent pas être employés avec des restaurations céramiques ;
- Utiliser un détartreur à ultrasons de manière brève sur les restaurations scellées.
Conclusion
L’approche actuelle du traitement de la surface radiculaire semble plus raisonnée et s’oriente vers une ablation douce du cément infecté et une désadhésion du biofilm. On cherche plutôt à décontaminer pour rétablir les conditions optimales d’équilibre hôte-bactéries. Comme les endotoxines sont peu adhérentes, on pourrait obtenir des parois assainies sans « sur instrumentation ». Reste la question de la quantité du cément à décontaminer. Cela dépendra du nombre de passage de l’instrumentation (Cadosh et coll., 2003), de la force exercée, de la pression latérale appliquée et de l’angulation de l’instrument. Cinq à dix passages d’instrumentation avec une force de 3 N semble être un bon compromis.
Il est établi également que la rugosité de surface décroît en fonction du matériel utilisé : curette manuelle < curette ultrasonique < fraise diamantée. En conclusion, la combinaison de différents instruments à efficacités spécifiques réaliserait le meilleur compromis. Dans la phase active, l’instrumentation manuelle manuelle avec les curettes semble judicieuse alors que pour les séances de maintenance, la nouvelle instrumentation ultrasonique suffirait. L’usage des nouveaux générateurs à puissance diminuée et à fréquence de vibration augmentée est plus conservateur pour les tissus. Ce nouveau matériel présente l’avantage d’associer des agents antiseptiques qui accélèreraient le rétablissement de l’état de santé parodontale.
Bibliographie
1. Costerton JW, Lewandowski Z, De Beer D, Caldwell D, Korber D, James G. Biofilms, the customized microniche. J Bacteriol 1994 ; 176 : 2137-2142
2. Jones W, O’Leary T. The effect of in vivo root planning in removing bacterial endotoxin from the roots of periodontally involved teeth. J Periodontol 1978; 41: 419-423
3. Renvert S, Nilveus R, Dahlen G, Slots J Egelberg J. 5-year followupof peiodontal intraosseous defects treated by root planning and flap surgery. J Clin Periodontol 1990; 17: 356-363
4. Adriaens PA, Edwards GA, De Boever JA, Loesche WJ. Ultrastructural observations on bacterial invasion in cementum and radicular dentin of periodontally diseased human teeth. J Periodontal 1988; 59: 493-503
5. Moore J, Wilson M, Kieser JB. The distribution of bacterial lipopolysaccharide (endotoxin) in relation to periodontally involved root surfaces; J Clin Periodontol 1986; 13: 748-751
6. Potera C. Forging a link between biofilms and disease. Science 1999; 283: 1837-1839
7. Carranza FA. La parodontologie clinique selon Glickmann 1998 pp682 CDP ed
8. Darveau RP, Tanner A, Page RC. The microbial challenge in periodontitis. Periodontol 2000 1997; 14: 12-32
9. Cobb CM. Clinical significance of non-surgical periodontal therapy: an evidence based perspective of scaling and root planning. J Clin Periodontal 2002; 29(2): 6-16
10. Jin L, Wong KY, Leung WK, Corbet EF. Comparaison of treatment response patterns following scaling and root planning in smokers and non-smokers with untreated adult periodontitis. J Clin Dent 2000; 11: 35-41
11. Caffesse RG, Sweeney PL, Smith BA; Scaling and root planning with and without periodontal flap surgery. J Clin Periodontol 1986, 13: 205-210
12. Badersten a, Nilveux R, Egelberg J. Effect of non surgical periodontal therapy. II; Severely advanced periodontitis. J Clin Periodontol 1984; 11: 63-76
13. Adriaens PA, Adriaens LM. Effects of non surgical periodontal therapy on hard and soft tissues. Periodontol 2000 2004; 36: 121-145
14. Cadosh J, Zimmerman U, Ruppert M, Guindy J, Case D, Zappa U. Root surface debridement and endotoxin removal. J Periodontal Res 2003; 38: 229- 236
15. Fridus VDW. Le monde fascinant des ultrasons. 2007 ; Quintessence International



Un commentaire
Bonjour
Atteinte d’une parodontie j’aimerais savoir quelle est la différence entre un détartrage sous gingival et un surfaçage l’un étant pris en charge par la SS et l’autre m’étant facturé entre 600 et 850 euros 😉
cdt
laurence